28例胎儿颈部淋巴水囊瘤预后分析
鲁建央,朱惠青,王志华,翟洪波
随着世界范围内胎儿颈项透明层厚度(NT)超声的普及,早中孕期胎儿颈部淋巴水囊瘤(CCH)的检出率不断提高,临床上对CCH预后进行咨询的案例不断增加,孕妇及家属可能直接根据咨询结果决定是否继续妊娠[1]。国内外对NT增厚的研究报道较多,但关于产前发现CCH胎儿预后的研究仍较少。笔者收集产前超声发现的28例CCH病史资料,并结合相关文献进行分析,旨在帮助临床医师进一步了解CCH的预后。现将报道如下。
1 资料与方法
1.1 一般资料 收集 2016年 1月至2017年 9月在杭州市第一人民医院产前诊断超声发现的28例CCH孕妇。所有孕妇均自愿参加本院疑难病例多学科专家组讨论,同意接受后续的跟踪随访,及利用数据进行临床研究。本研究经过医院伦理委员会同意。
1.2 研究方法 对普通产科超声提示CCH的孕妇,建议其到遗传咨询门诊就诊,申请本院产前超声诊断(由2名副主任及以上职称的具有产前诊断资质的超声专家共同检查)。根据孕周,知情同意进行侵入性产前诊断胎儿染色体核型和/或 SNP-Array检测。若胎儿无多发畸形且染色体正常,定期产检,动态超声观察胎儿情况,分娩后随访新生儿。若胎儿染色体异常和/或多发畸形,参加疑难病例多学科讨论,孕妇及家属知情同意选择终止妊娠或继续妊娠。跟踪随访妊娠结局及新生儿的情况。
1.3 统计方法 采用SPSS 19.0统计软件进行统计学分析,计量资料用均数±标准差表示,采用 检验;计数资料采用2检验。<0.05为差异有统计学意义。
2 结果
2.1 一般资料 孕妇年龄21~38岁,平均(28.9±4.1)岁,高龄占 10.7%,诊断CCH的孕周 12~ 26周, 平均(15.5±4.0)周,60.7%的患者进行NT超声检查时得到确诊。
2.2 CCH形态特点 89.3%的CCH有分隔(图1),10.7%无分隔。46.4%CCH合并全身软组织水肿,21.4%合并心脏畸形;见表1。
2.3 染色体结果 14例患者接受了胎儿染色体检查,其中8例(57.1%)确诊为染色体非整倍体异常(表2),2例为染色体片段微重复,4例CCH胎儿染色体核型结果正常。
2.4 妊娠结局 22例(78.6%)选择终止妊娠,5例(17.8%)足月分娩,1例继续妊娠严密随访中。2例新生儿颈部未见异常,3例新生儿颈部均有水囊瘤,最大者约7.0cm×6.0 cm×4.0 cm,其中2例在出生后6个月左右消退,无需手术治疗,1例失访。目前足月分娩可随访的4例中,婴儿最小者3个月,最大者15个月,电话随访尚未发现异常。
3 讨论
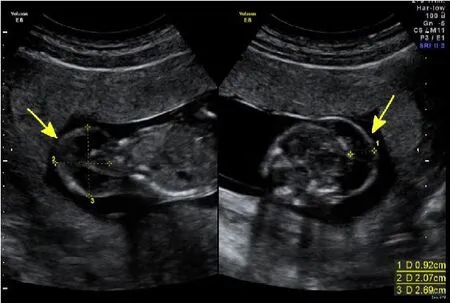
图1 孕14周有分隔的淋巴水囊瘤,通过胎儿颈部的横断面,可见颈部皮肤及皮下组织的分隔
目前,CCH在早中孕期的检出率不断提高,与NT超声在世界范围内的推广有关。1997 年Nicolaides等[2]在Lancet发表了利用NT厚度筛查唐氏儿的研究成果,同时发现了早孕期超声筛查胎儿结构异常的可行性。2013年国际妇产科超声学会指南推荐,有条件的医疗单位在孕11~13+6周进行早孕期胎儿超声结构筛查[3]。本文中多数孕妇在进行NT超声时发现CCH伴多发畸形,再次说明NT超声同时进行胎儿结构筛查的可行性与重要性。
CCH的发生机制与胎儿淋巴系统的发育异常相关。孕6~10周为胎儿淋巴系统发育的关键时期,从原始淋巴囊开始发育,发出淋巴管,形成淋巴系[1,4]。若原始淋巴囊汇入静脉系统失败,淋巴液积聚,淋巴管道阻塞扩张,最终形成水囊状淋巴管瘤。这种淋巴液的淤积除了导致颈部淋巴管过度膨胀外,也可使躯干及全身毛细淋巴管扩张,引起全身水肿。国内外产科领域的学者认为 CCH是胎儿染色体异常或先天畸形最早期的表现之一[5-7]。染色体异常的概率波动在40%~ 70%,最常见的染色体异常为Turner综合征、21-三体综合征、18-三体综合征及13-三体综合征等。本研究中CCH胎儿染色体异常率为57.1%,与相关文献报道基本吻合。本研究中未发现21-三体综合征,考虑与纳入的病例数较少有关。即使染色体核型正常,CCH胎儿也可能发生罕见的遗传综合征或常染色体隐性遗传病[8-9]。因此,对CCH孕妇进行遗传咨询时,需详细告知孕妇及家属所提供的产前诊断技术的优势及局限性,在没有先证者的情况下,有些遗传性疾病在孕期并不能得到诊断。
CCH胎儿常合并水肿及多发畸形,最常见的为心脏畸形。CCH胎儿水肿的发生与多因素相关,主要原因为染色体异常导致淋巴系统发育的异常。国内学者王学举等[10]最近报道,33例非免疫性胎儿水肿中,染色体异常占21.21%,包括 21-三体、18-三体、13-三体及Turner综合征等。与单纯的NT增厚相比,CCH与心脏畸形的关系更加密切,CCH胎儿先心病的发生率为25%,风险升高12倍[11]。这是因为当胎儿存在先天性心脏病时,可能存在静脉回流障碍,引起颈静脉压力升高;当压力高于淋巴管内压力时,会造成淋巴液回流障碍,在胎儿颈部淤积,导致淋巴水囊瘤形成。
2014年《染色体微阵列分析技术在产前诊断中的应用专家共识》提出,产前超声发现胎儿结构异常是进行染色体微阵列分析的适应证[12]。饶腾子等[7]对早孕期 CCH胎儿的绒毛进行染色体核型和微阵列分析,发现除了18例胎儿染色体非整倍体异常外,额外检出4例致病性拷贝数变异(CNVs)。在本研究中,因纳入的病例数量有限,故尚未发现明确意义的致病性CNV。作者认为:因早孕期CCH染色体异常率较高,故染色体核型分析仍是单纯性 CCH胎儿查找病因的主要方式;若合并其他的结构异常,微阵列分析可作为更进一步的补充检查手段。
在妊娠结局方面,有文献报道CCH胎儿足月分娩率波动在7.5%~18.8%[5-6];本文CCH胎儿足月分娩率为17.8%,随访时间最长为产后15个月。因此,笔者建议,门诊面对孕妇及家属咨询CCH胎儿预后时,可告知早中孕期CCH胎儿健康分娩的概率约为20%。
综上所述,早中孕期CCH胎儿染色体异常发生率较高,与水肿及心脏畸形密切相关。若孕妇咨询CCH胎儿预后,首先,告知需行侵入性产前诊断胎儿染色体核型分析,目的为明确是否存在胎儿染色体非整倍体异常,必要时行染色体微阵列分析排除致病性拷贝数变异。如果染色体正常,则需在孕20周~24周之间行系统超声筛查胎儿是否有重大结构畸形。鉴于CCH胎儿心脏畸形的风险较NT增厚胎儿明显增加,完善胎儿超声心动图是非常必要的。

表1 23例非单纯性CCH胎儿合并其他结构异常情况 =28

表2 8例CCH胎儿染色体非整倍体情况

