TMEM196基因甲基化及其在肺癌发生中的作用研究
王丹妮 汪雪雁 伍志灵 陈春 秦胜芳 欧敏
在我国,肺癌占所有恶性肿瘤死亡的20%以上[1]。DNA甲基化是表观遗传学的主要调控方式之一,已有大量研究证实了DNA甲基化与恶性肿瘤发生、发展的密切关联[2]。有学者发现,跨膜蛋白147(TMEM147)和TMEM207分别与直肠癌细胞增殖、胃癌细胞迁移浸润有关,作为与上述基因同族类似的跨膜蛋白,TMEM196亦具有细胞分化、移行、同型粘附调控作用,文献报道其在肺癌的增殖、侵袭等过程中扮演了重要角色[3-4]。此次研究选取60例肺癌组织标本及30例正常肺组织标本,观察TMEM196基因甲基化及其在肺癌发生中的作用。
1 材料与方法
1.1 仪器与试剂
主要仪器:单细胞凝胶电泳图像分析系统(英国Perceptive公司);聚合酶链式反应(PCR)基因扩增仪(德国Eppendorf公司)。
主要试剂:石蜡包埋组织基因组快速提取试剂盒(DP330,北京天根生化科技有限公司);Wizard基因组DNA纯化试剂盒(美国Promega公司);5-氮-2’-脱氧胞苷(5-Aza-Cd,美国Sigma公司);Trizol总RNA提取试剂(美国Invitrogen公司)。
1.2 标本来源
在获取医院伦理委员会批准并征得受试者知情同意后,选取60例肺癌组织标本及30例正常肺组织标本,肺癌标本均经病理组织学检查明确病理分型,标本取样前受试者均无放化疗治疗史。于美国典型培养物保藏中心(ATCC)采购10株肺癌细胞株,分别为H1975、H446、H1395、95D、LTEP、A549、SPC-A-1、H358、H460 及 H1650,于10% FBS PRMI-1640培养基中培养,培养温度37℃,二氧化碳浓度5%。
1.3 DNA提取及甲基化分析
参照DP330试剂盒使用说明书自石蜡组织标本中提取DNA,以亚硫酸氢钠行基因组DNA修饰处理,对修饰后的DNA行纯化、回收,参照相关文献设计甲基化特异性聚合酶链式反应(MSP)非甲基化引物(U)及甲基化引物(M)[5],详见表1。将修饰后的DNA行PCR扩增,以亚硫酸氢盐测序聚合酶链式反应(BSP)分析扩增产物的电泳、切胶和纯化结果,结果判断标准[6]:应用M引物后可见扩增产物说明存在DNA甲基化,应用U引物后可见扩增产物说明不存在DNA甲基化,应用M引物、U引物后均可见扩增产物说明存在部分DNA甲基化。

表1 甲基化特异性聚合酶链式反应非甲基化引物及甲基化引物序列设计
1.4 去甲基化
将TMEM196基因甲基化的肺癌细胞株置于含10%小牛血清的RPMI 1640培养基中孵育,培养温度37℃,二氧化碳浓度5%。以适宜密度接种对数期生长细胞,24 h后添加5-Aza-Cd行去甲基化处理,终浓度分别为2 μM、5 μM及10 μM,待24 h后丢弃培养液,重新加入对应浓度的5-Aza-Cd培养液,重复2次。对照组细胞以不含5-Aza-Cd的同体积培养液处理。于第4 d采集上述培养细胞,进行mRNA提取及mRNA表达分析。
1.5 mRNA提取及mRNA表达分析
采用Trizol法提取肺癌组织细胞株RNA,行定量逆转录-聚合酶链式反应(qRT-PCR)分析,包括引物合成、逆转录cDNA第一链合成、PCR反应三个步骤[7],引物合成序列设计详见表2。使用1.5%琼脂糖凝胶电泳分离PCR产物,凝胶成像分析系统成像并保存结果。

表2 TMEM196基因及β-actin引物序列设计
1.6 分析指标
观察肺癌组织、正常组织TMEM196基因甲基化率,比较不同临床病理特征肺癌患者肺癌组织TMEM196基因甲基化率,并分析肺癌细胞株TMEM196基因甲基化率及5-Aza-Cd去甲基化处理后TMEM196基因表达情况。统计软件使用SAS9.2。
2 结果
TMEM196经PCR测序及MSP检测,肺癌组织TMEM196基因甲基化率为58.33%(35/60),正常组织均未见TMEM196基因甲基化,组间比较差异有统计学意义(P< 0.05)。
TMEM196不同分化程度、临床分期肺癌患者肺癌组织TMEM196基因甲基化率比较,差异有统计学意义(P<0.05)。见表3。
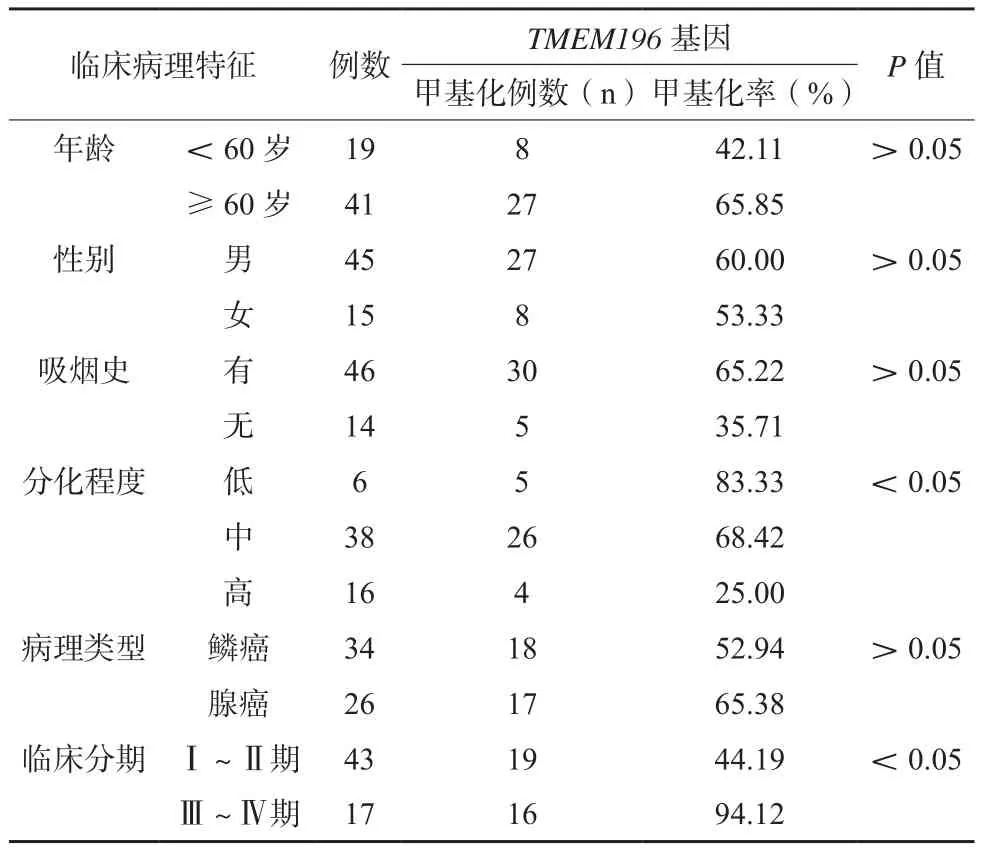
表3 不同临床病理特征肺癌患者TMEM196基因甲基化率比较(n/%)
TMEM196以正常上皮组织细胞为参照,根据β-actin计算肺癌TMEM196基因相对表达量,结果显示,去甲基化处理前,除H358细胞株外,其余9株肺癌细胞株TMEM196基因表达均缺失;去甲基化处理后,全部肺癌细胞株TMEM196基因表达均明显升高。见表4。

表4 肺癌细胞株MEM196基因表达量变化分析(相对表达量)
3 讨论
导致肺癌患者生存质量较差的重要原因为早期确诊率偏低,肺癌复杂的发病机制以及可靠早期诊断方法的欠缺,是影响患者生存时间的主要原因,因此,近年来临床愈发注重肺癌发病机制的探索以及早期诊断方法、靶向治疗思路的研究[8-9]。
既往关于肿瘤表观遗传学的研究结论指出,杂合性缺失、基因突变以及DNA甲基化均为肿瘤发生的常见因素[10],其中,DNA甲基化是最为重要的表观遗传修饰方式,该过程主要由甲基转移酶催化主导,甲基基团以共价结合方式移动至鸟嘌呤(CpG)、胞嘧啶及二核苷酸胞嘧啶,可导致原癌基因激活、染色体稳定性下降、转座子表达异常,并诱发抑癌基因大量失活[11-12]。大量研究显示,结肠癌癌前病变时已可检出HPP1基因甲基化,而VEZT启动子区甲基化可导致VEZT基因表达量大幅下降[13-15]。TMEM196基因定位于染色体7P21.1,与HPP1、VEZT基因跨膜结构类似,且已有体外研究发现TMEM196基因在肺癌组织中启动子区域CpG岛可见明显甲基化[16],说明这一基因可能在肺癌的发生发展中扮演了重要角色。本研究正常组织中TMEM196基因均未见甲基化,而肺癌组织TMEM196基因甲基化率高达58.33%,说明TMEM196基因甲基化在肺癌发生过程中具有普遍性。与此同时,随着患者分化程度的下降以及临床分期的上升,其肺癌组织TMEM196基因甲基化率呈上升趋势,提示TMEM196基因甲基化可能参与了肺癌的分化、增殖、侵袭等多个过程,与肺癌的进展亦具有密切关联。
基因启动子区的甲基化主要对基因的转录和表达产生抑制作用[17],而上述研究结果仅可显示TMEM196基因在肺癌组织中表达情况,无法证实TMEM196基因甲基化对其表达调控的影响。通过后续去甲基化试验,可以发现去甲基化处理后TMEM196基因表达明显上调,说明TMEM196基因甲基化是影响该基因表达的主要原因。可以认为,在肺癌发生的过程中,TMEM196基因甲基化是导致基因表达下调甚至失活的主要原因[18],且随着病情进展,TMEM196基因表达呈进一步下降趋势。因此,TMEM196可能是针对肺癌的候选抑癌基因,进一步探索TMEM196参与肺癌发生发展的具体机制,有望为肺癌的早期诊断、疗效评估及靶向治疗提供更为全面的思路。

