ADC值对脑胶质瘤放化疗效果评价
刘良进 吴良龙
脑胶质瘤患者全切术后复发、进展风险较高[1]。术后放化疗综合治疗尤为重要,但放化疗所致血管内皮损伤常使术野边缘区域影像学表现与胶质瘤进展难以区分,影响疗效判断及治疗策略的调整[2]。弥散加权成像(DWI)可通过了解活体组织内水分子弥散运动,判断组织结构和细胞特性的变化,其表观扩散系数(ADC值)评估胶质瘤治疗效果已有文献报道[3-4]。本研究分析采用ADC值判断脑胶质瘤放化疗效果的效能。
1 资料与方法
1.1 一般资料
自2014年8月至2017年6月于我院接受脑胶质瘤全切术后接受放化疗综合治疗[5]患者中抽取87例,患者签署书面同意后纳入此次前瞻性研究。患者年龄21~79岁,平均(43.15±8.72)岁,组织学分级[6]:Ⅱ级11例(弥漫性星形细胞瘤9例,少突-星形细胞瘤2例),Ⅲ级26例(间变型星形细胞瘤20例,间变型少突-星形细胞瘤6例),Ⅳ级50例(多形性胶质母细胞瘤50例)。
1.2 影像学检查
治疗前和放化疗3周后,使用美国GE 1.5T HDX MR扫描仪,行 T1Flair、T2WI、T2Flair,DWI及 T1Flair增强扫描。扫描参数:T1Flair:重复时间(TR)1975ms,回波时间(TE)24ms,反转时间(TI)760 ms;T2WI:TR3880ms,TE102ms;T2Flair序列:TR7500ms,TE 155 ms,反转时间(TI)1900 ms。增强扫描对比剂使用二乙三胺五乙酸钆络合物(Gd-DTPA),经肘前静脉注入,剂量0.1 mL/kg,速率2.5 mL/s。T1Flair增强扫描参数:TR 1975 ms,TE 24 ms,TI 760 ms。DWI扫描参数[7]:b值为1000 s/mm2,选择单次激发SE-EPI序列,TR3700 ms,TE 80 ms,视野(FOV)220 mm×220 mm,矩阵128×128。上述序列层厚均为6.5 mm,层间隔均为1.3 mm。
1.3 图像分析
将原始图像导入Advantage Workstation4.5,GE Medical Systems工作站(美国GE公司),选择T1Flair增强图像中病灶强化实性成分面积最大的层面并在其对应DWI图像中勾画感兴趣区(ROI),测量病灶ROI内平均ADC值(ADCmean)及最小ADC值(ADCmin),并以同层面对侧正常脑白质区域ADC值(nADC)为参照,计算病灶相对ADC值(rADC)[8],rADCmean=ADCmean/nADCmean;rADCmin= ADCmin/nADCmin。
1.4 6个月疗效随访
放化疗结束后6个月参照文献相关标准[9]评价病情变化。病情稳定为MRI未见新增病灶,异常增强病灶体积缩小<50%或增大<25%,且病变范围较治疗前缩小或稳定;进展为MRI可见新增病灶,异常病灶体积增大≥25%,或病变范围较治疗前增大并伴临床症状恶化。多发肿瘤者,以疗效最差病灶计。
1.5 ADC值的效果评价效能分析
按照1.4分组,比较进展组、稳定组患者ADCmean、ADCmin、rADCmean、rADCmin值差异,绘制受试者工作特征曲线(ROC),分析组间比较存在统计学差异的指标预测脑胶质瘤放化疗后进展的曲线下面积(AUC)及灵敏度、特异性。

图1 女,56岁,右侧顶叶胶质瘤治疗前后,A为治疗前感兴趣区ADC图像,B为手术后放化疗3周后复查感兴趣区ADC图像
2 结果
6个月后稳定49例,进展38例。进展组ADCmean、rADCmean低于稳定组,差异有统计学意义(P<0.05)。见表1。治疗后无进展典型图如图1所示。
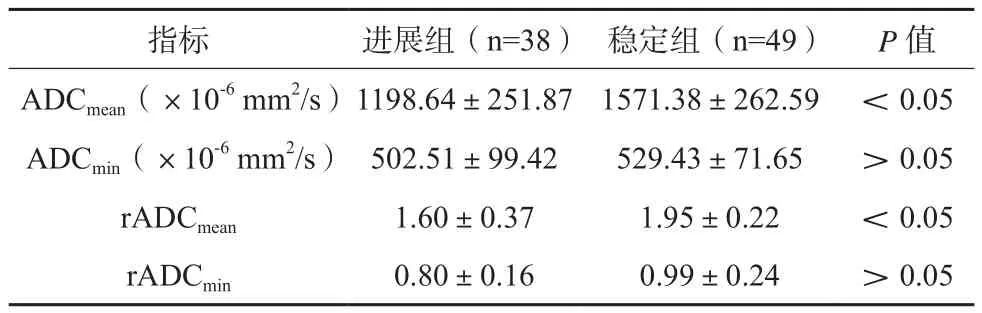
表1 进展组与稳定组放化疗后ADC值比较(x±s)
ROC曲线见图2,ADCmean预测脑胶质瘤放化疗后进展的AUC为0.671,以ADCmean=1227.81×10-6mm2/s为截断值,其灵敏度、特异性分别为88.15%、72.36%;rADCmean预测脑胶质瘤放化疗后进展的AUC为0.733,以rADCmean=1.75为截断值,其灵敏度、特异性分别为92.81%、78.44%。

图2 ADCmean、rADCmean预测放化疗效果的ROC曲线
3 讨论
ADC值是反映组织内水分子弥散能力的量化指标[10],ADC值越大,则水分子弥散能力越强,而脑胶质瘤细胞密度较大、细胞排列紧密,故细胞内水分子弥散运动往往受到明显限制并表现为ADC值的下降[11]。
随着b值升高,DWI对水分子运动的敏感性有所上升,但b值过大可造成DWI信号衰减模式变化,甚至导致图像变形或偏移[12],因此,本次研究选取b值=1000 s/mm2。进展组ADCmean、rADCmean均低于稳定组,与肿瘤进展所致水分子扩散障碍和扩散受阻有关[13]。
本研究于增强图像中病灶强化实性成分面积最大的层面对应DWI图像中最大的层面勾画ROI,亦有学者将手术区边缘2 cm内手动选择ROI,并发现脑胶质瘤复发灶多位于原发灶边缘2 cm内,ROI的不同也使得ADC值评价放化疗效果的AUC存在差异[14-15]。因此,在今后的临床研究中,可尝试探索不同ROI、不同b值对ADC值评价脑胶质瘤放化疗效果的效能的影响,寻求更为准确、可靠的截断值。需要注意的是,有研究认为,若病灶区域存在较大范围坏死和血管源性水肿,也可造成ADC值明显升高[116],故单纯根据ADC值评估肿瘤进展存在一定局限性,仍存在较大优化空间。
总体而言,ADC值可为脑胶质瘤放化疗效果的评价提供参考,随着ADC值的下降,脑胶质瘤细胞的密度有所增加,故ADC值的下降可能与肿瘤进展有关。如ADC值降低者,应考虑脑胶质瘤细胞进展,并及时调整综合治疗方案;若患者ADC值较高但MRI检查可见疑似进展征象,其原因可能与脑胶质瘤术后放射性损伤有关[17-18],此时可适当控制综合治疗时间、避免不必要的放射性损伤及费用。

