牛关节软骨细胞外基质材料的制备
刘民 ,贾帅军 ,高祎 ,赵成相 ,李丹
1.空军军医大学西京医院全军骨科研究所,陕西西安 710032;2.西安市红会医院脊柱病院,陕西西安 710054
创伤、感染及退变等多种因素均能引发关节软骨损伤,由于成熟关节软骨不具有血管结构,通过其自身修复的几率较低[1-2],而且大量的临床实践表明通过保守及手术方式都无法获得较满意的临床结果。 近些年,组织工程方法为关节软骨缺损修复提供了一种极具希望的治疗策略[3-4]。人类关节软骨是由少量的软骨细胞和大量细胞外基质构成,而关节软骨的细胞外基质(articular cartilage extracellular matrix,ACECM)主要成分有胶原及蛋白聚糖等生物活性成分[5]。通过复合方法获得的ACECM去除了供体细胞成分,大大降低了其免疫原性,同时保留了大量基质中的胶原及粘多糖成分。ACECM作为具备好生物相容性和生物活性的天然生物材料,在组织工程软骨修复领域具有广阔的应用前景[4,6]。基于该实验室前期的实验探索及牛膝关节丰富的来源,该实验就来源于成年牛膝关节(5只10个膝关节)的ACECM支架材料制备及其特性进行研究,以期为临床应用奠定实验基础。
1 材料与方法
1.1 关节软骨取材与颗粒粉碎
①在无菌环境中以手术刀仔细切取牛关节软骨,用含有抗生素(青霉素及链霉素双抗)的PBS溶液将获得的关节软骨薄片冲洗3次,置于超净细胞培养太中晾干;随后使用液氮浸没干燥后的关节软骨薄片,迅速将硬化后的软骨片投入粉碎机,高速粉碎后小心收集获得的软骨颗粒。用含有抗生素的PBS溶液溶解粉碎的软骨颗粒,通过400目筛网过滤后以高速离心机(Beckman,Avantij-25,Germany)离心(4℃,18 000 rpm,10 min),弃上清,收集沉淀即获得丰富的软骨颗粒(直径<150 μm)[7]。
②溶解脱细胞:采用含0.25%胰蛋白酶、0.1%乙二胺四乙酸(EDTA)及青霉素-链霉素双抗的PBS再次溶解粉碎的软骨颗粒,震荡搅拌1 h(37℃)后高速离心(4℃,7 000 rpm,5 min),用PBS洗涤沉淀3次;随后将收集的软骨颗粒加入含0.1 mmol/L苯甲基磺酰氟(PMSF)、0.1%EDTA、1%TritonX-100和双抗的0.01 mol/L三羟甲基氨基甲烷-盐酸(Tris-HCL)缓冲液中(pH 7.5),持续搅拌24 h(4℃),高速离心后弃去上清液,用PBS洗涤沉淀3次后加入含 50 U/mL DNA 酶 1(DNase l)、1 U/mL RNA 酶 A(RNase A)和青霉素-链霉素双抗的缓冲液中,随后持续搅拌12 h(37℃),高速离心后弃去上清液,用PBS洗涤沉淀3次[8]。以上各试剂均购自Sigma公司。
③冻干保存:将脱细胞的ACECM倒入1 000 mL烧杯中,以500 mL蒸馏水充分搅拌溶解洗涤,依据实验设计分为 3组,分别搅拌 1 h、2 h、4 h,重复离心洗涤 3次。 -20℃条件下冷冻24 h,随后-80℃冷冻l h后置于冷冻干燥机中(Alpha 2~4,Chaist,Germany)冻干。
1.2 组织学观察
采用4%多聚甲醛溶液固定冻干获取的材料,然后梯度酒精脱水,常规石蜡包埋后切片行HE、甲苯胺蓝和免疫荧光染色,分别在光学显微镜及荧光显微镜下进行观察。
1.3 扫描电镜 (scanning electron microscope analysis,SEM)观察
制备的ACECM材料分别切割成1×1×1 cm3大小(n=6),离子溅射仪表面喷金,SEM(S-3400N,Hitachi,Tokyo,Japan)观察基质材料微观结构;分别测定每组材料孔隙测定直径,结果以均数±标准差表示。
1.4 ACECM复合软骨细胞
按照参考文献中的方法分离、扩增培养2周龄新西兰兔关节软骨细胞。将3组ACECM材料均切割成直径5 mm、厚度5 mm的圆柱体,按照每个ACECM支架接种7.0×105个细胞分别进行接种;体外培养24 h后以2.5%戊二醛4℃固定4 h、丙酮梯度脱水、离子溅射仪表面喷金,利用SEM观察软骨细胞在ACECM材料上的形态及分布;同时使用3组ACECM材料浸提液和正常培养基分别培养兔软骨细胞,采用MTT法检测制备的ACECM对软骨细胞增殖影响[5]。
2 结果
大体观察切取的牛关节软骨薄片光滑而具有光泽,呈乳白色、半透明玻璃样外观(图1A);提取的ACECM混悬液呈乳白色,黏稠状;冻干后的ACECM材料呈多孔海绵样(图 1B)。
2.1 组织学观察
HE染色结果显示ACECM材料在镜下呈微小细丝状,相互结合成多孔网状结构,基质纤维及碎片颗粒则呈现红色,但未观察到软骨细胞的残留(图1C)。甲苯胺蓝染色结果显示ACECM材料呈阳性(图1D),提示材料中保留了大量的粘多糖成分。由于ACECM材料中含有大量II型胶原纤维,可以被激发出红色荧光,呈现贯通网状结构(图1E)。大体观察及组织学染色结果显示,冻干ACECM材料呈多孔海绵状外观,含有丰富的粘多糖其胶原纤维相互连接构成网状结构。
2.2 SEM观察冻干
ACECM材料呈均匀网状多孔结构,并有微孔相互连接(图 1F);孔隙直径为(105.2±20.3)μm。
2.3 SEM观察细胞粘附
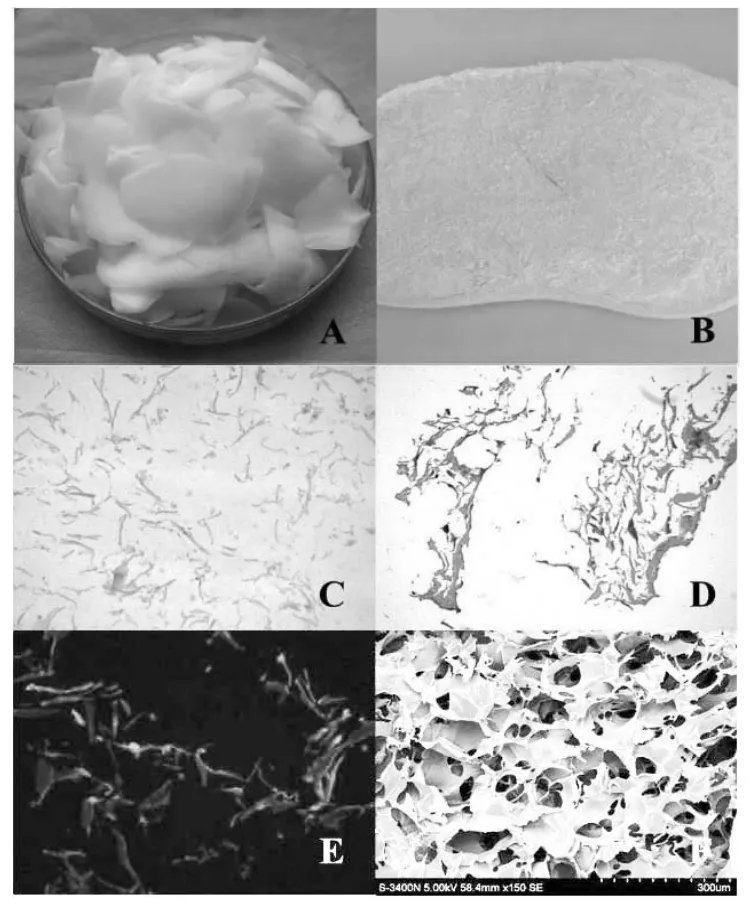
图1 软骨细胞外基质镜下观察Figure1 Observation of ACECM
SEM观察显示,接种的软骨细胞在3组ACECM材料上生长、粘附良好(图2),软骨多呈现圆形或椭圆形,外形饱满,具有较强的立体感,均匀分布于材料表面;同时,观察可见4 h组(图2 C)支架上细胞粘附及增殖密度显著高于 1 h组(图 2 A)及 2 h(图 2B)组支架,而 1 h与 2 h支架细胞粘附数量无明显差异。

图2 扫描电镜观察软骨细胞在ACECM材料上生长粘附Figure 2 Chondrocytes growth and adhesion on ACECM by SEM
2.4 MTT细胞增殖
结果显示,在体外静态培养过程中各组细胞数量均显著增加 (图 3),4 h组与正常对照组细胞数量差异无统计学意义(P 0.05),而显著高于 1 h 及 2 h 组(P<0.05)(图 3)。
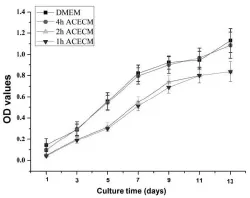
图3 MTT检测软骨细胞增殖Figure 3 MTT assay detected chondrocytes proliferation
3 讨论
目前,多种细胞外基质(extracellular matrix,ACECM)来源的天然生物材料已成功应用于血管、软骨等组织器官的重建[9-10]。有报道显示,同种异体皮肤来源的脱细胞基质材料在临床中已经开始应用[8]。Teebken等[11]对采用多种复合方法对猪心瓣膜进行脱细胞处理,获取了较为理想的冻干瓣膜基质材料。Voytik-Hartin等[12]报道不仅自小肠黏膜下基质中成功提取了FGF和TGF-β两种生长因子。同时,系统的化学检测和组织学观察显示,经过多重复合方法进行脱细胞处理后,最终得到了由具有一定组织结构和细微结构的不可溶的ECM成分,其主要包含多种胶原(I型或II胶原)、蛋白聚糖及弹性蛋白等组分,能够有效支持细胞的粘附与增殖,并为植入生物体内进行组织器官修复提供了良好的载体。该实验制备的牛来源ACECM材料具备良好的组织结构和适宜的生物相容性,具有进一步临床应用的潜能。与此同时,通过对细胞增殖及生长活性的观察发现,应用该实验方法制备的ACECM材料具有良好的生物相容性。
最早在1975年,Meezan等[13]采用化学脱细胞的方法获得了少量ECM材料,其后各种脱细胞方法逐步出现。Teebken等采用胰蛋白酶复合DNA,RNA酶的多酶消化法获取了猪心瓣膜脱细胞的基质材料,结果显示应用功能良好[11]。张晨等[14]发现单纯采用复合酶消化法方法作用较弱且需要作用时间较长,对于较厚组织脱细胞效果不佳。因此尝试应用化学除垢剂结合酶消化法获取大量ECM材料,结果发现联合应用化学除垢剂可达到最佳效果。而且张晨等进一步对ACECM材料检测生物相容性后发现,ACECM材料植入生物体内4周后无明显炎症反应,显示了良好的临床使用安全性。大量的研究显示,脱细胞过程中使用的化学除垢剂如曲拉通等对接种移植细胞存在一定毒性作用,需要使用大量蒸馏水或平衡盐溶液反复冲洗从而去除其毒性作用。该实验表明,经过4 h搅拌洗涤的软骨细胞外基质材料,在细胞接种密度及体外增殖性能等方面均优于1 h和2 h的材料,提示充分搅拌洗涤对于提高软骨基质材料的生物相容性和生物安全性尤为重要。该实验将牛软骨作成微粒,经过胰蛋白酶消化,化学除垢剂TritonX-100以及DNA,RNA消化和平衡盐重复离心洗涤等步骤,可获得高性价比的软骨细胞外基质载体。

