钙离子浓度对NaCl胁迫下嫁接黄瓜幼苗光合与荧光特性的影响
刘 馨,游诗尧,周海霞,祁娟霞,张雪艳
(宁夏大学农学院,宁夏 银川 750021)
设施农业栽培作为一种高效的生产模式,在反季节经济作物的生产中发挥着重要作用,因此得到大面积的推广[1],但由于其具有封闭性,土壤长期得不到雨水淋洗,又随着种植年限的增加和生产过程中水肥管理的不当,由此引发的土壤盐渍化问题十分普遍[2]。据统计,全球大约有9.54亿hm2的土壤受到盐渍化的影响,而我国约有盐渍化土地1亿hm2[3]。土壤盐渍化起主要毒害作用的是Na+和Cl-,其大量累积造成植物体内水分亏缺、营养失衡、PSⅡ活性降低[4],为了保持叶肉细胞相对较高的水势,植物叶片将气孔关闭,但这同时也严重阻碍了CO2进入叶肉细胞,进而降低了植物的光合作用[5],引起植物生长受阻,产量降低。光合作用是植物最基本的生命活动,是植物合成有机物质和获得能量的根本源泉[6],叶绿素荧光动力学是研究植物光合作用强弱与环境关系的探针[7],被广泛应用在探索植物逆境生理方面,任何环境因子对光合作用的影响均可通过对叶绿素荧光数据的分析,直接或间接判断植株受害程度。
黄瓜(CucumissativusL.)作为我国设施栽培的主要蔬菜之一,同样遭受着盐渍化的威胁,现已严重影响了黄瓜的生产。研究表明,嫁接黄瓜可明显增强其抗性,盐胁迫下嫁接黄瓜根系活力及抗性较强,从而增强了黄瓜幼苗在逆境中的各种生理特性[8]。嫁接黄瓜强大的根系,可以增强其对营养及水分的吸收能力,对作物的生长具有促进作用[9],采用嫁接的方式可以降低由盐害引起的作物品质下降、产量损失等问题。钙是植物生长所需的重要矿质元素之一,对细胞壁具有支持和加固的作用,钙离子在植物抗逆机制中作为第二信使,参与胞内稳定和植物生长发育的调节过程[10]。细胞内Ca+的平衡失调是盐胁迫的原初反应[11],因此,一定浓度范围内的钙可以起到保护高盐对植物组织的伤害作用,但其过量则会加重盐害的发生[12]。
目前针对黄瓜实生苗耐盐机理的研究已有初步进展,但采用嫁接黄瓜幼苗添加Ca2+来缓解耐盐性的研究鲜有报道。因此本文以耐盐嫁接黄瓜为材料,在NaCl为100 mmol·L-1的临界浓度下,研究不同Ca2+调控浓度对嫁接黄瓜光合与荧光的影响。以期探究合理的外源Ca2+调控浓度,为提高黄瓜在盐渍化土壤中的生长能力和持续高产提供理论依据。
1 材料与方法
1.1 试验设计
试验于2013年7月1-12日在宁夏大学农科实训基地日光温室内进行,供试黄瓜品种为“德尔99”,选用云南黑籽南瓜作为嫁接砧木。试验选取籽粒饱满、整齐一致的黄瓜种子进行室温浸泡4 h,在28℃恒温催芽1 d后播种于装有基质的育苗盘中进行育苗,待黄瓜子叶展平后,室温浸泡南瓜种子8 h,28℃恒温催芽2 d后播种。待南瓜幼苗长到一叶一心时开始采用插接法嫁接,嫁接后清水浇灌,嫁接14 d后转入1/2倍营养液(黄瓜山崎营养液)进行培养,培养1周后转入1倍营养液,待黄瓜幼苗为3叶1心时进行处理。本试验设定7个处理,每个处理2组重复,每组重复100株幼苗,其中以不加NaCl和CaCl2的处理为无盐对照处理,具体试验设计如表1所示。试验每2天更换1次营养液,同时更换NaCl与CaCl2。
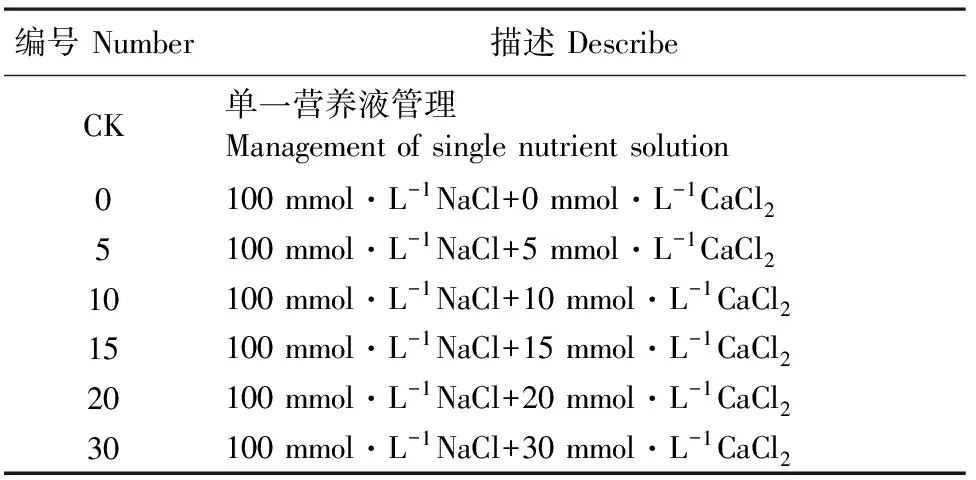
表1 试验设计Table 1 Experimental design
1.2 测定指标及方法
每个处理取5株代表性植株,利用ADC BioScientific LCi Analyser Serial No. 32498光合仪进行光合指标的测定。当光合有效辐射稳定在1 500~2 000 μmol·m-2·s-1,温度在25~30℃之间,环境CO2浓度在380~400 μmol·m-2·s-1,相对湿度为30%~32%时,于盐处理后的第0天、第3天、第7天、第11天的早晨9∶00-12∶00测定叶片的光合作用参数;用美国OSI-FL便携式叶绿素荧光仪于第0天、第3天、第7天、第11天的早晨9∶00-12∶00间测定叶片的荧光参数。
1.3 数据处理
每个处理测定5个平行样本,结果取其平均值,数据用SPSS 17.0软件采用LSD方法在P<0.05水平进行单因素显著性分析。
2 结果与分析
2.1 不同Ca2+浓度对NaCl胁迫下嫁接黄瓜幼苗光合指标的影响
植物光合特性中净光合速率(Pn)作为重要的参数之一,可反映植物同化CO2的能力,进而反映出植株的生长状况[13]。由图1a知,第0天时,各处理间无显著性差异;处理后第3、7、11天时,30 mmol·L-1Ca2+处理净光合速率较低,处理后第3天,CK净光合速率(21.19 μmol·m-2·s-1)显著高于其他处理,其次为0、5 mmol·L-1Ca2+处理;第7天,5~20 mmol·L-1Ca2+处理的光合速率显著高于0 mmol·L-1Ca2+处理,但30 mmol·L-1Ca2+处理仍然较低,并与0 mmol·L-1Ca2+处理无显著性差异;第11天时,相对于其他钙离子浓度处理,0 、10、15 mmol·L-1Ca2+处理的光合速率较高,为其他三组处理的3~4倍,各处理净光合速率随着时间推进而逐渐降低。
CO2为光合作用提供直接的碳源,因此胞间CO2浓度(Ci)是影响植物光合作用的重要因素[14]。由图1b可知,第0天,各处理胞间CO2浓度无明显差异;处理第3天时,0、5 mmol·L-1Ca2+处理的胞间CO2浓度显著高于其他处理,但低于CK;第7天时,0、30 mmol·L-1Ca2+处理的胞间CO2浓度为322 μmol·mol-1与339 μmol·mol-1,显著高于其他处理并接近于CK,0~30 mmol·L-1Ca2+处理胞间CO2浓度出现先降低后增长的趋势;处理第11天时,0、5 mmol·L-1Ca2+处理胞间CO2浓度显著高于CK,20、30 mmol·L-1Ca2+处理与CK无显著差异,但10 mmol·L-1与15 mmol·L-1Ca2+处理相对较低,较CK分别减少24.1 μmol·mol-1与136.5 μmol·mol-1。
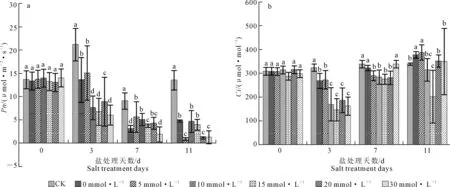
注:不同小写字母表示在P<0.05下差异显著。下同。Note: Different letters indicate significant difference (P<0.05). The same below.图1 不同Ca2+浓度对嫁接黄瓜幼苗光合速率与胞间CO2浓度的影响Fig.1 Effect of Ca2+ concentration on photosynthetic rate and intercellular CO2 concentration of grafted cucumber seedlings
蒸腾速率(Tr)反映植物蒸腾作用的强弱,强烈的蒸腾往往超过作物根部对水分的吸收速度,从而造成作物的萎蔫,最终导致死亡[15]。由图2a可知,随着试验时间的延长,植物蒸腾速率逐渐减缓,第0天时,各处理间Tr无显著差异;第3天时,各处理间差异较显著,不同Ca2+浓度处理均显著低于CK,且10、15、30 mmol·L-1Ca2+处理相对于0 mmol·L-1Ca2+处理分别降低40.02%、36.19%、38.18%;第7天时,外源Ca2+处理均显著降低了黄瓜幼苗的蒸腾速率,其蒸腾速率仅为0.87~1.45 mmol·m-2s-1;第11天,0 mmol·L-1Ca2+处理蒸腾速率与CK无显著差异,但其他钙离子浓度处理显著低于CK,10、15、30 mmol·L-1Ca2+处理Tr均相对较低。
气孔导度(Gs)可反映水汽与CO2通过气孔的难易程度。由图2b知,第0天时,各处理间无显著差异;处理第3、7、11天时,CK处理气孔导度显著高于其他处理,第3天时0 mmol·L-1与5 mmol·L-1Ca2+处理相对高于其他浓度处理,但仅为CK的1/4左右;第7天,各处理间差异不显著,但15 mmol·L-1Ca2+处理相对较低(0.065 mmol·m-2·s-1);第11天时,随着Ca2+浓度的增大植株气孔导度呈现先降低后增长的趋势,15 mmol·L-1Ca2+处理植株气孔导度最低,为该趋势的拐点,0 mmol·L-1Ca2+处理显著高于其他浓度处理。
水分利用率(WUE)在一定程度上反映了植物的耗水性,同时也是评价植物在水分亏缺条件下生长适宜程度的一个重要生理生态指标[16]。处理第0天时,各处理间WUE无显著差异,第3天,0~10 mmol·L-1Ca2+处理水分利用率与CK无显著差异,15~30 mmol·L-1Ca2+处理水分利用效率显著低于CK;处理第7天时,0、30 mmol·L-1Ca2+处理的水分利用率显著低于其他钙离子处理,仅为2.16 μmol·mmol-1与2.39 μmol·mmol-1,20 mmol·L-1Ca2+处理水分利用效率最高,其次为10 mmol·L-1Ca2+处理;第11天时,各处理间差异较显著,经钙离子处理后,10、15 mmol·L-1Ca2+处理的水分利用率显著增大,分别为不添加钙离子处理的11.76倍与1.56倍,0、30 mmol·L-1Ca2+处理差异不显著,5、20 mmol·L-1Ca2+处理水分利用率最低(图2c)。
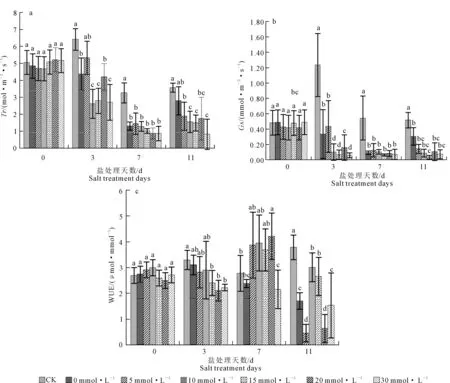
图2 不同Ca2+浓度对嫁接黄瓜幼苗蒸腾速率、气孔导度与水分利用率的影响Fig.2 Effect of Ca2+ concentration on transpiration rate,stomatal conductance and water use efficiency of grafted cucumber seedlings
2.2 不同Ca2+浓度对NaCl胁迫下嫁接黄瓜幼苗荧光指标的影响
Fo代表不参与PSII光化学反应的光能辐射部分,其反映PSII反应中心完全开放时的荧光产量[17]。一般认为,PSII天线色素的热耗散增加导致Fo的降低,而Fo的升高则表明PSII反应中心受到伤害。由图3a可知,处理第0天,各处理无明显差异,处理第3天,相对于CK与30 mmol·L-1Ca2+处理,其他各处理Fo均有明显下降的趋势,10 mmol·L-1Ca2+处理Fo显著低于其他处理,相对于CK下降了16.02%;处理第7天,CK低于20、30 mmol·L-1Ca2+处理,0 mmol·L-1Ca2+处理的Fo最高;处理第11天,除10 mmol·L-1Ca2+处理外,其他处理Fo均呈上升趋势,10 mmol·L-1Ca2+处理的Fo值最低,仅为787.4,0 mmol·L-1Ca2+处理的Fo最高,为1 163.8。
最大荧光产量(Fm)是PSII反应中心处于关闭时的荧光产量[18],可反映通过PSII的电子传递情况。如图3b所示,第0天,各处理间Fm无明显变化,当处理第3天,10、15、20 mmol·L-1Ca2+处理的Fm均表现出下降趋势,并显著低于CK;第7天,CK显著高于其他处理,其次为10 mmol·L-1>30 mmol·L-1>0 mmol·L-1>5 mmol·L-1>15 mmol·L-1>20 mmol·L-1Ca2+处理;第11天时,5、10、30 mmol·L-1Ca2+处理的Fm与其他各处理间差异显著,并显著高于其他浓度钙离子处理,但低于CK。
Fv/Fm是研究植物胁迫程度常用的参数,在非胁迫条件下该参数变化极小,不受物种和生长条件的影响,但在胁迫条件下该参数明显下降[19]。处理后第0、3、7天,各处理无显著差异;当处理第11天时,各处理间差异显著,相对于其他浓度盐胁迫处理,10 mmol·L-1Ca2+处理的Fv/Fm显著增大,分别为其他5个浓度处理的17.69、1.33、1.66、2.82倍与1.22倍,但低于CK,0 mmol·L-1Ca2+处理的Fv/Fm最低并接近于0(图3-c)。
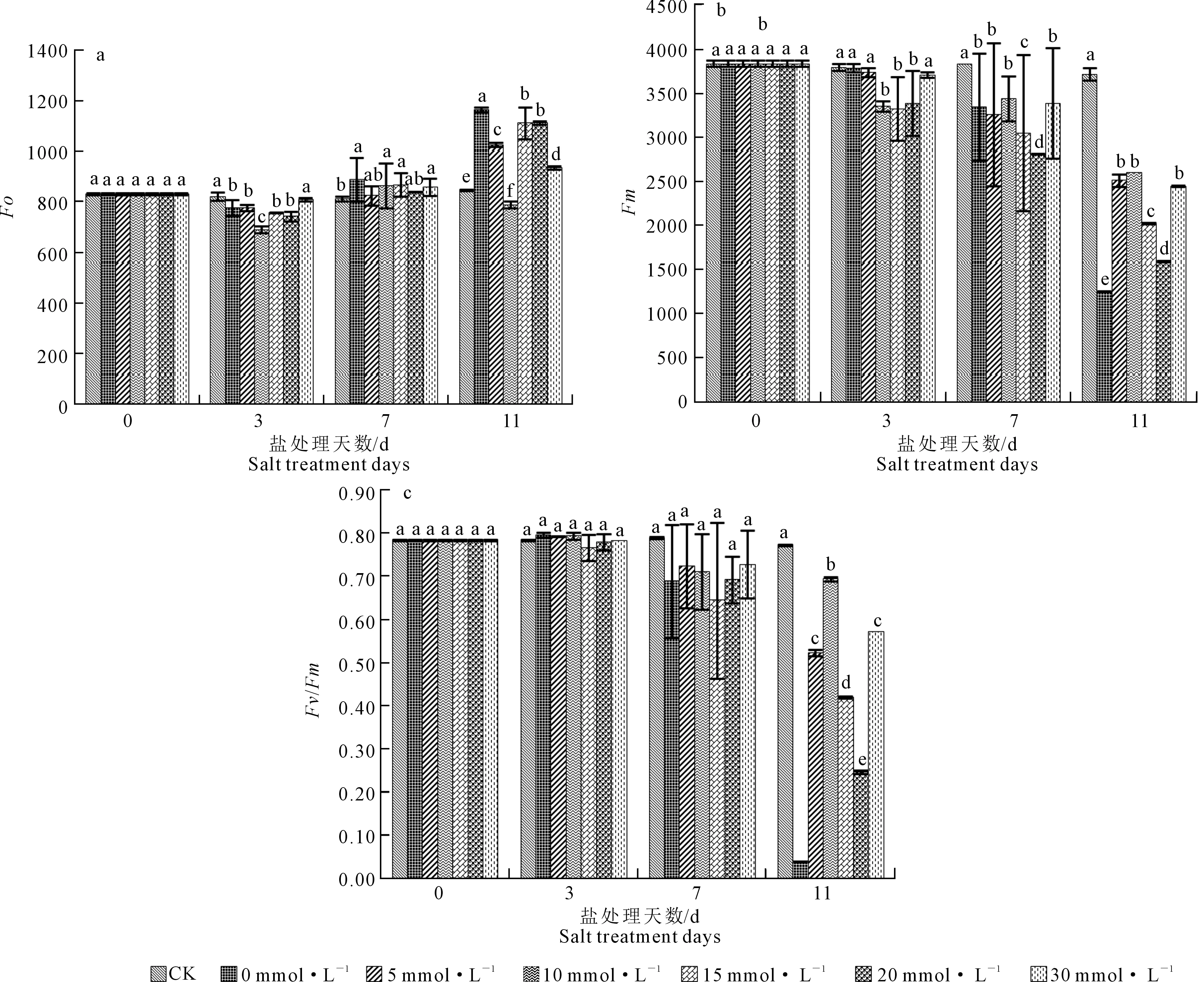
图3 不同处理对嫁接黄瓜幼苗Fo、Fm与Fv/Fm的影响Fig.3 Effect of different treatments on Fo, Fm and Fv/Fm in grafted cucumber seedlings
PSII反应中心的光化学猝灭通常用光化学猝灭系数qP表示,qP反映了PSⅡ天线色素吸收的光能用于光化学电子传递的多少,同时也反映了PSII反应中心的开放程度[20]。如图4a,处理第0、3天,各处理间无显著差异;第7天,10、20 mmol·L-1Ca2+处理的qP与CK无显著差异,0和30 mmol·L-1Ca2+处理qP显著低于其他处理,15 mmol·L-1Ca2+处理qP分别较10、20、30 mmol·L-1Ca2+处理增长43.56%、54.26%、210.71%;当处理第11天,各处理qP值均出现上升的趋势,5、10 mmol·L-1Ca2+处理的qP无显著差异且接近于CK,约为0.52~0.71,0、20 mmol·L-1Ca2+处理的qP较高,分别为0.992与0.802。
qN表示PSⅡ反应中心的非光化学猝灭系数,当PSⅡ反应中心天线色素吸收了过量的光能时,若不能及时耗散将对光合机构造成伤害,所以非光化学猝灭是PSⅡ的重要保护机制,对光合机构起一定的保护作用[21]。由图4b可知,当处理第0、3、7天,各处理间的qN无显著差异;第11天时,0 mmol·L-1Ca2+处理的qN值略高于其他处理,其次分别为5与10 mmol·L-1Ca2+处理,15 mmol·L-1Ca2+处理的qN显著低于其他处理。
由图4c可知,处理第0天和第3天,各处理间表观光合电子传递速率(ETR)无显著差异;当第7天时,CK处理ETR值较高,除0 mmol·L-1Ca2+处理外,其他各处理随着钙离子浓度增大,ETR值逐渐减小,5、10 mmol·L-1Ca2+处理ETR值相对较大,30 mmol·L-1Ca2+处理最小;第11天,各处理间具有显著差异,0 mmol·L-1Ca2+处理的ETR接近于0,10 mmol·L-1Ca2+处理的ETR显著高于其他处理,但与CK无显著差异。
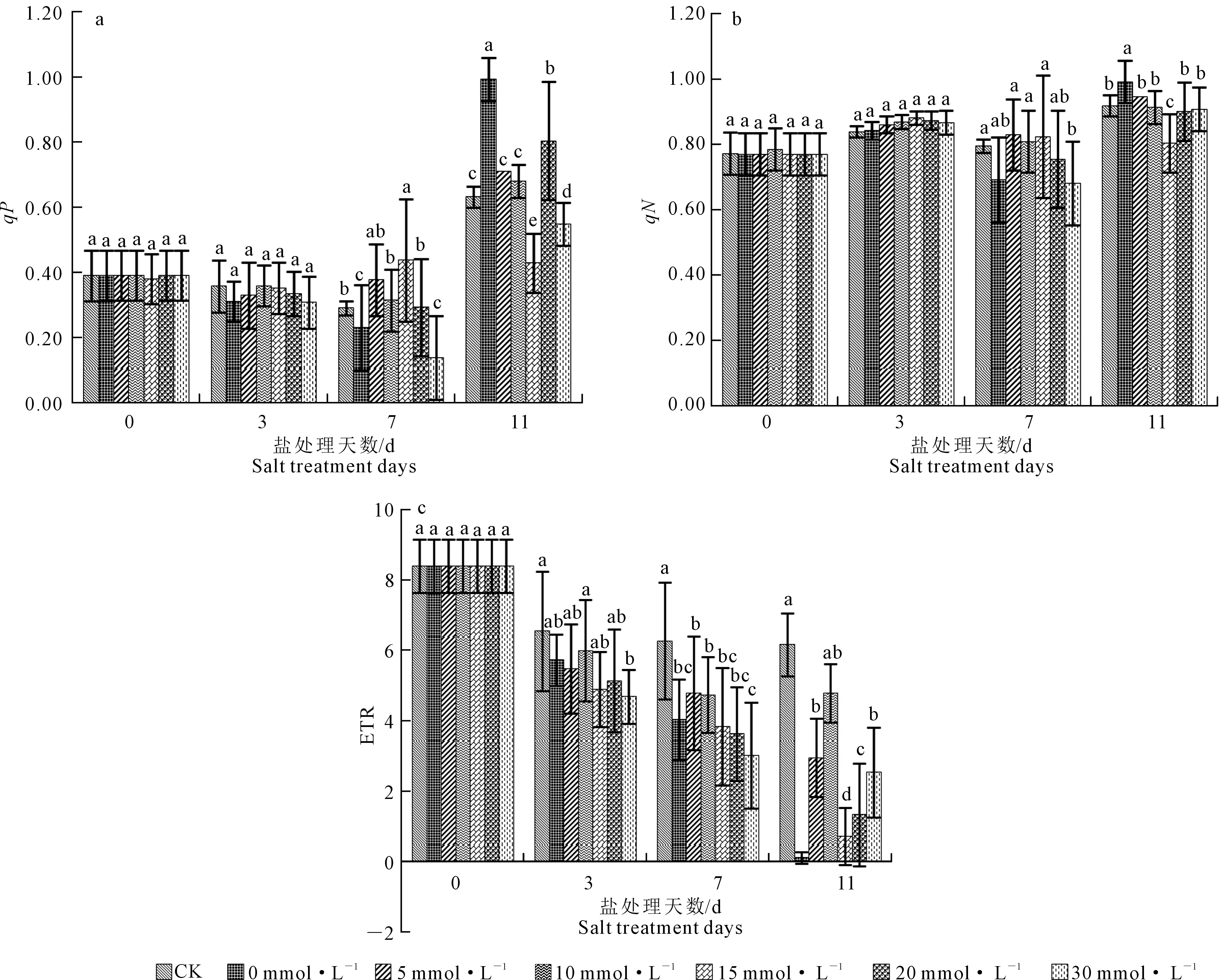
图4 不同处理对嫁接黄瓜幼苗猝灭系数、光化学量子产量与光合电子传递速率的影响Fig.4 Effect of different treatments on the quenching coefficient, photochemical quantum yield and photosynthetic electron transfer rate of grafted cucumber seedlings
3 讨论与结论
土壤次生盐渍化不但破坏了土壤环境,同时也危害了作物的生长。盐渍化土壤中高浓度的盐含量使土壤水势大幅度降低,植物吸水困难,导致植物体内离子失衡,植物生理代谢紊乱,使得植物光合作用能力下降,生长受阻[22]。White等研究表明,盐胁迫后,植物体内大量Na+与Cl-的累积,使得植物光合作用受到抑制[23];Everard等对芹菜和玉米的研究表明,盐胁迫破坏了叶绿体的光合机构,抑制了光合作用的原初反应,阻碍了光合电子传递过程[24];裘丽珍等研究表明,由于植物受盐胁迫后,植株体内的叶绿素酶活性增强,促进了叶绿素的降解,最终导致了叶绿素含量降低,光合速率下降[25]。植物活体叶绿素发出的荧光信号包含的光合信息十分丰富,其在测定叶片光合作用过程中光系统对光能的吸收、传递、耗散、分配等方面具有独特的作用[26],叶绿素荧光的变化可在一定程度上反映逆境对植物的影响,因此通过叶绿素荧光参数分析可深入了解盐胁迫对植株的影响。嫁接条件下,砧木根系可减少或者阻止Na2+和Cl-离子的向上运输,外加钙可促进根系对K+的选择吸收和运输,降低盐害并增加叶片的光合作用[27]。
本试验研究表明,不同钙离子浓度处理第11天,植株叶片净光合速率、蒸腾速率以及气孔导度与CK和0 mmol·L-1Ca2+处理相比显著降低,此结果与杨淑萍通过盐胁迫对不同基因型海岛棉光合作用的影响研究结果一致[28]。这是因为短期的盐胁迫造成了植物水分的亏缺,植物叶片细胞程序性死亡、输导组织受损[29],光合作用能量及电子传递受到抑制,引起气孔关闭,气孔导度受阻,胞间CO2浓度降低,CO2扩散受到限制,同时蒸腾速率下降,最终导致植物光合速率下降[30];0、5 mmol·L-1Ca2+处理胞间CO2浓度相对较高,10 mmol·L-1Ca2+处理胞间CO2浓度相对适中。另外盐处理第11天时,10 mmol·L-1Ca2+处理的水分利用率显著高于其他处理,并接近于CK,说明10 mmol·L-1Ca2+处理后植物净光合速率的下降幅度小于蒸腾速率的下降,因此表现为水分利用率的相对上升,这是植物抵御不良环境的生理反应,表明10 mmol·L-1Ca2+处理对嫁接黄瓜幼苗的光合作用影响较小。整体可知,在100 mmol·L-1NaCl胁迫条件下,外源施加适当浓度的钙离子(10 mmol·L-1),不但没有加重盐害,反而表现缓解盐害的作用(在光合特性方面),这是由于高浓度的Na+造成细胞内Ca2+的减少,破坏了质膜上Ca2+的正常运输系统[31],引起叶细胞环境的改变,而一定浓度外源Ca2+的添加可减少细胞壁和质膜对Na+的吸附,减少Na+在植株体内的累积,消除Na+对胞内Ca2+的不利影响;在盐胁迫条件下,Ca2+也可增加组织内钙调素的含量,活化ACC合成酶,促进乙烯合成,提高植物的抗盐性[32]。
叶绿素荧光的变化可以反映出植物受胁迫的情况[33],盐胁迫可以使PSⅡ受到损害,进而影响到植株的光合作用过程。试验处理第11天,10 mmol·L-1Ca2+处理的黄瓜幼苗的Fo最低且更接近于CK,Fo的大小与PSⅡ的受损状况有关,Fo的降低,说明PSⅡ受体电子传递的受害程度较轻;而黄瓜幼苗的Fm与Fv/Fm均呈现下降趋势,其中0 mmol·L-1Ca2+处理降低的幅度最大,10 mmol·L-1Ca2+处理相比其他处理下降较少并接近于CK,这说明在10 mmol·L-1Ca2+处理下能较好地保持PSⅡ的光化学活性,同时能够通过将过量的光能转化成热能并散失掉,保护了光合结构,避免了光合速率过度下降。盐处理第11天,黄瓜幼苗的qP突然增大,同时qN也略有增加,并且10 mmol·L-1Ca2+处理的黄瓜幼苗的qP与qN均更接近CK,说明10 mmol·L-1Ca2+处理可减小盐胁迫下过剩光能对其光系统的破坏[22],PSII的电子传递活性增强,叶片捕获的激发能中用于推动光化学反应的部分所占比例上升[34]。外源钙处理第3天后黄瓜幼苗ETR逐渐下降,第3天与第7天时10 mmol·L-1Ca2+处理的黄瓜幼苗ETR相对其他降低较小接近于CK,盐处理11天后,外源钙处理与对照相比均显著降低了黄瓜幼苗的ETR,但10 mmol·L-1Ca2+处理的ETR降低缓慢,说明通过荧光指标比较可知,10 mmol·L-1Ca2+处理对嫁接黄瓜幼苗的光合作用影响较小。刘晓龙等研究盐胁迫下水稻叶绿素荧光参数的变化发现,盐胁迫下两种水稻的Fv/Fm、ETR、光化学猝灭(qP) 均下降,这与本试验研究结果一致[35]。
综上可知,通过嫁接黄瓜叶片相关光合与荧光指标分析表明,10 mmol·L-1Ca2+处理可更有效地缓解盐害对嫁接黄瓜幼苗的伤害。