汉防己甲素联合阿霉素体外逆转前列腺癌细胞耐药机制研究
李忠孝 葛启斌 王俊龙 郑璐娜 袁菱 程红涛
癌细胞会对临床抗癌药物及类似药物产生耐药,同时对结构或作用机制完全不同的药物产生交叉耐药[1]。肿瘤细胞的耐药机制复杂,其中通过跨膜转运蛋白外排作用来减少耐药细胞内抗肿瘤药物浓度被视为“经典耐药”[2]。学术界广泛认为跨膜转运蛋白大多属于ATP结合盒转运蛋白家族,而P-糖蛋白(P-gp)是该家族中的重要一员。抑制P-gp蛋白表达和屏蔽其药物外排功能,能逆转由P-gp介导的肿瘤耐药作用[3]。因此,抑制P-gp蛋白表达或干扰其相关功能,可以逆转相关肿瘤耐药,促使耐药细胞对化疗药物复敏。汉防己甲素(Tet)又称为粉防己碱,是从防己科植物粉防己块根中提取的双苄基异喹啉类生物碱,被作为传统中药而广泛用于临床,具有镇痛、降血压、抗风湿、抗纤维化、抗炎性反应、抗肿瘤等作用[4]。研究表明,Tet抑制与杀伤肿瘤细胞机制包括诱导细胞凋亡、引起自噬、阻断Ca2+通道、调节细胞内活性氧分子等[5-6]。近年来研究发现Tet能逆转K562/阿霉素(DOX)和MCF-7/DOX等肿瘤细胞的耐药[7]。但是,仍未见Tet逆转耐药型前列腺癌(DU145/DOX)细胞耐药的可行性报道,其相关机制研究也很少。因此,本文围绕Tet联合DOX对DU145/DOX细胞的体外抗肿瘤作用、促凋亡诱导、细胞摄取、蛋白及基因水平的机制进行系统研究。
1 材料和方法
1.1 主要材料 人前列腺癌DU145细胞购自中国科学院细胞库。Tet(批号:20160827,纯度>98%,南京泽朗生物技术有限公司),配制溶剂为二甲亚砜(DMSO);DOX盐酸盐(货号:D1515,纯度>99%,美国Sigma公司);1640细胞培养基(美国GIBCO公司);青霉素、链霉素(美国HyClone公司);FBS(杭州四季青生物工程材料有限公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、DMSO和姬姆萨染液(北京索莱宝科技有限公司);1%Triton X-100裂解液、二喹啉甲酸(BCA)蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);Pgp-GloTM分析系统(美国Progema公司);P-gp、β-actin抗体(北京博奥森生物技术有限公司);辣根过氧化物酶标记的山羊抗兔IgG(北京中杉金桥生物技术有限公司);逆转录试剂盒(美国Promega公司)。CO2培养箱(美国Thermo Scientific公司);Spectra Max M5型多功能酶标仪(美国MD公司);液相芯片检测器(美国Luminex公司);电泳仪(美国Bio-Rad公司);凝胶成像仪Image Quant LAS4000(美国GE公司);IX70型倒置显微镜以及图像采集系统(日本Olympus公司);QB-9001型微孔板快速振荡器(江苏海门其林贝尔仪器制造有限公司);Avanti J-26 XP高速冷冻离心机(美国Beckman公司);Guava微量流式仪(美国密理博公司)。
1.2 方法
1.2.1 药物配制 用DMSO溶解(终浓度为0.5%),再加入含10%FBS的1640培养液,混合均匀。Tet配制浓度为1~40μM;DOX配制浓度为0.2~8μM。联合用药组DOX+Tet浓度比例设定为1/1、1/3、1/5。对照组为含有同比例DMSO的不完全培养基。
1.2.2 细胞培养 DU145/DOX细胞的制备采用经典的DOX浓度梯度诱导法(诱导至DOX对DU145细胞的IC50是耐药细胞的2倍以上)。将DU145/DOX细胞置于含10%FBS的1640培养液中,37℃、5%CO2培养箱中静置培养。隔天换液,待细胞覆盖率达到80%时消化、传代。
1.2.3 MTT法测定药物对细胞生长的抑制作用 收集对数生长期的DU145细胞及DU145/DOX细胞,用0.25%胰酶消化,调整细胞数1×104个/ml,以每孔200μl接种于96孔板,37℃、5%CO2培养箱中培养24h;吸弃孔内原培养液,分别加入含Tet、DOX、不同浓度比例Tet+DOX的培养基,每孔200μl,每个浓度设6个复孔,继续培养48h;每孔加入20μl MTT溶液,孵育4h;吸弃培养液,加入DMSO150μl,振摇10min;用多功能酶标仪检测490nm处吸光度。计算细胞存活率和半数抑制浓度(IC50,以DOX浓度计算),细胞存活率=给药组吸光度/对照组吸光度×100.00%。
1.2.4 流式细胞仪测定药物诱导细胞凋亡的作用 将1×105个/ml对数生长期的DU145细胞及DU145/DOX细胞分别接种于24孔细胞培养板,培养至70%密度后移除培养基,分别加入含Tet、DOX、不同浓度比例Tet+DOX的培养基,加入相同比例的DMSO的不完全培养基为空白对照组。孵育8h后移除培养基,500μl PBS清洗3次,除去细胞表面药物及凋亡细胞,100μl胰酶消化,PBS终止消化,制备细胞悬液。取100μl细胞悬液和100μl细胞凋亡检测试剂Annexin V-PE于96孔板内,避光孵育15~30min,用微量流式细胞仪检测细胞凋亡情况。
1.2.5 胞内DOX浓度的测定 取对数生长期DU145细胞及DU145/DOX细胞,以1×105个/ml密度接种于24孔培养板,每孔0.5ml,在细胞培养箱中培养24h(密度至80%)。分别加入DOX(2μM)、DOX(2μM)+Tet(2~10μM),对照组用含有同比例DMSO的不完全培养基处理。孵育2h后用0.5ml PBS充分清洗3次,胰酶消化后收集细胞悬液。取0.2ml细胞悬液进入流式细胞仪,计算每5 000个细胞的荧光强度。胞内DOX浓度由以下公式量化:胞内DOX=实验组DOX平均荧光强度值-对照组平均荧光强度值。
1.2.6 胞内荧光探针罗丹明123(R123)定量法 取对数生长期DU145细胞及DU145/DOX细胞,以1×105个/孔的细胞浓度接种于24孔板,待细胞长至80%密度后,分别给予 DOX(2μM)、Tet(2μM)、DOX(2μM)+Tet(2~10μM)、含有等量DMSO(空白对照组)的完全培养液进行预处理2h。移除培养液,加入10μM R123工作溶液继续孵育2h,0.5ml PBS冲洗细胞3次,加入1%Triton X-100溶液裂解细胞。取0.2ml甲醇沉淀,用荧光分光光度计测定R123的浓度(激发波长485nm,发射波长535nm);另取等量裂解液用BCA试剂盒测定细胞蛋白浓度。R123在细胞内的累积量以R123浓度/蛋白浓度的比值表示(单位:nmol R123/mg蛋白)。
1.2.7 P-gp ATP酶活性评价 采用Pgp-GloTM分析系统检测P-gp ATP酶活性,按照说明书制备P-gp膜。每孔加入 20μl Buffer、20μl P-gp 膜,每孔分别加入 0.1、0.5、1.0、2.0、6.0、10.0μM Tet或原钒酸钠(一种广谱的胞内ATP酶抑制剂),37℃孵育5min,加入l0μl Mg ATP,37℃反应40min。加入ATP检测试剂,用液相芯片检测器测定化学发光强度,以相对光单位(RLU)表示,ΔRLU=原钒酸钠RLU-各给药组RLU。
1.2.8 Western blot法检测P-gp蛋白表达 取对数生长期的DU145/DOX细胞,以每孔1×106个细胞接种于6孔板中,至细胞80%贴壁后,给予DOX(2μM)、Tet(10μM)、DOX(2μM)+Tet(10μM)给药处理,未用药物处理组和DU145组分别为阴性对照组和细胞对照组。孵育24h后,1ml PBS清洗3次,1%Triton X-100裂解液孵育30min,BCA法测定胞内蛋白浓度。取30μg/孔蛋白上样,进行10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳,湿法转膜后,硝酸纤维素膜于5%脱脂牛奶封闭2h,加入一抗(1∶1 000,P-gp;1∶1 000,β-actin),4℃孵育过夜,室温二抗孵育2h;增强化学发光法定量测定蛋白表达。1.2.9 RT-PCR法检测MDR1 mRNA表达 将DU145细胞及DU145/DOX细胞以合适的密度接种于6孔板中,至贴壁后分别进行 DOX(2μM)、维拉帕米(20μM)、Tet(2μM)、DOX(2μM)+Tet(2~10μM)联合给药以及空白对照PBS孵育8h。1ml PBS清洗细胞3次,消化、离心,制备2.5×106/ml的细胞液。利用经典一步法提取两种细胞的RNA[8]。PCR引物[9]:正义链引物为 5′-GGGAGCTTAACACCCGACTT-3′,反义链引物为 5′-ATTCCCCTGAGAGGACCAAG-3′;参照基因:正义链引物为 5′-CTGCAGCATCTTCTCCTTCC-3′,反义链引物为 5′-CAAAGTTGTCATGGATGACC-3′。按照试剂盒说明书制备cDNA和PCR体系,94℃变性 15s,55℃退火30~40s,72℃再延伸 1min,扩增 30 个循环;最后 72℃延伸5min。定量:取15个扩增产物,2%琼脂糖凝胶(含溴化乙锭)70V电泳2h,染色后在紫外线下观察,MDR1 mRNA表达量用MDR1 cDNA/参照cDNA的比值表示[10]。
1.3 统计学处理 应用GraphPad Prism 6.0统计软件。计量资料用表示,多组间比较采用单因素方差分析,两组比较采用双尾t检验。P<0.05为差异有统计学意义。
2 结果
2.1 联合用药对细胞生长抑制的作用 DOX及Tet+DOX不同浓度比例联合用药组均能明显抑制DU145细胞增殖。当两药浓度比例为1/1时,CI值为0.86,而其他比例联合用药组CI值均>1。DOX抑制DU145细胞和DU145/DOX细胞增殖的 IC50分别为(0.29±0.03)、(1.62±0.09)μM,差异有统计学意义(P<0.01),提示耐药细胞构建成功。不同浓度比例联合用药组在DU145/DOX细胞实验中CI值均<1,随着Tet比例增加,CI值明显下降。其中,DOX+Tet(1/5)组IC50按Tet和DOX计算分别为(1.85±0.06)、(0.37±0.02)μM,后者较 DOX 组下降4.38倍。此外,其他比例联合用药组DOX的IC50与DOX组比较,差异亦均有统计学意义(均P<0.05);提示联合用药有助于增强DOX对DU145/DOX细胞的杀伤作用。Tet单药组对DU145细胞及DU145/DOX细胞的IC50比较,差异无统计学意义(P>0.05),见表1。
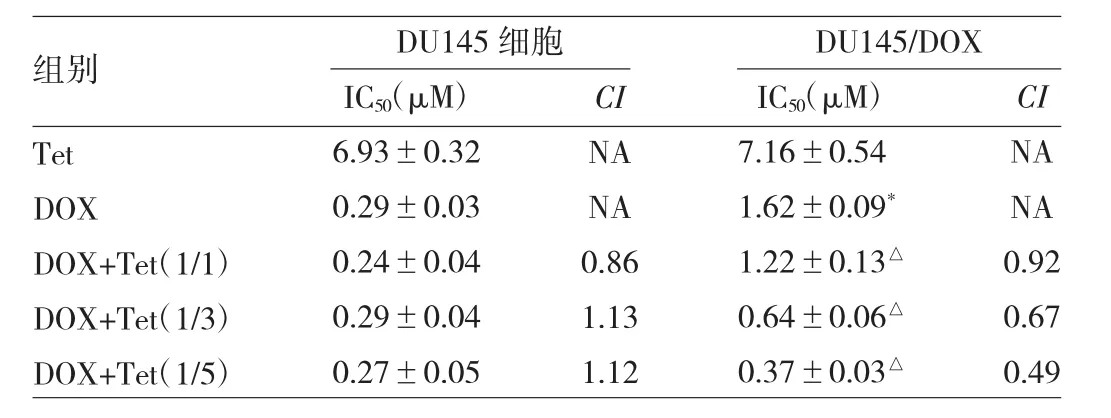
表1 不同浓度比例联合用药组对DU145细胞及DU145/DOX细胞的抑制效应及CI(n=6)
2.2 联合用药对细胞凋亡诱导的作用 DOX及Tet+DOX不同浓度比例联合用药组均能明显诱导DU145细胞凋亡。DOX组与联合用药组比较,未出现凋亡诱导增强效应;与DU145/DOX细胞的DOX组比较,凋亡率是它的1.86倍,差异有统计学意义(P<0.01)。在DU145/DOX细胞实验中,不同浓度比例联合用药组凋亡率均明显高于DOX组(P<0.01)。从趋势上看,随着Tet比例增加,联合用药组对DU145/DOX细胞凋亡诱导能力明显增强。其中DOX+Tet(1/5)组凋亡率是DOX组的2.1倍,提示联合用药能促进DU145/DOX细胞凋亡,有Tet浓度依赖性。Tet单药组对DU145细胞及DU145/DOX细胞的凋亡率比较,差异均无统计学意义(均P>0.05),见表2;提示这种效应可能与Tet干扰了DU145/DOX细胞的耐药环境有关。
2.3 Tet干预对细胞摄取DOX的影响 无论是单药组或联合用药组,每5 000个DU145细胞内DOX的荧光强度值均在60左右,组间比较差异无统计学意义(P>0.05);但相同用药组在DU145/DOX细胞系上出现明显差异:DOX组被DU145/DOX细胞摄取的荧光强度值为18.59±2.41,随着Tet的加入,联合用药组的荧光强度值明显增强,且呈明显的Tet浓度依赖性。DOX+Tet(1/5)组被DU145/COX细胞摄取的荧光强度值为50.24±4.24,明显高于其他用药组(均P<0.01),见图1;提示Tet的参与有助于促进DOX在DU145/DOX细胞内的聚集,可能是联合用药增加细胞毒性的主要原因。

表2 不同浓度比例联合用药组对DU145细胞及DU145/DOX细胞凋亡诱导的作用(n=4)
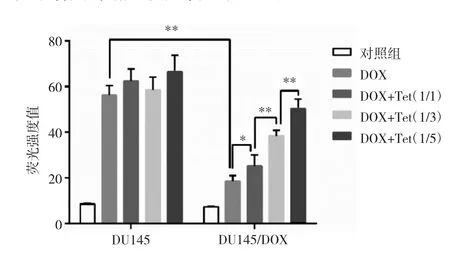
图1 Tet干预对DU145细胞及DU145/DOX细胞摄取DOX的影响(n=4,*P<0.05,**P<0.01)
2.4 Tet预处理对R123细胞内累积的影响 Tet、DOX、联合用药预处理后,R123在DU145细胞的累积量均未见明显改变。空白预处理后,R123在DU145细胞及DU145/DOX细胞的累积量比较,差异有统计学意义(P<0.01),表明耐药环境干扰了R123细胞内聚集行为。经空白对照处理与DOX处理后,R123在DU145/DOX细胞内的累积量比较,差异无统计学意义(P>0.05);与空白对照组比较,单独Tet预处理组、不同浓度比例联合用药组的R123细胞内累积量均明显增多(均P<0.01),且增强效应与Tet比例呈正相关,见图2。提示DU145/DOX细胞的耐药可能被Tet逆转,这种逆转效应与DOX无关。

图2 Tet预孵育2h对R123在DU145细胞及DU145/DOX细胞的累积量的影响(n=4,*P<0.01)
2.5 不同浓度Tet对P-gp ATP酶活性的影响 广谱的胞内ATP酶抑制剂原钒酸钠将胞内各种磷酸酶“冻结”,若测试组能抑制P-gp ATP酶活性,则体现在ΔRLU值为正值,反之为负值。Tet(2~10μM)干预组ΔRLU均高于空白对照组(P<0.01),表明Tet(2~10μM)对P-gp ATP酶活性具有明显刺激作用,且在0.5~10μM的浓度范围内,对P-gpATP酶活性作用具有明显的剂量依赖性(P<0.01)。与维拉帕米组(阳性对照)比较,Tet对ATP酶的活性刺激作用稍弱,见图3。
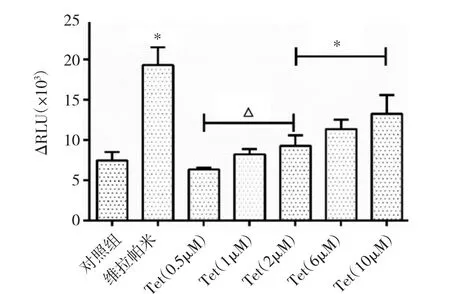
图3 不同浓度Tet对DU145/DOX细胞P-gp ATP酶活性的影响(n=3;与空白对照组比较,*P<0.01;与 Tet 10μM 组比较,△P<0.01)
2.6 Tet对P-gp蛋白表达的影响 根据凝胶电泳和灰度值归一化法,笔者对Tet能否改变DU145/DOX细胞膜上P-gp蛋白表达进行半定量测定。Tet(10μM)、DOX(2μM)+Tet(10μM)对DU145/DMR细胞中P-gp蛋白表达量明显低于双阴性对照组,差异均有统计学意义(均P<0.05),这表明Tet能通过降低P-gp蛋白表达来实现DOX细胞摄取增强效应,且这种效应不受DOX的影响。DOX(2μM)对DU145/DMR细胞中P-gp蛋白表达量,与双阴性对照组比较差异无统计学意义(P>0.05),见图4。
2.7Tet对DU145/DOX细胞MDR1 mRNA表达的影响与对照组比较,Tet处理组、不同浓度比例联合用药组均对DU145/DOX细胞MDR1 mRNA表达产生影响,差异均有统计学意义(均P<0.01)。维拉帕米组、DOX组对DU145/DOX细胞MDR1 mRNA表达的影响不大,与对照组比较差异均无统计学意义(均P>0.05),见图5。
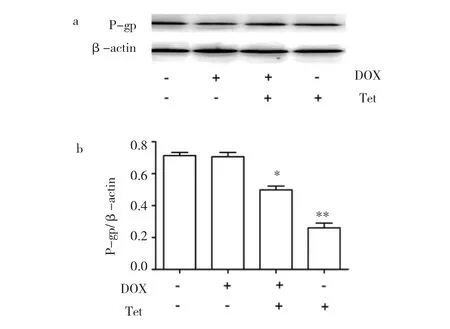
图4 Tet对DU145/DOX细胞中P-gp蛋白表达的影响(a:凝胶电泳图;b:定量图;n=3;与双阴性对照组比较,*P<0.05,**P<0.01)
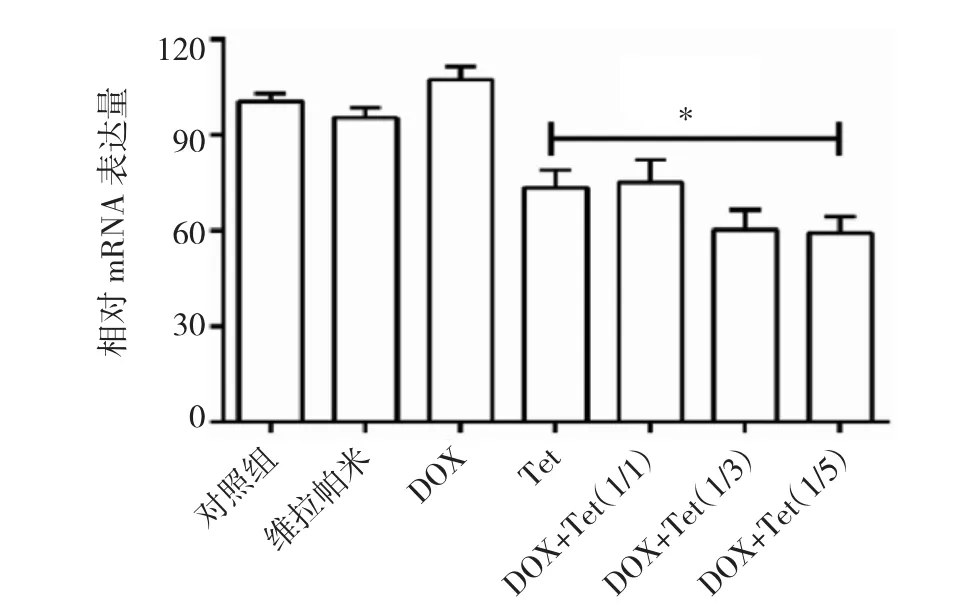
图5 Tet对DU145/DOX细胞MDR1 mRNA表达的影响(n=3;与对照组比较,*P<0.01)
3 讨论
近年来研究发现Tet具有抑制肿瘤细胞生长、减轻放化疗毒性反应、放疗增敏和逆转肿瘤耐药等作用[11-12]。本研究表明,与DOX单药比较,Tet+DOX不同浓度比例联合用药对DU145/DOX细胞生长抑制作用明显增强,联合用药具有很好的协同抗肿瘤效应,且这种效应与Tet比例呈正相关;此外,不同浓度比例联合用药在促DU145/DOX细胞凋亡方面也表现出明显优势。上述Tet介导的耐药细胞毒性和细胞凋亡增强效应在DU145细胞系上并不明显,表明Tet可能通过干扰耐药环境来协助DOX提高抗肿瘤活性。为证实笔者的假想,通过Tet与DOX同时给药测定胞内DOX含量的方法,以及Tet预处理DU145/DOX细胞后测定胞内P-gp底物荧光探针R123累积量的方法,证实了Tet无论是提前给药还是与DOX同时给药,都能增强P-gp蛋白底物的细胞摄取量;同时,这种现象在DU145细胞系上并不明显。本文选取耐药和非耐药型2种细胞系,设置空白对照组、单药组和不同浓度比例联合用药组,最后推断出Tet可能是通过干扰DU145/DOX细胞的P-gp正常生理功能,提高了DOX细胞内化能力,进而促使DU145/DOX细胞对DOX的复敏,最终达到DOX抗肿瘤活性增强的效应。
P-gp属于ATP结合盒转运蛋白家族,由MDR1基因编码,是肿瘤细胞产生耐药的核心因素。P-gp在前列腺癌、卵巢癌中高表达,可引起化疗药物抗癌疗效降低,最终导致治疗失败[13-14]。有报道证实,P-gp被抑制后可增强化疗药物在耐药患者中的疗效[14]。Zhu等[15]研究发现Tet发挥逆转耐药机制与P-gp直接相关。基于细胞毒性作用、细胞凋亡和细胞摄取实验结果,笔者假设Tet的干预可能通是过干扰DU145/DOX细胞的P-gp正常生理功能来协同DOX抑制细胞生长,促进细胞凋亡,提高细胞摄取能力。因此,笔者设计了单药组和不同浓度比例联合用药组,并观察Tet对P-gp ATP酶活性、P-gp蛋白表达的影响。结果发现在实验设计的浓度范围内,各浓度比例Tet均能有效降低DU145/DOX细胞P-gp蛋白表达,且这种效应与DOX是否存在无关,这为联合用药的合理性提供了先决条件。值得重视的是,Tet直接干扰P-gp表达的效应,而经典的P-gp抑制剂维拉帕米却不具备,这是Tet相较于传统耐药逆转剂的一大优势;此外,各浓度比例的Tet均能有效刺激P-gp ATP酶活性,降低P-gp ATP的能量供应,导致P-gp功能受损。笔者还从基因水平考察了Tet的潜在耐药逆转机制。通过经典的RT-PCR技术比较了不同浓度比例Tet、维拉帕米对DU145/DOX细胞MDR1 mRNA表达的影响,结果发现Tet在抑制耐药基因方面优势明显,而维拉帕米尚不能在基因水平逆转耐药现象,这是Tet相较于传统耐药逆转剂的另一大优势。
综上所述,本研究证实Tet联合DOX能逆转DU145/DOX细胞耐药,并从蛋白和基因水平剖析了具体作用机制。笔者认为Tet来源易得、价格低廉、不良反应小,干预耐药的通路广泛,有望代替传统的耐药逆转剂与化疗药物联合使用,以应对临床化疗导致的耐药问题。笔者下一步将构建肿瘤体内动物模型,评价体内结果与体外数据是否具有相关性,为临床转化作深入、系统的研究。

