血栓弹力图在儿童脓毒症诊治中的临床应用
谢倩茹 张晨美
自20世纪90年代初首次提出脓毒症的概念以来,人们对其认识不断提高。儿童脓毒症是儿科急诊、PICU、NICU常见的急危重症,据统计PICU中严重脓毒症和脓毒性休克患儿的病死率约为17%和50%[1]。快速诊断与积极治疗对降低脓毒症患儿的病死率意义重大。过度炎症反应和凝血紊乱之间的交互作用被认为是脓毒症最根本的病理改变。血栓弹力图(thromboelastograpy,TEG)能完整地反映凝血与纤溶的过程,最大程度模拟人体内真实的凝血反应过程,有效监测脓毒症患者凝血功能变化,有助于识别高凝、低凝状态,客观评价病情严重程度,指导临床风险的评估。
1 脓毒症及脓毒性休克
2016年美国危重病医学会和欧洲危重病医学会成立国际工作小组,由19位专家组成,回顾审查了脓毒症和脓毒性休克的旧版定义,并对定义进行更新。国际工作小组建议将脓毒症的定义修改为宿主对感染的反应失调而导致危及生命的器官功能障碍;脓毒性休克的定义修改为出现严重的循环障碍及细胞代谢异常,且导致病死率明显增加的脓毒症。脓毒性休克相比单纯脓毒症有着更高的死亡风险[2]。
脓毒症的诊断标准(参照 Sepsis 3.0)[2]:(1)感染;(2)序贯器官衰竭评分急性增加≥2分,评分标准见表1。同时满足以上2条即诊断为脓毒症。脓毒性休克的诊断标准[3]:在脓毒症的基础上,出现补液无法纠正的低血压且血清乳酸水平升高(>2mmol/L)。不同年龄儿童低血压标准见表2[4]。
脓毒症的发病机制复杂,并非单因素促成的疾病,而是一个涉及大量局部和全身性炎症反应的复杂的病理综合征。凝血功能障碍在脓毒症的发病过程中起着重要作用。相关证据表明炎症与凝血功能之间存在着广泛的交互作用,即炎症能激活凝血系统,而凝血功能紊乱也会放大炎症反应[5]。20%~50%的脓毒症患者将发展成弥散性血管内凝血[6]。脓毒症引起凝血功能障碍的发病机制主要包括以下4点:(1)发生脓毒症时炎性介质IL-6、TNF、IL-1及白细胞刺激血管内皮细胞表达组织因子,从而启动外源性凝血途径,导致微血管内微血栓形成和微循环障碍[7];(2)发生脓毒症尤其是严重脓毒症时,丢失或破坏增加、骨髓抑制等原因导致PLT下降,同时血小板功能减弱并随病情加剧而加重,因此血小板控制血管紧张性及血管舒张或收缩性物质释放的功能明显减弱;(3)发生脓毒症时体内血浆抗凝血酶水平下降;(4)发生脓毒症时,凝血的激活往往伴随主要抗凝机制的功能受损,包括抗凝血酶、蛋白C系统和组织因子途径抑制物[8-9],纤溶系统受抑制而导致纤维蛋白溶栓的清除迟缓[10]。
2 TEG
2.1 工作原理 TEG技术是1948年由Dr.Hellmut Hartert发明,20世纪80年代开始应用于临床,现已成为监测凝血功能的重要检查方法,多个国家的输血、麻醉、重症、心外等学科指南均建议使用[11]。TEG仪的工作原理:烧杯加入0.36ml血标本,温度保持在37℃,以模拟人体恒温状态。承载血标本的烧杯以4°45′的角度、10s/圈的速度进行匀速转动。在旋转过程中,纤维蛋白在烧杯壁与扭力丝之间发生多聚反应,凝血块逐渐形成。当血栓形成后,烧杯中金属探针受到标本形成的切应力作用,开始随之出现左右旋动,金属针在旋动过程中因为切割磁力线而产生电流,经过软件处理后在电脑上绘制出与时间相对应的图像,即TEG曲线。简言之,TEG仪的基本原理就是凝血块在形成与溶解过程中会引起物理弹性及力度变化[12],见图1。

表1 序贯器官衰竭评分
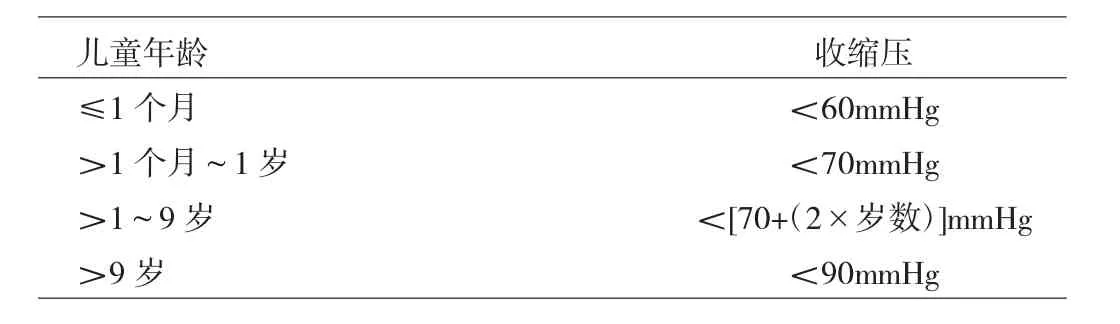
表2 不同年龄儿童低血压标准

图1 TEG仪的工作原理
2.2 常用参数 TEG是一条关于时间的对称曲线,分为凝血与纤溶2个过程,见图2。常用参数包括R时间、K 时间、α 角度、最大振幅(MA)、LY30、CL30、A 振幅、A30振幅、A60振幅、凝血综合指数(CI)[13-15]。

图2 TEG曲线的示意图
2.2.1 R时间 它是仪器开始工作到第1块纤维蛋白凝血块形成的一段潜伏期,即TEG图像从起始至振幅达2mm处,此时纤维蛋白尚未形成,反映参加凝血启动过程的凝血因子综合作用。正常值为5~10min。若使用抗凝剂或血液中因子缺乏时,R时间会延长;若血液呈高凝状态,R时间会缩短。
2.2.2 K时间 它是R时间的终点到曲线幅度达到20mm所需时间,反映纤维蛋白和血小板在血凝块开始形成时共同作用的结果,即血凝块形成的速率,其中以纤维蛋白的功能为主,故为检测Fb功能的一项指标。正常值为1~3min。K时间缩短提示Fb功能亢进,血液呈高凝状态;反之,Fb功能降低。使用抗凝剂会影响血小板功能及Fb形成,延长K时间。
2.2.3 α角度 从血凝块形成点到最大曲线弧度作切线,该切线与水平的夹角为α角度。正常值为53°~72°。α角度变大,提示血液呈高凝状态;反之,血液呈低凝状态。α角度与K时间密切相关,共同反映纤维蛋白与血小板的相互作用。但α角度不受其低凝状态的影响,比K时间更全面。
2.2.4 MA 它反映正在形成的血凝块最大强度或硬度,以及血凝块形成的稳定性。血小板功能及数量、Fb水平、血小板与Fb之间的相互作用均会影响MA,主要影响因素为血小板功能及数量。正常值为50~70mm。MA降低,提示血小板功能降低或数量减少,血液呈低凝状态。
2.2.5 LY30它是指MA后30min血凝块幅度减少速率,反映纤维蛋白溶解状态,正常值<7.5%。
2.2.6 CL30它是指MA确定后30min内血凝块纤溶剩余的百分比,由A30与MA确定,正常值>85%。
2.2.7 A、A30及A60振幅 它们分别是指任意时刻曲线两点间的宽度、MA后30min的振幅、MA后60min的振幅。在MA确定前,MA=A;A是在MA确定后出现的,用于反映纤溶过程的信息。A60的正常值为MA-5mm。
2.2.8 CI 以R时间、K时间、α角度和MA为基础来描述总体凝血状态,CI<-3为低凝状态,CI>+3为高凝状态。
2.3 优缺点 TEG通过模拟人体内的凝血环境来检测体外全血样本,提供了可同时反映1期、2期凝血与纤溶状态的量化参数。它能反映凝血因子活性、Fb功能、血小板功能及纤溶活性,有助于快速、简便地了解患者凝血功能变化。此外,TEG检测需血量少,方法简单、快速,可在床边进行。然而,TEG也存在有一定的局限性。在体内,凝血是从血小板黏附于损伤的血管壁开始的,但TEG无法检测血小板与血管内皮的相互作用;若患者处于低体温状态,TEG便无法反映患者真实的凝血功能状态[16]。常规TEG采用凝血酶为血小板激动剂,若患者接受抗血小板治疗,常规TEG就无法反映患者凝血状态;此外,TEG在30min内测定凝血状态,但血标本在30min内已发生变化,可见TEG无法反映当时的凝血状态。目前TEG正常值范围较大,且脓毒症的诊断标准中并无TEG相关参数。此外,TEG检测费用较高。
3 TEG在脓毒症诊治中的临床应用
凝血功能紊乱程度与脓毒症的严重程度相关。TEG检测有助于临床识别脓毒症患者的凝血功能变化,协助诊断弥散性血管内凝血,为肝素抗凝治疗提供依据。何婧瑜等[17]一项队列研究发现,TEG是预测脓毒症预后的有效工具,MA<50mm是脓毒症患者30d病死的独立预测因素。崔利丹等[18]发现当发生弥散性血管内凝血时,凝血功能紊乱更加严重,TEG参数有助于判断脓毒性休克患儿发生弥散性血管内凝血的风险。钟声健等[19]回顾性分析92例脓毒症患者的临床资料,发现TEG能有效监测脓毒症患者凝血功能的变化,识别高凝与低凝状态,客观评价病情严重程度,从而指导临床风险的评估;这一结论与刘潇潇等[20]应用ROC曲线对TEG参数进行分析得出的结论相符。王一雪等[21]报道TEG参数诊断弥散性血管内凝血具有较好的特异度,能弥补常规凝血功能检测的缺陷。潘洁仪等[22]应用内毒素建立比格犬的感染性休克模型,发现TEG可提示低凝状态及纤溶抑制。陈益君等[23]通过成功复制严重脓毒症大鼠模型,发现常规凝血功能检测显示低凝,而TEG提示高凝,可见不能单纯依靠常规凝血功能检测来评价严重脓毒症大鼠的凝血功能,建议用TEG来诊断严重脓毒症早期液体复苏后的高凝状态。
国外学者对TEG的报道结果如下。Muzaffar等[24]一项对55例ICU患者的前瞻性研究发现,TEG较传统的凝血项目检测更灵敏。Müller等[25]从680篇文献中筛选出18篇进行分析,得出TEG可以有效检测出脓毒症患者的凝血功能异常。Adamzik等[26]一项多因素分析结果显示,TEG参数出现病理性结果(K时间<3.1min,MA>55.0mm,α角度>57.5°)是严重脓毒症患者病死的独立危险因素,较序贯器官衰竭评分能更好地预测患者30d存活率。Ostrowski等[27]一项前瞻性研究结果证实,MA下降的低凝状态是严重脓毒症患者28d病死的独立预测因素。De等[28]研究表明,TEG可用于评估凝血功能变化,有效指导临床抗凝治疗。Mendez-Angulo等[29]证实,TEG有助于评价脓毒症动物模型凝血功能变化,特别是MA。Nates等[30]在内毒素诱导的猪休克模型研究中,认为TEG是脓毒症早期快速评估凝血功能的有效工具。
4 小结
TEG能完整、动态地监测凝血与纤溶整个过程,可全面提供凝血因子、纤维蛋白、血小板、纤溶系统等多方面信息。它对于脓毒症的诊治帮助颇多,具有协助诊断、分析病情、指导治疗、评估预后等多重作用,值得在临床推广。但目前关于TEG的研究仍较少,其作用仍需要大规模前瞻性研究加以证实,其存在的局限性需要在实践中不断改进。

