一种胶原基质全层皮肤模型的构建和表征
宋肖洁 史晓婷 姚期凤 吴越
200233上海,伽蓝(集团)股份有限公司研发中心
三维皮肤模型是应用细胞生物学和工程学的技术和原理,在体外利用人正常皮肤细胞构建具有完整三维解剖结构、高度模拟人体皮肤的组织模型。组织工程技术的发展,以及制药业和化妆品行业对动物替代方法的巨大需求,推动了体外重建皮肤模型技术的进步。我们尝试使用来自中国人的皮肤细胞构建包含表皮-真皮结构的三维全层皮肤模型,并从形态学、超微结构以及特征蛋白表达方面对三维皮肤模型进行测试评估,以期将其应用于皮肤屏障、伤口愈合等皮肤相关的基础研究,以及和化妆品相关的安全性和功效性评估。
材料与方法
一、主要试剂及仪器
本研究通过上海芯超生物科技有限公司伦理委员会批准(YBM-05-02),健康人皮肤组织来自上海芯超·生物样本库。角质形成细胞无血清培养基(KSFM)、DMEM培养基(美国Invitrogen公司),猪胶原(北京金泰宏达生物科技有限公司),胎牛血清(美国Thermo公司),噻唑蓝(MTT)、曲拉通X-100(Triton X-100)(美国Sigma公司),OCT试剂(美国SAKURA公司);一抗鼠抗人角蛋白10(K10)抗体、Ki67抗体、免疫组化试剂盒(丹麦Dako公司),鼠抗人转谷氨酰胺酶(TG)、原纤维蛋白抗体(fibrillin,美国Thermo公司),鼠抗人层黏连蛋白5抗体(laminin 5,美国Millipore公司),兔抗人Ⅲ型胶原抗体(COLⅢ,法国Novotec公司),鼠抗人Ⅳ型胶原(COLⅣ)(美国Santa Cruz公司)、Ⅰ型胶原(COLⅠ,英国Abcam公司)、丝聚合蛋白(filaggrin,美国Vector labs公司)抗体,二抗驴抗鼠Alexa Fluor®568、羊抗兔Alexa Fluor®568(美国Life technologies公司),荧光/化学发光酶标仪(美国PerkinElemer公司),普通/荧光显微镜(德国Zeiss公司)。
二、皮肤模型制备
1.原代皮肤细胞提取:人成纤维细胞及人角质形成细胞的提取参见文献[1],将皮肤组织冲洗后置于含0.25%~0.5%分离酶的PBS溶液,4℃过夜;次日,分离真表皮,表皮部分使用0.5%胰酶室温消化15 min,无菌不锈钢滤网过滤后得到人角质形成细胞单细胞悬液,真皮部分使用含0.2%胶原酶的DMEM溶液于37℃消化2~6 h,过滤得到人成纤维细胞单细胞悬液,分别计数、传代培养或冻存。
2.真皮层制备:将获得的人成纤维细胞使用含10%胎牛血清的DMEM培养。用超纯水溶解猪胶原,取第5~10代的成纤维细胞,按照0.5×106/ml~3×106/ml的密度接种至已经溶解的胶原中,胶原浓度为0.4 g/ml;然后将此胶原和成纤维细胞的混合物倒于细胞培养皿中,待胶原凝固后,加入含10%胎牛血清的DMEM,置于5%CO2、37℃条件下培养,每隔48 h更换1次培养基,以接种成纤维细胞作为皮肤模型培养的第0天,记为D0。
3.表皮层制备:将从皮肤组织提取的人角质形成细胞使用KSFM培养基培养。接种成纤维细胞后皮肤模型培养的第3天(D3),将准备好的第3~7代角质形成细胞按照0.1×105~1.5×105个/cm2接种于真皮层表面,按文献[2]配制培养基,于5%CO2、37℃培养,每隔48 h换液1次,持续培养2周,培养结束后将皮肤模型放到OCT试剂中-20℃冻存,制备常规冷冻切片,或浸泡到4%甲醛中固定24 h,然后进行常规石蜡切片的脱水和包埋。
三、皮肤模型形态学观察
将石蜡切片脱蜡复水后,通过HE染色对培养得到的三维皮肤模型的组织结构进行观察,并与正常人皮肤组织进行对比;通过Masson染色进一步观察D17、D18、D19、D20、D24和D31时三维皮肤模型的表皮层变化。通过HE或Masson染色观察到该模型真皮中有活的成纤维细胞,表皮层分化良好,各层结构清晰且具有角质层,即可视为得到双层皮肤模型。
四、皮肤模型超微结构的电镜观察
将皮肤模型切成1~2 mm宽的细长条,戊二醛和锇酸双固定,常规制作透射电镜样本,然后对皮肤模型真皮层、基底膜、表皮层中的超微结构进行观察并拍照记录。
五、皮肤模型中各层标记物的检测
1.免疫荧光染色检测TG、K10、COLⅢ、COLⅣ、laminin 5和fibrillin表达:将冰冻切片放在冷甲醛中固定10 min,再放入PBS中清洗2次,各5 min,加入0.5%牛血清蛋白封闭1 h后,加入上述蛋白的一抗(TG抗体1∶1 000稀释,fibrillin抗体1∶50稀释,其余抗体均按1∶100稀释),过夜。次日,PBS清洗2次,各5 min,再加入二抗孵育1 h。PBS清洗,封片,在荧光显微镜下观察。
2.免疫组化染色检测皮肤模型中filaggrin、Ki67和COLⅠ表达:将5 μm石蜡切片浸入100℃柠檬酸钠缓冲液(0.01 mol/L,pH6.0)中30 min,冷却30 min至室温,加入上述蛋白的一抗(filaggrin、COLⅠ抗体1∶100稀释,Ki67抗体1∶50稀释),孵育1 h后按试剂盒说明书染色,苏木精核染5 min,光镜下观察。
结 果
一、皮肤模型的构建结果及形态学观察
按上述方法培养真皮3~4 d,培养表皮14 d,即共培养17 d(D17)时获得三维皮肤模型。该模型表皮具有较好的层状结构,包括基底层、棘层、颗粒层和角质层;真皮中具有充盈的胶原,且细胞均匀地分布于真皮层。三维皮肤模型表皮层及真皮层与正常人皮肤相近(图1)。D17、D18、D19、D20、D24和D31(继续培养14 d)时,三维皮肤模型表皮(不含角质层部分)不断变薄,表皮不断向上分化,角质层增加,仍具有稳定的结构,见图2。

图1 皮肤真表皮结构(HE×100)
二、三维皮肤模型的超微结构
透射电镜下,正在分化的三维皮肤模型的表皮层可观察到形态清晰的基底层、棘层、颗粒层和角质层;颗粒层含有透明角质颗粒,角质层含有脂质和角化桥粒(corneodesmosome);细胞间有桥粒,且真表皮连接处具有完整的基底膜;真皮层可观察到成纤维细胞和胶原纤维,见图3。
三、皮肤模型中各层标记物的表达
在正常人皮肤和三维皮肤模型表皮中,TG、filaggrin、Ki67、K10均有明显表达(图4);真表皮交界处COLⅣ及laminin5均正常表达(图5);真皮层COLⅠ、COLⅢ、fibrillin均正常表达(图5)。
讨 论
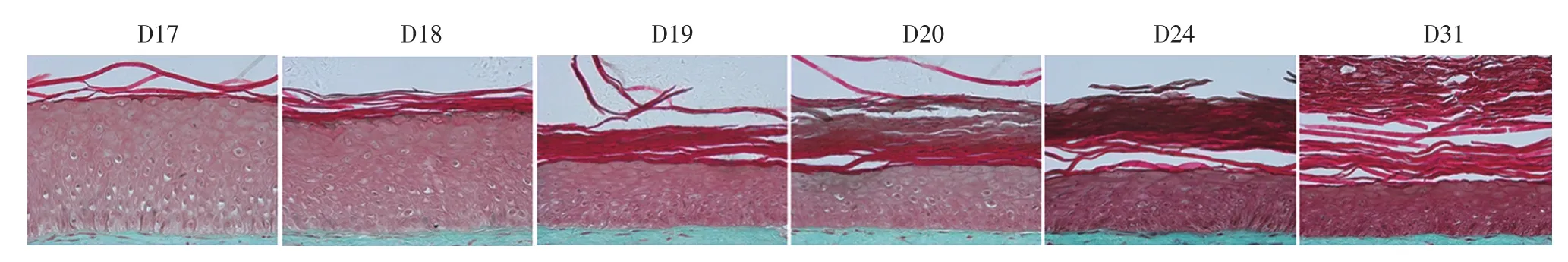
图2 三维皮肤模型表皮层随培养时间的生长分化(Masson×250)

图3 三维皮肤模型表皮层、基底膜及真皮超微结构

图4 正常人皮肤与三维皮肤模型的表皮层免疫组化及免疫荧光染色(×250)
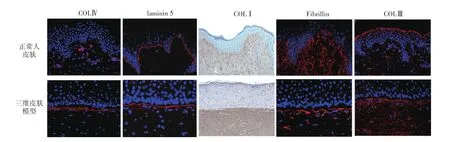
图5 正常人体皮肤与三维皮肤模型Ⅳ型胶原(COLⅣ)、层黏连蛋白5(laminin 5)、原纤维蛋白(fibrillin)、Ⅲ型胶原(COLⅢ)免疫荧光染色和Ⅰ型胶原(COLⅠ)免疫组化染色(×250)
皮肤模型已成为皮肤组织工程学发展的重要趋势。三维皮肤模型的发展影响了癌症生物学、药理学及基础细胞生物学的一系列研究领域[3-4]。这种模型也正在用于模拟疾病[5],研究药物传播[6]以及人类器官发育机制[7]。目前重建人皮肤模型主要有表皮模型和全层皮肤模型,市面上用于销售的几种模型,已经有成熟的检测方法用以评估样品对皮肤的腐蚀性和刺激性[8-16]。随着新型生物相容性材料研发以及更复杂的细胞组分的掺入,皮肤模型的发展得到持续改进。本研究所构建的皮肤模型是以中国人皮肤来源的成纤维细胞、角质形成细胞为基础,该模型更符合东方人的皮肤结构特点,可用于筛选适合中国人皮肤的护肤品。
我们使用猪胶原与人成纤维细胞混合培养构建模拟皮肤的真皮层,再在其上层接种人皮肤角质形成细胞,通过真皮培养3~4 d,表皮培养14 d,成功构建三维皮肤模型。通过组化分析可以观察到表皮上具有较好的层状结构,包括细胞呈柱状排列的基底层,具有多层结构的棘层,向上逐步分化呈扁平状的颗粒层和无细胞核的角质层。真皮层上具有充盈的胶原,且成纤维细胞均匀分布于真皮层。而且角质层厚度随着接种角质形成细胞后时间增加而增加,继续培养14 d仍具有完整的表皮层结构。目前已有的一些皮肤模型,通常模型成熟后仅能维持3~7 d,且最后模型已无完整的表皮层结构,限制了使用模型进行检测的时间;而本研究用中国人皮肤重建的全层皮肤模型,在模型成熟收获后(即D17)仍能在体外维持完整结构长达14 d(即D31),并且表皮中仍具有6~7层含活细胞的角质层,大大增加了可供检测的时间,拓展了皮肤模型用于检测的范围和广度。
屏障功能是表皮的基本属性,受表皮脂质组成的影响[13-14,17]。电镜下可观察到,我们构建的三维皮肤模型表皮层具有多层结构,颗粒层中有透明角质颗粒,角质层中具有角化桥粒和脂质颗粒,它们均有助于屏障功能;角质形成细胞分化也通过分化标记物的表达模式得到验证;对不同分化阶段的标记物染色显示,该模型与人表皮分化过程相似;与表皮层细胞分化相关的TG正常表达,filaggrin可见于颗粒层细胞中,在基底层中可观察到与角质形成细胞分化相关的Ki67,早期分化相关的角蛋白K10在基底层以上表达。
电镜观察本研究构建的三维皮肤模型,有完整的基底膜。免疫荧光标记可以观察到基底膜相关蛋白COLⅣ和层黏连蛋白明显表达,说明该模型构建成功,具有完整的基底膜。同时,电镜观察到该三维皮肤模型真皮层具有胶原纤维和成纤维细胞。免疫荧光标记显示,真皮层中filaggrin、COLⅠ和COLⅢ胶原在三维皮肤模型中的表达类似于正常人皮肤。
总之,用中国人皮肤构建的三维皮肤模型与正常人皮肤具有较高的相似性,可以作为中国化妆品研究的有利工具,也可以用来开发体外替代物和毒理学测试研究,但和正常皮肤相比,本研究构建的3D皮肤模型没有黑素细胞、免疫细胞以及神经细胞,同时也缺乏毛囊、皮脂腺、汗腺等皮肤附属器。因此不能用于涉及以上细胞及附属器的生物学研究中。

