PM2.5促进Th9细胞分化及在哮喘发病中作用的初步研究
付劲蓉 孙立成 夏 莉 刘丽娟 黄赛花 韩 晓 周玉峰,2
哮喘是在遗传易感背景下由过敏原和环境因素相互作用而引起的一种免疫炎症性疾病[1]。近年来受环境污染的影响,哮喘的发病率呈逐年上升趋势[2~4]。流行病学研究结果显示,PM2.5与哮喘发病率增加、症状加重及急诊就诊率上升相关,但PM2.5通过何种机制诱发和(或)加重哮喘尚不清楚[5,6]。Th9细胞是近年来新发现的T细胞亚群,是在转化生长因子-β(TGF-β)及IL-4联合刺激下分化而来,以分泌大量IL-9为主要特点,与哮喘的发生发展密切相关[7,8]。本研究利用蟑螂提取物(CRE)建立过敏原致敏的小鼠哮喘模型,以此模型进一步研究PM2.5暴露对小鼠气道炎症、支气管高反应性、Th9细胞的影响,为阐明环境污染与哮喘发作的关系及哮喘的防治提供实验证据。
1 方法
1.1 实验动物 SPF级C57BL/6雌鼠,6~8周龄,体重18~20 g,购自上海斯莱克实验动物有限责任公司,饲养在复旦大学实验动物科学部。饲养环境符合SPF级环境设施标准。实验方案得到了复旦大学附属儿科医院(我院)伦理委员会的批准。
1.2 PM2.5采集 ZR-3930型环境空气颗粒物采样器(青岛众瑞智能仪器公司)置于我院科研楼顶楼,连续采集2017年10~12月份的大气PM2.5。将采有PM2.5的石英膜裁剪为1 cm×3 cm大小,浸入三蒸水中超声振荡1 h。用70 μm的过滤网过滤振荡液,滤液冷冻真空干燥,灭菌,低温保存备用。
1.3 哮喘小鼠模型的建立方法 采用本实验室已经发表的方案[9]:将20 μg CRE(购自美国 GREER Laboratories)于D0~D4气管内分别注射致敏5次(致敏阶段),D10~13气管内分别刺激4次(激发阶段),D14处死(图1)。处死后收集肺泡灌洗液和肺组织备用。部分肺组织用于RNA和蛋白提取;部分肺组织用于HE染色,检测肺组织的病理状态。

图1 小鼠哮喘模型建立方案
1.4 分组 激发阶段在给予小鼠过敏原刺激的同时,采用气管内滴注的方法检测PM2.5对小鼠哮喘发作的影响(图1)[10~12]。前期预实验中,本研究采用不同剂量PM2.5(25、50、100 μg)处理小鼠,发现PM2.5能明显增强CRE诱导的过敏反应,其中100 μg PM2.5作用最强,之后体内实验本研究均采用100 μg的PM2.5进行处理。分组: ①PBS对照组:致敏和激发阶段均采用50 μL PBS处理;②CRE组:致敏和激发阶段均采用50 μL CRE(20μg)处理;③单用PM2.5组:致敏阶段采用50 μL PBS处理,激发阶段采用50 μL PM2.5(100 μg)处理;④PM2.5+CRE组:致敏阶段采用50 μL CRE(20μg)处理,激发阶段采用50 μL PM2.5(100 μg)和CRE(20μg)混合液处理。每次每组5只小鼠,实验重复3次。
1.5 气道高反应性检测 末次激发24 h后,采用戊巴比妥麻醉小鼠,行气管插管,连接呼吸机和雾化装置,用有创小鼠肺功能仪(美国Buxco公司)检测不同分组小鼠的气道反应性。以乙酰甲胆碱(Mch)作为刺激剂,依次检测0、6.25、12.5和25 mg·mL-1浓度的Mch引起小鼠气道阻力和肺顺应性的变化,作为评价小鼠气道阻力的指标。
1.6 炎症细胞分类计数 采用流式细胞仪(美国BD公司,FACS Canto Ⅱ)检测不同分组小鼠肺泡灌洗液中炎症细胞的分类计数[9]:嗜酸性粒细胞表型为side scatter (SSC)highSiglec-F+Mac-3-细胞, 肺泡巨噬细胞定义为 SSChighSiglec-F+Mac-3+细胞, 粒细胞定义为SSChighGr-1+细胞,淋巴细胞为 forward scatter(FSC)low/SSClowCD3+或CD19+。荧光标记抗体购自美国e-Bioscience公司。
1.7 Th9比例检测 取小鼠肺门淋巴结,制成单细胞悬液,细胞培养在96孔培养板中,加入50 ng·mL-1PMA、1 μg·mL-1离子霉素和25 μM 布雷非德菌素A培养5 h。然后进行CD3和CD4染色,再用BD 细胞固定/破膜试剂处理30 min,最后进行细胞内IL-9染色。荧光标记抗体购自美国e-Bioscience 公司。用流式细胞仪检测不同分组IL-9+细胞。
1.8 Th9细胞体外分化 用德国美天旎生物技术有限公司的小鼠 幼稚CD4+T分离试剂盒分离幼稚T细胞。用anti-CD3和anti-CD28(2 μg·mL-1)包被96孔培养板,加入TGFβ(10 ng·mL-1)、重组鼠(rm)IL-2(10 ng·mL-1)、rmIL-4(10 ng·mL-1)和anti-IFNγ(10 μg·mL-1)分化培养4 d,部分细胞加入PM2.5(50 μg·mL-1),流式细胞术检测IL-9+细胞比例或RT-PCR检测IL-9表达。
1.9 RT-PCR检测 采用德国QIAGEN公司RNeasy Mini Kit 提取RNA,采用随机引物法合成cDNA,然后用SYBR Green(美国ABI公司)法进行荧光定量PCR检测,采用β-actin 作为内参,数据分析采用2-△△CT法[13]。引物由上海生工生物工程技术服务有限公司合成。
1.10 统计学处理 采用SPSS 20.0或GraphPad Prism software 6.0软件进行统计分析。符合正态分布的计量资料采用均数±标准差表示。计数资料以例数( %)来表示。符合正态分布且方差齐性的计量资料组间比较采用两个独立样本t检验分析;不符合正态分布或方差不齐的计量资料采用非参数检验的Mann-WhitneyU检验。P<0.05认为差异有统计学意义。
2 结果
2.1 气道高反应性检测 图2显示,CRE组与PBS组相比,气道阻力增加[Mch 12.5 mg·mL-1:(2.372±0.289)vs(1.743±0.189) cmH2O·mL-1·s-1,P=0.002 1;Mch 25 mg·mL-1:(3.048±0.126)vs(2.209±0.118) cmH2O·mL-1·s-1,P=0.003 7)],表明小鼠哮喘模型建立成功。CRE+PM2.5组与CRE组相比,小鼠气道阻力增加[Mch 12.5 mg·mL-1:(3.028±0.116)vs(2.372±0.289) cmH2O·mL-1·s-1,P=0.040 9;Mch 25 mg·mL-1:(4.044±0.335)vs(3.048±0.126) cmH2O·mL-1·s-1,P=0.015 0)]。

图2 气道高反应性检测
注 1):CRE组vsPBS组,P<0.05;2):CRE组vsCRE+PM2.5组,P<0.01
2.2 PM2.5加重过敏性哮喘小鼠的肺部炎症反应 CRE组与PBS组相比,小鼠肺部炎症增强,表现为支气管周围大量炎症细胞浸润(图3A,B);支气管肺泡灌洗液中炎症细胞总数、嗜酸性粒细胞、巨噬细胞、中性粒细胞、淋巴细胞计数增加(表1)。CRE+PM2.5组小鼠肺部炎症明显增强(图3D),与单用CRE组相比,支气管肺泡灌洗液中细胞总数、嗜酸性粒细胞、中性粒细胞、淋巴细胞计数明显增加,巨噬细胞改变不明显(表1)。与PBS组比较,单用PM2.5组肺部病理改变及炎症细胞数改变不明显(图3C,表1)。

图3 肺组织病理切片HE染色
注 A:PBS组;B:CRE组;C:PM2.5组;D:PM2.5+CRE组

表1 小鼠肺泡灌洗液中炎症细胞分类计数
注 1)PBS组vsCRE组;2)CRE组vsPM2.5+CRE组
2.3 PM2.5在体内促进Th9细胞分化 图4A显示,采用荧光定量PCR法检测肺组织中IL-9的表达,结果显示在小鼠哮喘模型中,CRE组较PBS组IL-9 mRNA转录明显增加[(3.02±0.29)vs(1.0±0.07),P=0.002 4],PM2.5+CRE组较CRE组IL-9转录亦明显增加[(5.95±0.67)vs(3.02±0.29),P=0.016 1];而单用PM2.5组IL-9转录无明显增加(P>0.05)。图4B、C显示,采用流式细胞术检测肺门淋巴结中Th9细胞数量,与荧光定量PCR结果一致,CRE组与PBS组[(4.85±0.53)%vs(0.80±0.11)%,P=0.001 7],及PM2.5+CRE组与CRE组相比[(9.47±0.8)%vs(4.85±0.53)%,P=0.010 7],肺门淋巴结Th9细胞分化明显增加。

图4 PM2.5在体内促进Th9细胞分化
注 A:采用qRT-PCR检测肺组织中IL-9表达;B:采用流式细胞术检测肺门淋巴结中Th9细胞数量;C:流式细胞术检测肺门淋巴结Th9细胞(定量分析);1):CRE组vsPBS组,P<0.05; 2):CRE组vsCRE+PM2.5组,P<0.05
2.4 PM2.5在体外可促进Th9细胞分化 体外实验结果显示,PM2.5组IL-9阳性细胞的比例[(52.0±5.8)%]高于PBS组[(31.7±3.2)%],P=0.002 3(图5)。进一步用qPCR检测IL-9的表达及调控Th9细胞分化的转录因子水平,PM2.5可明显促进IL-9的转录[(3.16±0.18)vs(1.01±0.10),P=0.008 7],以及Th9细胞分化调控转录因子PU.1[(2.16±0.18)vs(0.99±0.09),P=0.027 2]和B细胞活化转录因子(BATF)的转录[(2.31±0.03)vs(1.01±0.10),P=0.006 3]。
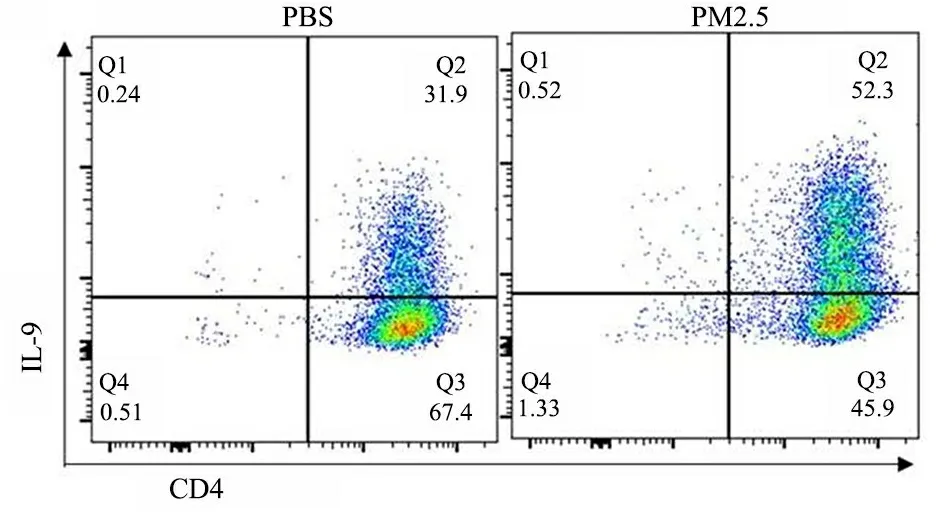
图5 PM2.5在体外可促进Th9细胞分化
3 讨论
流行病学研究结果显示,PM2.5与哮喘发病率增加、症状加重及急诊就诊率上升相关,PM2.5每增长10 μg·m-3,引起哮喘门诊量上升2.0%,但其机制尚不清楚[5]。因此阐明PM2.5诱发及加重哮喘发作的具体机制,探寻防治策略,具有重要的社会和经济学意义。
本研究利用小鼠哮喘模型发现,PM2.5能明显增强过敏原诱导的过敏反应,表现为处理组小鼠的肺部炎症明显增强,支气管肺泡灌洗液中炎症细胞明显增加,肺组织中IL-9明显增多,肺门淋巴结Th9细胞分化增加。Th9细胞是近年来新发现的T细胞亚群,是在转化生长因子-β(TGF-β)及IL-4联合刺激下分化而来,分泌大量IL-9为其主要特点[8]。Th9细胞作为效应性T细胞,在促进组织炎症发生的过程中起着重要作用。研究表明,Th9与哮喘的发生发展有密切的关系:Th9通过分泌IL-9直接作用于支气管平滑肌引起气道高反应;Th9上调Th2细胞因子的分泌同时抑制Th1细胞因子的表达;Th9也可作用于气道上皮细胞使之分泌过量的黏液和趋化因子,引起炎症反应,导致气道上皮细胞的纤维化增生、平滑肌细胞的重构[14~16]。此外,IL-9对多种炎症调节及效应细胞如B细胞、肥大细胞、嗜酸粒细胞及中性粒细胞等均具有重要的调节作用,如其可促进B细胞免疫球蛋白的类别转换,产生免疫球蛋白E(IgE);可促进肥大细胞增殖并诱导其表面高表达FcεRIa受体。此外,还可促进中性粒细胞对多种趋化因子的分泌,从而招募大量炎症细胞,加重气道内的炎症反应,并可招募嗜酸性粒细胞以及促进其成熟和抑制凋亡[7]。因此,我们认为 PM2.5加重哮喘发作的一种重要机制为:通过增强肺内Th9细胞分化,分泌IL-9,加重哮喘的发作。
至今,尚无研究发现Th9细胞分化的决定性转录因子,但研究发现,转录因子PU.1、BATF和IRF4对Th9的分化和功能具有重要作用[8,17~19]。本实验发现PM2.5可明显上调Th9分化相关转录因子PU.1和BATF的表达,表明PM2.5可直接影响Th9细胞分化。但尚未解决的问题是,PM2.5通过何种机制诱导Th9细胞分化。PM2.5的成分非常复杂,包括元素碳、有机碳化合物、硫酸盐、硝酸盐、铵盐和重金属等,在不同地区、不同污染源和不同气象条件下差别迥异。为了验证PM2.5对Th9细胞分化的影响,本课题组还采用了由北京协和医院提供的2016冬季收集的PM2.5,不同地区的PM2.5引起的炎症反应程度会有所差异,但对Th9分化的影响的趋势是一致的。至于具体何种成分影响Th9分化,由于PM2.5成分复杂,目前解析到具体单一成分对Th9细胞的影响,尚有一定难度,但解析不同组分对Th9细胞分化的影响,对于寻找恰当的防治策略将有一定的指导意义。

