枇杷花功能成分及抗氧化活性随生长时间的变化
班新伟,康如如,魏凌云,鲁周民
(西北农林科技大学 林学院,陕西 杨陵 712100)
枇杷(Eriobotryajaponica)系蔷薇科苹果亚科枇杷属植物,主要分布在长江以南各省,是原产于我国的著名亚热带水果[1],含人体所需的多种营养组分,具有极高的营养价值[2],同时具有极高的医疗价值,并且枇杷的果实、种子、花、叶子均可入药[3]。《本草纲目》记载,枇杷具有化痰止咳和胃降气的功效[4]。现有的研究中,以果实为主,叶片次之,对花的相关研究相对较少。
枇杷果树80%~90%的枝条可形成花穗,每花穗约有30~260朵花,一般为70~110朵,但仅有5%~20%的花可结成果实[5]。因此,通过疏花、疏果来调节生长与结果的关系,减少养分消耗,提高产量品质和商品价值,是枇杷丰产、稳产、高效的一项重要技术措施[6]。
近年来,枇杷花的价值越来越受到人们重视,对其研究不断深入。研究表明,枇杷花含有人体所需的18种氨基酸以及维生素C、抗衰老素等和黄酮类、酚类物质、三萜类等多种药用成分[7],具有提神养气、清肺润喉、化痰止咳等功效。枇杷花中含有丰富的类黄酮和酚酸类等生物活性成分[8],其中黄酮类主要的药理作用为护肝、活血化瘀、降脂、抗肿瘤、抑菌及抗氧化、抗衰老和抗疲劳、增强免疫调节等[9]。酚类物质,其结构上的特点是在苯环上具有一个或多个羟基,通常以酯化或糖苷化的形式存在于植物组织中,正是这种特殊的结构,使其具有猝灭单线态氧和清除自由基的作用[8]。
近年来,国内外关于枇杷花所含总黄酮和总酚的研究主要集中在化学成分鉴定和含量测定[10-12]、药效学研究[13-15]以及提取工艺[16-18]等方面,关于枇杷花功能成分及抗氧化性能随时间变化研究未见报道。本文主要对不同生长时期枇杷花中的黄酮、总酚含量以及抗氧化活性指标进行测定,并对各指标间进行相关性分析,旨在为枇杷花功能成分更深层次的研究以及适宜的疏花时期提供科学依据。
1 材料与方法
1.1 材料与试剂
材料:枇杷花,采自西北农林科技大学校园枇杷园的实生枇杷树。
试剂:三氯化铁、氯化钠、氯化钾与过硫酸钾产自国药集团化学试剂公司;磷酸二氢钠、磷酸二氢钾、九水合硝酸铝、亚硝酸钠、无水碳酸钠、没食子酸、芦丁、无水乙醇、氢氧化钠产自广东光华科技股份有限公司生产;福林酚试剂(1N)产自上海荔达生物科技有限公司;盐酸、乙酸钠产自天津光复精细化工研究所;ABTS、DPPH、Trolox、TPTZ产自上海蓝季生物科技有限公司。以上试剂均为分析纯。
1.2 仪器设备
KH-500DE数控超声波清洗器(昆山禾创超声仪器有限公司)、H1850医用离心机(湖南湘仪实验室仪器开发有限公司)、DK-S24电热恒温水浴锅(上海森信实验仪器有限公司)、UV-VIS紫外可见分光光度计、破碎机(九阳股份有限公司)。
1.3 试验方法
1.3.1 采样 在枇杷花开放后,从2017年11月2日开始,每隔7 d左右,在枇杷树四周采样1次,至2017年12月16日结束,共采样7次。每次采样时间均为10:00-11:00,采样质量分别为:48.2、44.6、50.1、42.2、51.3、48.7 g和43.6 g。
1.3.2 样品处理 样品采回后立即放入破碎机中,粉碎5 min成粉末状。精确称取枇杷花粉末2.5 g(精确到0.000 1 g)3份于3个50 mL离心管中,分别加入50%、75%乙醇和无水乙醇溶液25 mL,遮光浸提12 h。再超声辅助提取30 min、温度35℃、超声频率100 Hz。在转速9 800 r/min下离心10 min。取上清液分装于10 mL储液管中冷冻保存备用。为消除样品本身差异带来的误差,本试验中每个处理重复9次。
1.4 指标测定方法
1.4.1 总黄酮含量 参照文献[19],采用硝酸铝比色法测定总黄酮含量。
称取芦丁0.1 g,用50%乙醇定容至100 mL,超声20 min辅助溶解。精密移取浓度为1 mg·mL-1的芦丁标准液0(1号管)、0.2、0.4、0.6、0.8、1.0、1.2 mL和1.4 mL于10 mL试管中,依次分别加入75%乙醇3.0、2.8、2.6、2.4、2.2、2.0、1.8 mL和1.6 mL摇匀,各加入5%亚硝酸钠1.0 mL,摇匀,静置6 min,加入1.0 mL 10%的硝酸铝,摇匀,静置6 min,最后加入4%氢氧化钠溶液5 mL,静置15 min,得到芦丁标准品浓度梯度显色溶液。以1号管溶液作参比,在510 nm处测定吸光值。以吸光值y对质量浓度进行回归,y=12.257x+0.036 7,R2=0.999 2。标准品芦丁含量在0~0.14 mg·mL-1范围内与吸光值线性关系良好。
分别取枇杷花溶剂系统提取液0.5 mL代替芦丁标准液,按此方法测定,计算结果,结果以mg·g-1表示。
1.4.2 总酚含量 参照文献[20],采用Folin-Ciocalteu比色法测定总酚含量。
精密移取浓度为0.1 mg·mL-1的没食子酸标准液0(1号管)、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL于10 mL试管中。依次加入8.0、7.8、7.6、7.4、7.2、7.0、6.8、6.6 mL蒸馏水,0.5 mL FC显色剂, 1.5 mL 7.5%碳酸钠溶液混匀,置于75℃水浴加热15 min,冷却至室温。以1号管溶液做参比,在765 nm处测定吸光值。以吸光值y对没食子酸浓度进行回归,y=84.071x+0.034,R2=0.997 6。标准品没食子酸含量在0~0.014 mg·mL-1范围内与吸光值线性关系良好。
分别取枇杷花溶剂系统提取液0.2 mL代替没食子酸标准液按此方法测定,各样品9个重复,结果以mg·g-1表示。
1.4.3 DPPH自由基清除率 参照文献[21],在试剂用量和时间上略加修改。
将50%和75%乙醇浸提液稀释20倍,无水乙醇浸提液稀释10倍,吸取样液各0.2 mL于试管中,加入0.1 mmol/L DPPH 4 mL,混匀,室温25℃左右避光反应30 min,517 nm下测定吸光值(Ai)。吸取0.2 mL样液与4 mL 无水乙醇于试管中混匀,同样的方法测定吸光值(Aj);将4 mL DPPH与0.2 mL浸提溶剂于试管中混匀,同样的方法测定吸光值(Ac)。按下列公式计算清除率(K)。
K=(1-(Ai-Aj)/Ac)×100%
1.4.4 ABTS自由基清除率 参照文献[22]测定ABTS自由基清除率。
用蒸馏水配制7 mmol/L ABTS溶液,与2.45 mmol/L K2S2O8,1∶1混合于棕瓶中,反应过夜(12~16 h),测定之前用PBS缓冲液稀释至734 nm下的吸光值为0.7±0.002。
将50%和75%乙醇浸提液稀释20倍,无水乙醇浸提液稀释10倍,吸取0.1 mL样液,再加入3.99 mL ABTS反应液于试管中混合均匀,37°水浴10 min,734 nm下测定吸光值(As)。将样品的浸提溶剂与ABTS反应液于试管中混合均匀,按上述方法测定吸光值(Ac)。按下列公式计算清除率(K)。
K=(1-As/Ac)×100%
1.4.5 FRAP试验 参照吴媛琳[2]的方法进行FRAP试验。
将300 mmol/L乙酸钠、10 mmol/L TPTZ(用40 mmol/L HCl配制)与20 mmol/L FeCl3按10∶1∶1的比例混合均匀,现配现用。吸取0.6 mL的400、200、100、50、25、12.5、6.25、0 μmol/L Trolox标液于各试管中,再加入4.5 mL预热至37℃的FRAP工作液,37℃反应10 min,593 nm测定吸光值。以Trolox浓度μmol/L为横坐标,相应吸光值为纵坐标绘制标准曲线,得到线性回归方程:y=0.003 5x+0.016,R2=0.997 3。结果显示,Trolox浓度在0~400 μmol/L范围内与吸光值线性关系良好。
将50%和75%乙醇浸提液稀释200倍,无水乙醇浸提液稀释100倍,用同样的方法测定样品吸光值,在标准曲线上求得相应的Trolox浓度μmol/L,结果用Trolox当量表示(μmol TEAC/g)。
1.5 数据统计分析
采用Excel2010,SPSS20.0对所得数据进行统计分析、差异性分析和相关性分析。
2 结果与分析
2.1 黄酮含量随时间变化分析
由图1可知,枇杷花在开放的不同时期中,总黄酮的含量呈先上升后下降的趋势。3种乙醇浓度提取法,总黄酮含量变化规律相近。2017-11-02的样品50%、75%和无水乙醇浸提液总黄酮含量依次为(7.549±0.041)mg·g-1、(6.325±0.082)mg·g-1和(2.257±0.052)mg·g-1,含量较低;之后含量开始上升。2017-11-27的样品50%、75%乙醇和无水乙醇浸提液总黄酮含量依次为(20.401±0.474)mg·g-1、(22.599±0.254)mg·g-1和(8.331±0.000)mg·g-1,含量达到最高值;在后续测定中又呈现降低的趋势,2017-12-11的样品50%、75%乙醇和无水乙醇浸提液总黄酮含量依次为(16.474±0.457)mg·g-1、(14.962±0.180)mg·g-1和(6.140±0.294)mg·g-1。
通过差异性检验得出,50%与75%乙醇浸提液总黄酮含量差异不显著(P>0.05),但均显著高于无水乙醇浸提处理总黄酮含量(P<0.05)。
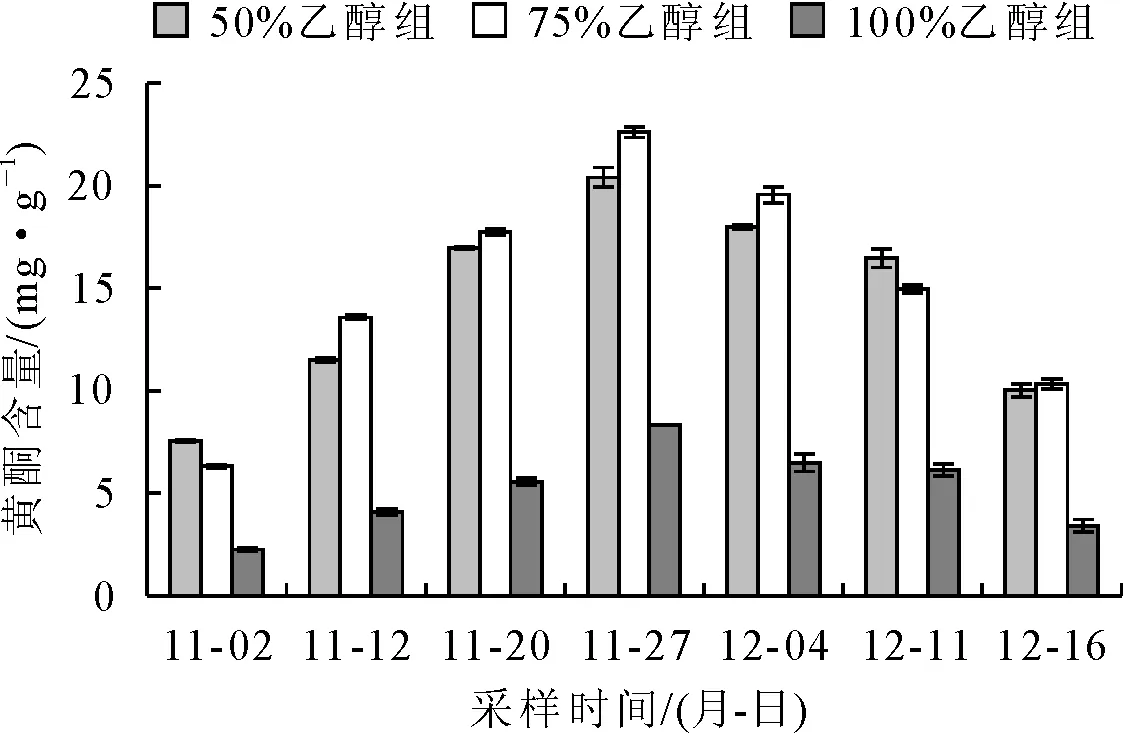
图1 黄酮含量随时间变化
2.2 总酚含量随时间变化分析
由图2可知,枇杷花在开放的不同时期中,总酚的含量呈先上升后下降的趋势,变化幅度较小。3种乙醇浓度提取法,总酚含量变化规律相近。2017-11-02的样品50%、75%乙醇和无水乙醇浸提液总酚含量依次为(3.858±0.036)mg·g-1、(3.233±0.024)mg·g-1和(2.060±0.009)mg·g-1,含量较低;2017-11-27的样品50%、75%乙醇和无水乙醇浸提液总酚含量依次为(5.840±0.079)mg·g-1、(5.702±0.016)mg·g-1和(3.727±0.055)mg·g-1,在采样时间区段达到了高值;2017-12-04的样品总酚含量与2017-11-27差异不显著(P>0.05),50%、75%乙醇和无水乙醇浸提液总酚含量依次为(5.638±0.144)mg·g-1、(5.640±0.080)mg·g-1和(3.995±0.055)mg·g-1。后续的样品,总酚含量呈现下降的趋势。
通过差异性检验得出,50%与75%乙醇浸提处理总酚含量差异不显著(P>0.05),但均显著高于无水乙醇浸提液总酚含量(P<0.05)。
2.3 DPPH清除率随时间变化分析
由图3可知,枇杷花在开放的不同时期,DPPH自由基清除率呈现出先升高后降低的趋势。3种乙醇浓度浸提法,DPPH自由基清除率变化趋势相近。2017-11-02的DPPH自由基清除率50%、75%乙醇和无水乙醇浸提液依次为(14.798±0.706)%、(21.786±0.950)%和(3.042±0.239)%。之后呈上升趋势。不同浸提方法均在2017-12-04日左右达到峰值,50%、75%乙醇和无水乙醇浸提液测得的DPPH自由基清除率依次为(79.094±1.153)%、(80.281±2.493)%和(35.115±0.933)%,显著高于其他时间(P<0.05)。之后开始下降,2017-12-16的DPPH自由基清除率介于11.20与11.27的测定值,50%、75%乙醇和无水乙醇浸提液依次为(41.010±1.915)%、(55.132±1.491)%和(9.994±0.912)%。
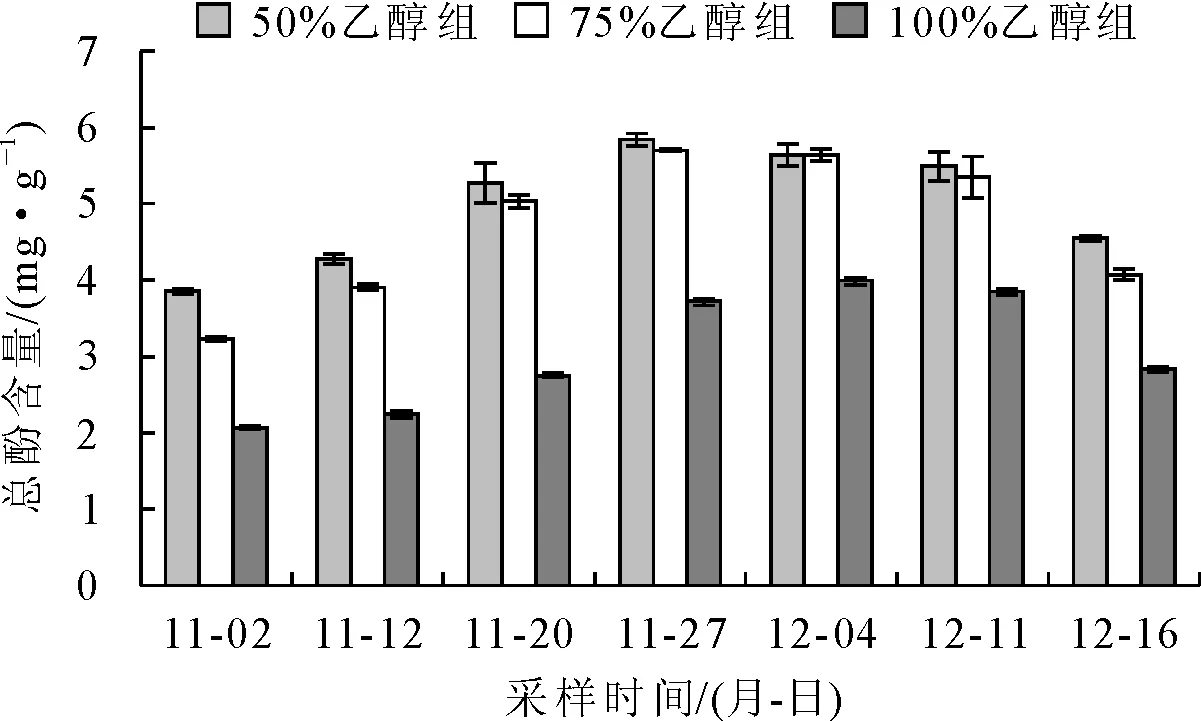
图2 总酚含量随时间变化
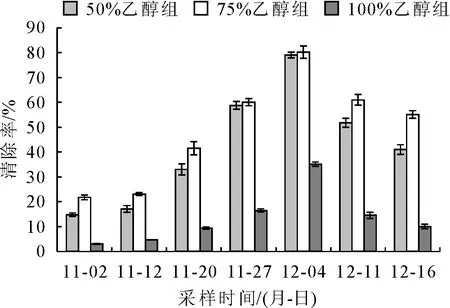
图3 不同采样时间枇杷花的DPPH自由基清除率
通过差异性检验得出,50%和75%乙醇浸提液测得的DPPH自由基清除率差别不显著(P>0.05),但均显著高于无水乙醇浸提液(P<0.05)。
2.4 ABTS自由基清除率随时间变化分析
由图4可知,枇杷花在开放的不同时期,清除ABTS+·的能力呈现出先升高后降低的趋势。不同浓度乙醇浸提液变化趋势相同。2017-11-02的ABTS自由基清除率50%、75%乙醇和无水乙醇浸提液分别为(28.167±1.342)%、(29.167±1.933)%和(8.283±0.466)%。之后呈上升趋势,2017-11-27达到峰值,50%、75%乙醇和无水乙醇浸提液的ABTS自由基清除率依次为(77.642±0.84)%、(78.963±1.458)%和(47.188±1.268)%,显著高于其他时间(P<0.05)。之后开始下降,2017-12-16的ABTS自由基清除率50%、75%乙醇和无水乙醇浸提液分别为(18.149±1.388)%、(25.813±1.233)%和(6.428±0.739)%,为整个观测过程中的最低值。
通过差异性检验得出,50%和75%乙醇浸提液的ABTS自由基清除率差别不显著(P>0.05),但均显著高于无水乙醇浸提液(P<0.05)。
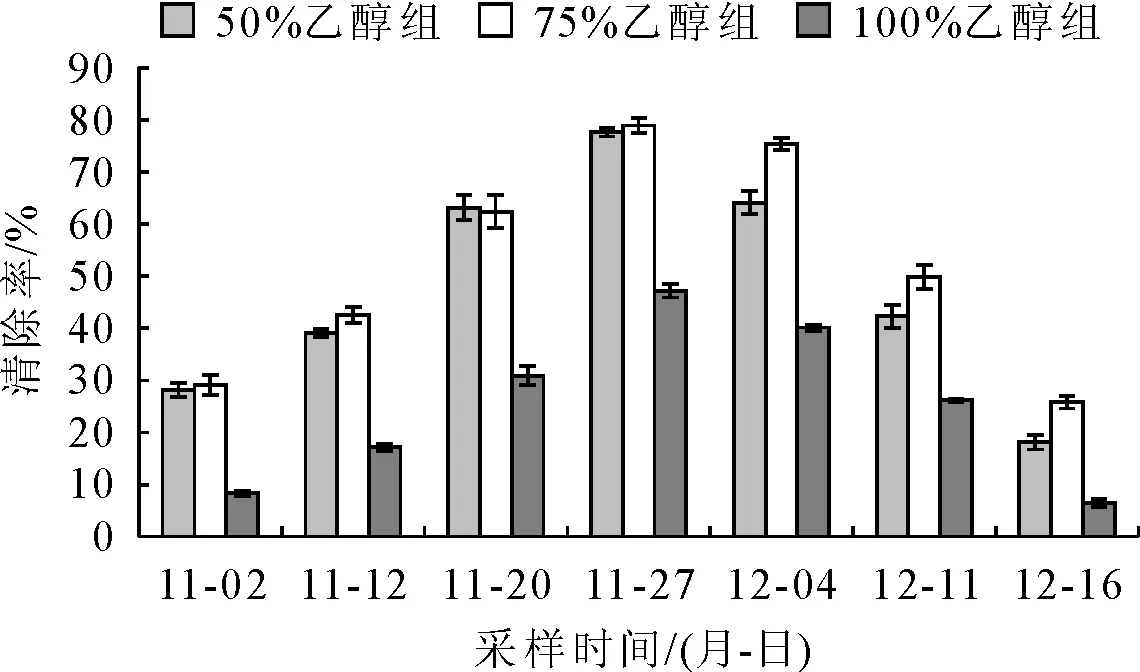
图4 ABTS.+法测定不同采样时间枇杷花的自由基清除率
2.5 FRAP试验体系中抗氧化活性随时间的变化分析
由图5可知,枇杷花在开放的不同时期,用FRAP法测抗氧化活性先升高后降低,不同浸提方法趋势变化相同。抗氧化活性用Trolox当量表示,2017-11-02的50%、75%乙醇和无水乙醇浸提液的抗氧化活性依次为(209.587±3.223)μmol TEAC/g、(171.429±4)μmol TEAC/g和(73.905±4.466)μmol TEAC/g。之后呈上升趋势,不同浸提液均在2017-12-04左右达到峰值,显著高于其他时间(P<0.05)。50%、75%乙醇和无水乙醇浸提液的抗氧化活性依次表示为(406.540±10.876)μmol TEAC/g、(436.952±7.800)μmol TEAC/g和(144.571±3.010)μmol TEAC/g。之后呈下降趋势,2017-12-16的抗氧化活性稍高于开始时的测定值,50%、75%乙醇和无水乙醇浸提液依次为(232.127±3.014)μmol TEAC/g、(271.587±3.330)μmol TEAC/g和(85.810±2.106)μmol TEAC/g。
通过差异性检验得出,50%和75%乙醇浸提液测得的抗氧化活性差别不显著(P>0.05),但均显著高于无水乙醇浸提液(P<0.05)。
2.6 5个指标间的相关性分析
表1中的黄酮、总酚含量以及抗氧化活性指标的数据,均为7个批次的试验全部结束后,将各次试验数据取平均值所得。提取溶剂为75%乙醇。
由表1可以看出,总酚含量和FRAP试验体系下测得的抗氧化活性之间有较高的相关性,相关性系数为0.953;除此之外,黄酮含量和ABTS自由基清除率之间也有较高的相关性,相关性系数为0.954。而对同一类指标来说,功能性成分中总酚含量与黄酮含量之间表现出一定的相关性,相关性系数为0.917;对抗氧化活性的指标来说,DPPH自由基清除率与FRAP试验体系下测得的抗氧化活性间表现出一定的相关性,相关性系数为0.916。
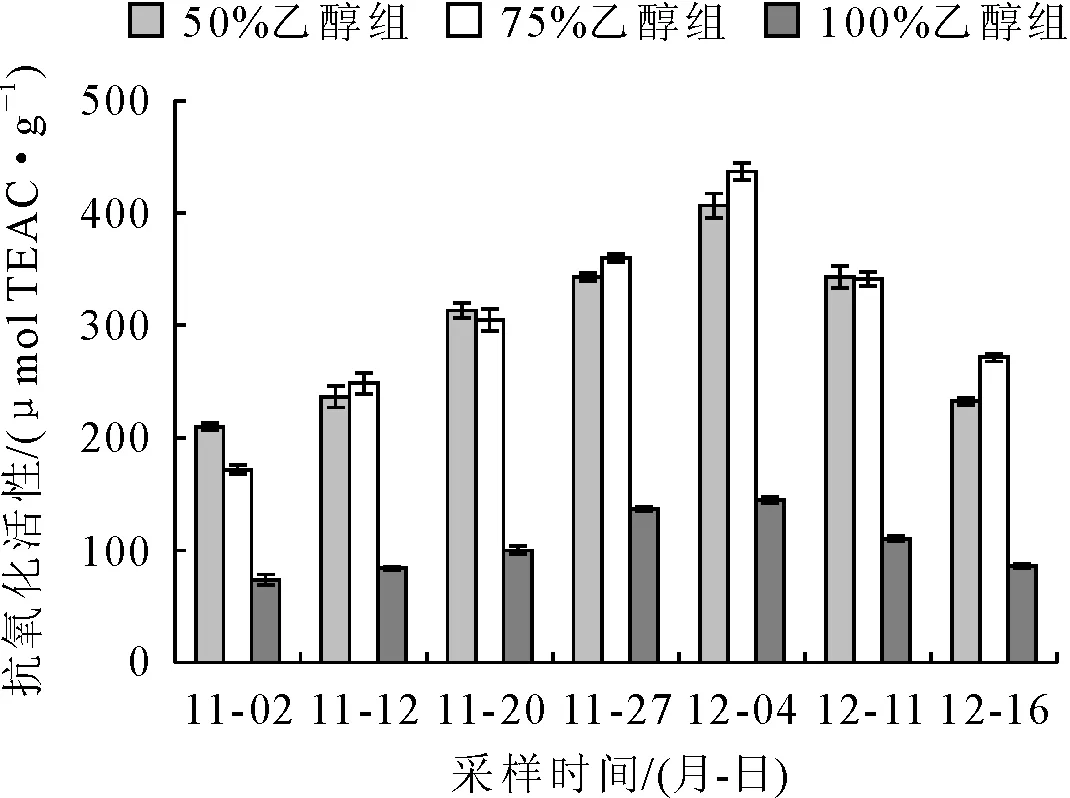
图5 FRAP法测不同采样时间的枇杷花抗氧化活性
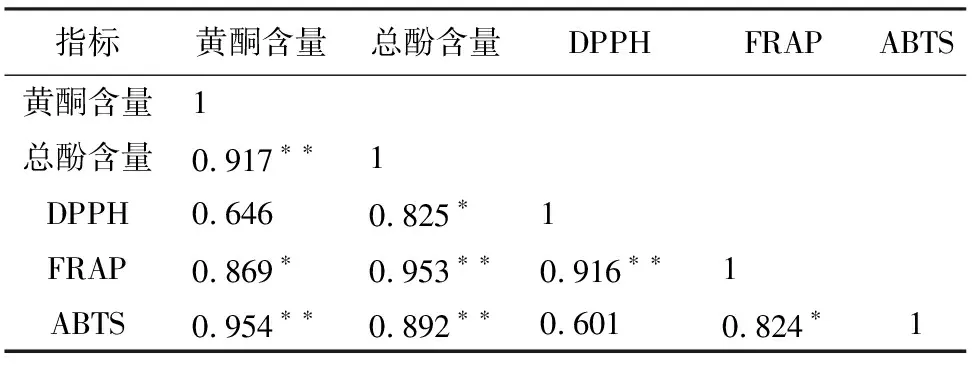
表1 5个指标的相关性分析
注:**.在0.01 水平(双侧)上显著相关;*.在 0.05 水平(双侧)上显著相关。
黄酮含量与DPPH自由基清除率的相关性较低,相关性系数仅为0.646;DPPH自由基清除率与ABTS自由基清除率之间也有较低的相关性,相关性系数为0.601。
3 结论与讨论
本试验结果表明,枇杷开花后,随着生长时间的变化,花中总黄酮和总酚含量呈现先上升后下降的趋势,DPPH、ABTS自由基清除率和FRAP试验体系下测定的抗氧化活性也呈现出先升高后降低的趋势,均在11月末12月初达到峰值。
枇杷花在11月底到12月初,总黄酮和总酚的含量显著高于其他时间,抗氧化活性也在此时期达到峰值,为疏花利用提供了理论指导。上述疏花时间与王智圣[7]等提供的疏花穗时间基本一致。
50%与75%乙醇浸提处理的枇杷花总黄酮与总酚含量、3种抗氧化活性测定的指标差异均不显著(P>0.05),但均显著高于无水乙醇浸提处理(P<0.05),为疏掉的枇杷花的利用方法提供参考。该结论与王静波[13]的研究结论基本一致,枇杷花各提取物总黄酮含量为50%乙醇提取物>75%乙醇提取物>95%乙醇提取物。
对枇杷花的功能成分和抗氧化活性指标进行相关性分析得出,ABTS自由基清除率与总黄酮含量、FRAP试验体系下测定的抗氧化活性与总酚含量间分别存在较高的相关性(相关性系数>0.9)。
试验中提取液制备为湿提,还未见相关报导,关于干花的研究颇多,总黄酮含量在2.257~22.599 mg·g-1;蒋定文[21]等测定的白沙枇杷干花总黄酮含量为38.7 mg·g-1;黄琼[18]等用60%乙醇提取枇杷干花总黄酮为83.7 mg·g-1。不同研究者得到的结果不同,除处理差异和误差所致外还可能与枇杷花富含绿原酸有关,绿原酸的存在对总黄酮的测定有显著的影响[22]。总酚含量的测定,该试验总酚含量在2.060~5.840 mg·g-1;周春华[23]用乙醇提取的枇杷干花总酚含量为8.3367 mg·g-1。枇杷花功能成分含量的差异与多种因素有关,有待于进一步探究。

