野黄芩苷对阿尔茨海默病小鼠的治疗作用
田世元 邵 玉 张璐妮 张玉影 陈加俊 刘晓阳
(吉林大学中日联谊医院神经内三科,吉林 长春 130033)
野黄芩苷(SCU)是从黄芩茎叶、灯盏和细辛等药物中分离得到的一种黄酮类化合物。目前,普遍认为SCU对心脑血管系统具有较好的调节功能。研究发现,SCU具有抗氧化应激〔1〕、调节钙离子〔2〕、保护神经系统〔3〕等作用。在心肌保护方面,研究证明长期使用SCU可以抑制心肌间质纤维化,其主要途径包括抑制纤维连接蛋白(FN)1、转化生长因子(TGF)-β1的表达和p38-丝裂原活化蛋白激酶(MAPK)、细胞外信号调节激酶(ERK)1/2 的磷酸化,进而改善心肌梗死小鼠的心脏功能〔4〕。在促进新生血管形成方面,SCU可调节血小板内皮黏附分子、诱导基质金属蛋白酶(MMP)-2的活化及表达,进而促进血管内皮细胞的增殖〔5〕。在神经保护方面,SCU可明显改善缺血性脑卒中患者的临床表现。动物实验已证实,SCU在大鼠瞬时脑缺血时可以通过抑制聚ADP 核糖聚合酶(PARP)依赖的线粒体功能障碍和细胞凋亡诱导因子(AIF)的易位,减轻脑损伤,发挥神经保护效应〔6〕。但在行为和认知方面,有关SCU的作用还未曾报道。本文旨在成功建立阿尔茨海默病(AD)小鼠模型,探讨SCU对AD小鼠学习和记忆能力的影响。
1 材料与方法
1.1材料 50只小鼠由吉林大学实验动物中心提供,均为8周龄的昆明种小鼠,雌雄各半,20~30 g。SCU购于中国食品药品检定所。Y-型迷宫来自三兴声电公司生产的MG-3型Y型迷宫。
1.2建立小鼠AD模型 在小鼠双侧海马内注射寡聚态β淀粉样蛋白(Aβ)1~42,将其制成AD模型。通过对Y型迷宫的被动回避反应实验,筛选出符合实验要求的AD模型小鼠。
1.3实验分组 根据体重不同随机分为正常对照组、模型对照组(寡聚态 Aβ1~42 0.1 ml/10 g)、低剂量组(SCU 10 mg/kg)、中剂量组(SCU 20 mg/kg)、高剂量组(SCU 40 mg/kg)各10只,低、中、高剂量组分别于造模后第15天开始给予SCU,持续给药15 d。
1.4小鼠学习能力和记忆保持的检测 采用MG-3型Y-型迷宫行暗环境被动回避反应,MG-3型Y-型迷宫由等长(16 cm)的Ⅰ、Ⅱ、Ⅲ臂和三者的交界区组成,箱底铺设直径0.3 cm、间距1.2 cm的铝栅,用挡板挡住Ⅲ臂,用黑布包裹Ⅱ和Ⅲ臂形成实验用暗室;Ⅰ臂顶端装一盏15 W的白炽灯形成实验用明室。将小鼠放入明室(Ⅰ臂)中,由于小鼠先天的趋暗习性,迫使其进入暗室;暗室铝栅通电(0.3 mA、50 Hz)后,受电刺激的小鼠逃回明室,之后重复上述训练,训练间隔20 s,直至小鼠在明室的停留时间≥10 min,说明学会。记录每组学会需要的训练次数,并观察各组学习过程的变化。最后学习达标的小鼠休息1 w,于第10天重新开始先前的测试,并记录小鼠进入暗室前在明室停留的时间(即进洞潜伏期),分析各组休息10 d后的记忆保持能力。
1.5统计学分析 采用SPSS17.0软件进行t检验。
2 结 果
2.1AD小鼠模型的测试与筛选 模型对照组学习和记忆能力明显低于正常对照组(P< 0.01),即AD小鼠模型建模成功。见表1。
2.2各组学习记忆能力的改变 低、中、高剂量组学会所需训练次数均明显少于模型对照组(P<0.01),高剂量组与正常对照组差异有统计学意义(P<0.01)。停止训练后,低、中、高剂量组进洞潜伏期明显高于模型对照组(P<0.01),但与正常对照组差异无统计学意义(P>0.05)。见表2。
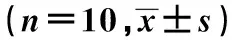
表1 各组学会所需训练次数及进洞潜伏期比较
与正常对照组比较:1)P<0.01
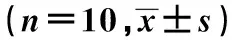
表2 各组学会所需训练次数及进洞潜伏期比较
与模型对照组比较:1)P<0.01;2)与正常对照组比较:2)P<0.01
3 讨 论
AD是一种中枢神经系统变性疾病,原发性、不可逆性、慢性进行性是其发病特点。AD的主要病理特征为患者大脑皮层和海马区因Aβ沉积而形成大量老年斑(SP),神经元胞体内可因tau蛋白异常聚集出现神经原纤维缠结(NFT),此外还有神经元细胞的大量丢失,其中SP及NFT 为AD 的两个最为典型的病理学改变〔7〕。AD主要影响患者的认知功能及学习记忆功能,认知功能、学习记忆功能是人类的高级神经功能,这些功能的减退或丧失是大脑神经元细胞衰老的重要标志。AD患者临床上主要表现为进行性学习记忆功能损伤和认知功能障碍。关于AD的病因及发病机制迄今尚无明确定论。普遍观点认为AD的发病与多种因素有关,如年龄、家族遗传、代谢性因素、雌激素缺乏等。传统观点认为AD的发病可能与胆碱能系统功能减退、谷氨酸(GLU)能神经递质功能障碍、免疫炎症反应、氧自由基损伤、细胞凋亡等有关。最近研究报道从基因和分子水平对AD的发病机制进行了阐述,①tau蛋白异常学说:tau蛋白已经被证实是一种含磷糖蛋白〔8〕,也是一种微管相关蛋白(MAP),可与微管结合并保持微管的稳定性。Weingarten等〔8〕在钝化微管蛋白时首次分离出了这种蛋白。tau蛋白具有合成和稳定神经元细胞的作用,现代分子生物学已证实AD患者体内tan蛋白表达明显增加,这些蛋白通常以过度磷酸化的形式存在。tau 蛋白过度磷酸化假说认为,tau 蛋白过度磷酸化在AD 发病机制的早期起重要作用〔9〕。tau 蛋白的过度磷酸化加快了tau 蛋白在大脑和脑脊液中的积累并进一步形成NFT〔9〕。此外,过度磷酸化的tau 蛋白不仅与tau、MAP1、MAP2 等微管蛋白竞争性地结合微管从而使微管解聚,微管系统瓦解,影响轴浆的运输功能,而且使自身与微管蛋白的结合能力下降〔8,9〕。②Aβ 级联反应学说:AD是由膜内淀粉样前体蛋白(APP)的异常水解和错误折叠所致的一种淀粉样变性疾病,Aβ42是其中的一种水解产物,也是主要的致病形式,能导致Aβ沉积,进而发展为SP〔10,11〕。研究显示,Aβ抑制脑中大分子量蛋白酶的活性,导致Aβ无法降解,这样就进入了一个Aβ聚积的恶性循环〔12〕。此外,在AD患者中,Aβ的异常沉积形成免疫原,导致小胶质细胞和星形胶质细胞被激活,补充和释放炎性因子,通过直接或间接慢性免疫反应的作用,造成神经元损害〔13〕。③基因突变学说:AD患者基因突变通常位于21号染色体、14号染色体和1号染色体上,目前已经报道过的基因突变包括APP基因、载脂蛋白(Apo)E基因、早老素1基因和早老素2基因,其他可能导致AD的基因位点存在于9、10、12和19号染色体上〔14〕。目前被大多数学者所接受的是Aβ 级联反应学说,即Aβ在大脑内特定区域聚集,进而引发神经元凋亡、NFT、氧化应激及胆碱能系统损伤等一系列病理变化,这些病理性改变在AD的进程中发挥重要作用〔15,16〕。
目前治疗AD的药物种类繁多,但主要有以下两大类:胆碱酯酶抑制剂(如:多奈哌齐,加兰他敏和利伐斯的明)和非竞争性N-甲基-D-天冬氨酸受体拮抗剂(美金刚),这些药物虽然有助于AD患者认知功能的改善,但不能阻止进行性神经变性〔17,18〕。此外,上述药物均存在轻-中度的副作用,如多奈哌齐的主要不良反应有恶心、呕吐、腹泻、头晕、失眠、肌肉痉挛等;美金刚片的常见不良反应有幻觉、意识模糊、头痛、头晕、疲倦等。SCU药理作用研究主要集中在其对心血管系统的调节功能。它具有对抗氧化应激的作用,可以减轻PC12细胞由氧化应激反应而引起的细胞凋亡〔1〕。SCU也具有抗心肌肥厚的药理作用,可以通过调控钙调蛋白激酶(CaMK)Ⅱ信号通路和钙调神经磷酸酶介导Ca2+来发挥抗心肌肥厚〔2〕。SCU还可通过抑制小胶质细胞的炎症反应而起到神经保护作用〔3〕。有学者证实,SCU在体外可以抑制Aβ聚集,进而防止了由Aβ介导的细胞凋亡〔19〕。另外,SCU还可能通过G蛋白耦联受体(GPR)30介导的非基因组信号传导途径来预防Aβ诱导的神经元损伤〔20~22〕。一些SCU具有较强的抗氧化活性,但抗Aβ聚集和(或)抗Aβ诱导的细胞凋亡没有明显效果〔23〕。据世界卫生组织预测,到21世纪中期,全球将有1.07亿人患AD〔24〕。本研究结果提示SCU可以明显提高小鼠的学习能力和短期记忆能力,揭示了SCU对神经的保护作用,从而为药物治疗AD提供了新的思路和方法。
——水芹主要害虫识别与为害症状

