生脉饮与四君子汤中用生晒参或红参对巨噬细胞免疫作用的比较研究
张 凡 赵 远 曹丽娟 姜恒丽 贾天柱▲
1.辽宁中医药大学药学院,辽宁大连 116600;2.辽宁省中药炮制工程技术研究中心,辽宁大连 116600;3.上药康丽(常州)药业有限公司,江苏常州 213100;4.盛实百草药业有限公司,天津 300301
四君子汤首载于《太平惠民和剂局方》,组方为人参、麸白术、茯苓、炙甘草,是益气健脾,为治疗脾胃气虚证的基础方剂[1]。生脉饮首载于《医学起源》,组方为人参,麦冬,五味子,功效为益气生津,敛阴止汗,多用于心血管疾病的治疗[2]。在原方中四君子汤是以生晒参纳入方剂用药的,而生脉饮中则是以红参纳入方剂的。人参作为百草之王,有多种炮制品,常用的炮制品为生晒参和红参。生晒参经过蒸制而得红参,在炮制过程中活性成分发生了量变和质变[3]。在临床应用方面,生晒参多用于补气生津,治疗气阴不足,津伤口渴等症,以清补为佳; 红参则味甘性温,以温补为主,常用于治疗体虚欲脱,肢冷脉微,气不摄血等症[4]。药效学显示,四君子汤和生脉饮均有一定的免疫调节的作用[5-6],但在四君子汤和生脉饮中,这两种方剂的原方选择不同的人参炮制品入药,其原理并没有相关报道,故在本实验中先应用CCK-8法测定RAW264.7细胞存活率来筛选给药浓度,ELISA 法检测细胞培养液中NO、ROS、TNF-α的含量来评价免疫效果,进而从体外细胞效应角度评价人参生熟饮片对四君子汤和生脉饮对免疫调节的差异,确定四君子汤中最佳的人参炮制品种。故本实验以不同的侧重点,将不同饮片纳入相同方剂,将相同饮片纳入不同方剂,以期找出差别,说明原理,进而从方剂层面说明人参的生熟差异,为人参在临床使用中提供科学依据,促进人参的合理用药提供科学依据[7]。
1 材料与方法
1.1 药材
人参鲜品购自辽宁省桓仁县,对照2010版中华人民共和国药典鉴定为五加科植物人参(Panax ginseng C.A.Mey)的根。各人参炮制品由辽宁省中药炮制工程技术研究中心制备。白术(购自安徽济人药业有限公司,批号:111018),茯苓块(购自安徽济人药业有限公司,批号:120716),甘草(购自安徽济人药业有限公司,批号:120608),麦冬(购自安徽济人药业有限公司,批号:120506),五味子购自丹东大梨树五味子GAP基地。
1.2 试剂
DMEM高糖培养基(Thermo公司);胎牛血清(Thermo公司);胰酶、EDTA (Reanta公司) 青霉素、链霉素双抗(Thermo公司);中性红粉末(上海哈灵生物医药科技有限公司);HANKS液(上海哈灵生物医药科技有限公司);CCK-8试剂盒 (上海哈灵生物医药科技有限公司); NO、ROS、TNF-αELISA试剂盒(上海哈灵生物药业有限公司);DMSO 为ACS级;75%医用消毒酒精;小鼠腹腔巨噬细胞RAW264.7细胞株(由美国模式培养物集存库ATCC提供),并冻存于辽宁中医药大学炮制实验室-80℃冰箱中备用。
1.3 仪器
超净工作台(上海智城 ZHJH-C1112B),倒置显微镜(宁波永新NIB-100),CO2培养箱(日本三洋MCO-15AC),Alpha 4冷冻干燥机(Christ北京思达兴业仪器有限公司)Multiskan MK3酶标仪(Thermo公司),细胞培养用具等。
1.4 方法
1.4.1 样品制备 生晒参四君子汤的制备:取生晒参、麸白术、茯苓、炙甘草按照3∶3∶3∶2的比例400mg,加10倍量的蒸馏水浸泡0.5 h,煎煮2次后,过滤,合并滤液,浓缩并冻干成粉,再用DMEM溶解冻干粉,配制成含生药量为100、200、400、800、1600、3200、4000mg/L 的 培 养 液,混 匀,0.22μm 滤膜滤过,置-20℃备用。
红参四君子汤的制备:将上方中的生晒参换为红参,用制备生晒参四君子汤的方法制备红参四君子汤,制备相同浓度的含药培养基,保存备用。
生晒参生脉饮的制备:取生晒参、麦冬。五味子按照1∶2∶1的比例400mg,加10倍量的蒸馏水浸泡0.5h,煎煮2次后,过滤,合并滤液,浓缩并冻干成粉,再用DMEM溶解冻干粉,配制成含生药量为 100、200、400、800、1600、3200、4000mg/L 的培养液,混匀,0. 22μm 滤膜滤过,置-20℃备用。
红参生脉饮的制备:将上方中的生晒参换为红参,用制备生晒参生脉饮的方法制备红参生脉饮,制备相同浓度的含药培养基,保存备用。
1.4.2 RAW264.7细胞培养 细胞按常规培养,DMEM 培养基,10%胎牛血清,1%青链霉素双抗,置于 37℃ ,5% CO2细胞培养箱中培养,0.25% 胰酶消化传代,选取对数生长期细胞进行实验。
1.4.3 CCK-8法筛选RAW264.7细胞不同给药浓度 以生晒参四君子汤及红参生脉饮为例,筛选最佳的给药浓度范围。调整细胞浓度至3×104/mL 接种至入 96 孔板100μL,并留出1个孔,不加细胞悬液,作为空白对照组,培养24h后,再弃去原培养液,并在 96 孔板中依次加入生晒参四君子汤 4000,3200,1600,800,400,200mg/L 各 10μL,不加药液的不干预组作对照; 培养24 h,加入10μL CCK-8试剂后再孵育4h,用酶标仪以540nm波长测定吸光度 A。每给药组设5个副孔,取平均值计算其细胞活力 = (A药液-A空白)/( A不干预-A空白)× 100%。
1.4.4 对小鼠腹腔巨噬细胞吞噬中性红的影响[8]将小鼠腹腔巨噬细胞接种于96孔细胞板,贴壁后加入100、200、400和800mg/L浓度的生晒参四君子汤,红参四君子汤,生晒参生脉饮,红参生脉饮药物(以下简称生四君,红四君,红生脉和生生脉),孵育24h,弃上清,加质量浓度为0.75g/L中性红200μL/孔,置37℃,5% CO2孵箱培养30min后弃上清,Hanks液200μL/孔,洗3遍,最后每孔加150μL Hanks液,反复冻融,直到细胞破裂,540nm下测定OD值,按下公式计算吞噬增加率/%=(A药液-A对照)/A对照×100%。每给药组设 3 个副孔。
1.4.5 对巨噬细胞NO、ROS、TNF-α释放的影响[9-11]RAW264.7细胞消化后,调整细胞浓度为3×104/mL,向96孔细胞培养板中加入100μL细胞悬液,培养24h待其贴壁后,弃去上清液。处理组各加入200μL的生四君,红四君,红生脉和生生脉提取液,对照组加入200μL DMEM完全培养液。37℃、5%CO2培养箱中培养24h后,取上清液,ELISA法测定细胞上清液中NO、ROS、TNF-α的含量。每给药组设 3 个副孔。
1.5 统计学方法
本实验结果数据采用SPSS16.0统计软件,数据资料以(x±s)表示,统计方法用单因素方差分析与组间LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1 RAW264.7 各组给药药液浓度筛选
随着四君子汤( 红参) 药液浓度的增加,细胞的活力逐渐减弱,表明药液浓度过高会对巨噬细胞产生毒性作用; 选择细胞活力最接近不干预组的4 个浓度,确定给药浓度为100~800mg/L,见表1。
2.2 各给药组对小鼠腹腔巨噬细胞吞噬中性红吸光度和增长率的影响
测量结果与计算结果分别见表2 ~ 3。从测量得到的结果可以看出,四君子汤与生脉饮能够显著的增加巨噬细胞吞噬中性红的吸光度(P<0.05),从表中可以看出,随着浓度的增加,吸光度逐渐增加,当浓度达到400mg/L时,吸光度达到最大,再增加给药浓度,吸光度出现下降的趋势;同剂量与生四君组比较,在100mg/L时红四君有显著差异为(0.80±0.05),在200mg/L时生生脉有显著差异,吸光度为(0.75±0.10);在800mg/L时生生脉有显著差异,吸光度为(0.60±0.08),其余同剂量组间没有显著差异。
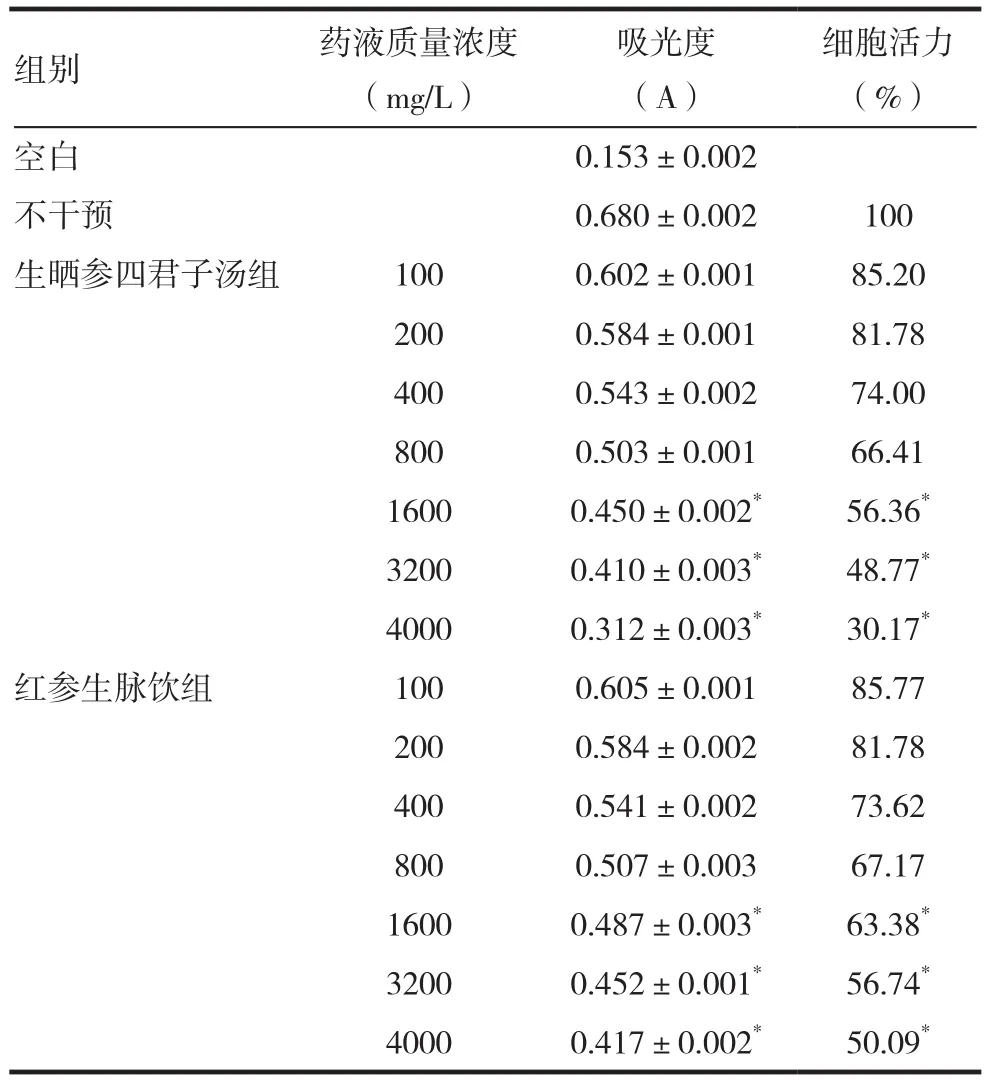
表 1 不同浓度生晒参四君子汤对心肌细胞活力影响(x ± s,n=5)
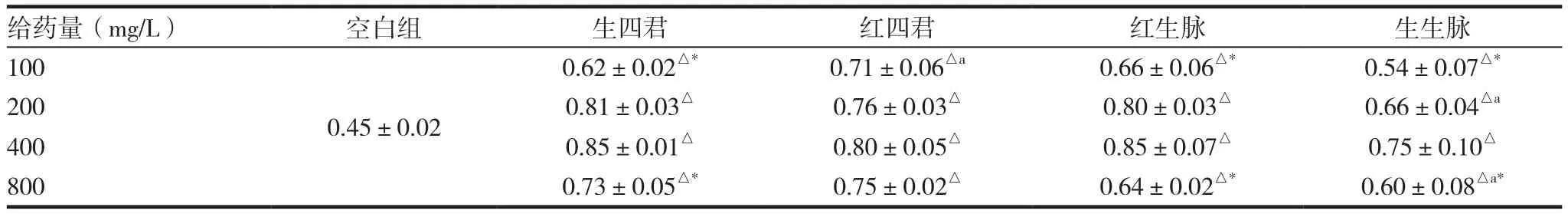
表2 各给药组对巨噬细胞吞噬中性红吸光度的影响(x ± s,n=3)
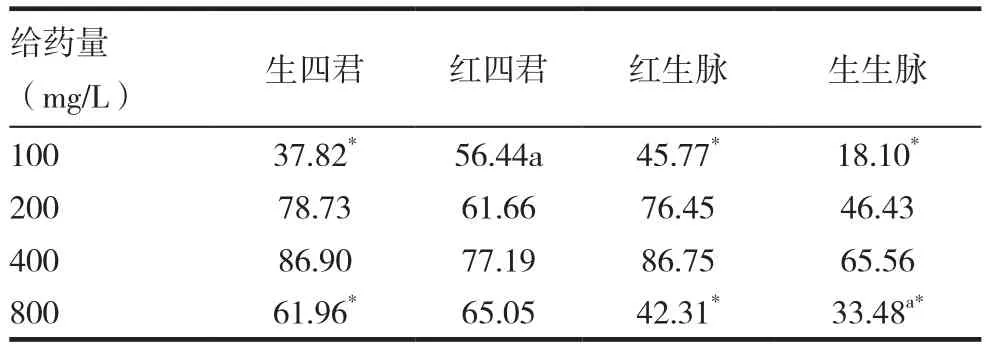
表3 各给药组对巨噬细胞吞噬中性红增长率的影响(n=3,%)
2.3 各给药组对小鼠腹腔巨噬细胞NO的影响
计算结果分别见表4。从测量得到的结果可以看出,四君子汤与生脉饮能够显著的增加巨噬细胞上清液中NO的含量(P<0.05);从表中可以看出,随着浓度的增加,NO的释放量逐渐增加,当浓度达到400mg/L时,释放量达到最大,再增加给药浓度,释放量出现下降的趋势,400mg/L时,NO释放量存在显著差异(P<0.05);同剂量时与生四君组比较,生四君组400mg/L对巨噬细胞NO的影响为(24.31±1.93)μmol/L均高于其同剂量其他三组。

表4 各给药组对小鼠腹腔巨噬细胞NO的影响(μmol/L,x ± s,n=3)

表5 各给药组对小鼠腹腔巨噬细胞ROS的影响(IU/mL,x ± s,n=3)

表6 各给药组对小鼠腹腔巨噬细胞TNF-α的影响(ng/L,x ± s,n=3)
2.4 各给药组对小鼠腹腔巨噬细胞ROS的影响
计算结果分别见表5。从测量得到的结果可以看出,四君子汤与生脉饮能够显著的增加巨噬细胞上清液中ROS的含量(P<0.05);随着浓度的增加,ROS 的释放量逐渐增加,当浓度达到400mg/L时,释放量达到最大,再增加给药浓度,释放量出现下降的趋势,但是在400mg/L时,ROS释放量不存在显著差异(P>0.05);同剂量下,在800mg/L时,生生脉组与生四君对巨噬细胞ROS的影响分别为(533.16±73.88)IU/mL、(629.77±64.66)IU/mL 组存在显著差异,效果上生四君组优于红四君组,红生脉组优于生生脉组,但各组之间没有显著差异。
2.5 各给药组对小鼠腹腔巨噬细胞TNF-α的影响
计算结果分别见表6。从测量得到的结果可以看出,四君子汤与生脉饮能够显著的增加巨噬细胞上清液中TNF-α的含量(P<0.05);随着浓度的增加,TNF-α的释放量逐渐增加,当浓度达到400mg/L时,释放量达到最大,再增加给药浓度,释放量出现下降的趋势,与400mg/L组比较,100和800mg/L有显著性差异(P<0.05);同剂量组与生四君组比较,生生脉组对TNF-α的影响分别为(18.28±1.53)ng/L、(16.47±1.44)ng/L(P < 0.05)呈显著性差异,效果上生四君组优于红四君组,红生脉组优于生生脉组。
3 讨论
3.1 对小鼠腹腔巨噬细胞吞噬中性红吸光度和增长率的影响[12]
本实验结果表明,各给药组小鼠腹腔巨噬细胞吞噬中性红的能力高于空白组, 说明生晒参四君子汤、红参四君子汤、红参生脉饮和生晒参生脉饮均有显著增强巨噬细胞的活性,提高巨噬细胞的吞噬能力;同时比较各组数值,在400mg/L时增强效果最为明显,细胞活性最强,说明400mg/L为其最佳浓度,促进巨噬细胞的作用最强;比较同方剂生熟之间的差异,四君子汤组中生晒参组方数值上优于红参组方;同时生脉饮组中,红参组方在数值上优于生晒参组方,但是生、红组方间不存在显著差异。
3.2 各给药组对小鼠腹腔巨噬细胞NO的影响[13]
巨噬细胞可释放NO因子,而NO的一个最突出的作用是增强巨噬细胞对抗病毒、细菌、真菌、肿瘤细胞等作用。本实验结果表明,四君子汤与生脉饮能够促进巨噬细胞释放NO,随着给药浓度的增加,NO的释放量逐渐增加,当浓度达到400mg/L时,释放量达到最大,同剂量时与生四君组比较,400mg/L时,红四君组、生生脉组和红生脉组均低于生四君组。
3.3 对小鼠腹腔巨噬细胞ROS的影响[14]
需氧细胞在代谢过程中产生一系列活性氧簇(reactive oxygen species,ROS)可双向调控某些肿瘤细胞的凋亡和增殖,并发现了自由基与细胞信号转导之间的内在关联,同时ROS在启动和维持的再生反应中必不可少。本实验结果表明,四君子汤与生脉饮能够显著的增加巨噬细胞上清液中ROS的含量;当浓度为400mg/L时,ROS 的释放量达到最大,说明400mg/L为其最佳给药浓度;同剂量下,在100和800mg/L时,生生脉组与生四君组存在显著差异,数值上生四君组高于红四君组,红生脉组高于生生脉组,但各组之间没有显著差异。
3.4 各给药组对小鼠腹腔巨噬细胞TNF-α的影响[15]
肿瘤坏死因子(TNF-α)是由单核巨噬细胞产生的,对免疫系统有强有力的作用,促进机体免疫炎症反应。本实验结果表明,四君子汤与生脉饮能够显著的增加巨噬细胞上清液中TNF-α的含量;400mg/L为释放TNF-α最佳给药浓度,说明在400mg/L时,细胞活性达到最大,比较各组间数据,数值上生四君组高于红四君组,红生脉组高于生生脉组。
综合以上,从实验结果可以看出,各方剂组在400mg/L时促进巨噬细胞的作用最强,同剂量组间生四君、红生脉效果优于替换后的方剂组,说明经典方剂在使用中的优越性与特定性,在使用的过程中应避免将生晒参与红参互换代替的行为,才能最好的发挥人参在方剂中的作用。

