鸭IFN-β启动子双荧光素酶报告基因系统的构建及活性检测
高全新,刘云霞,程玉强,严亚贤,孙建和∗
(1上海市宝山区动物疫病预防控制中心,上海201900;2上海交通大学农业与生物学院,上海市兽医生物技术重点实验室,上海200240)
鸭是主要的家禽养殖物种,近年来高致病性禽流感的流行,给养殖户带来了巨大的经济损失,同时也对公共安全产生了严重威胁。干扰素(Interferon,IFN)具有抗病毒、抗肿瘤活性,且有强大的免疫调节作用[1],对于禽类的天然免疫及触发获得性免疫十分重要[2]。根据IFN氨基酸序列及其特异性识别受体的不同,可将IFN分为Ⅰ型、Ⅱ型和Ⅲ型,其中β干扰素(IFN-β)属于Ⅰ型IFN。IFN-β是由微生物、dsRNA和病毒等干扰素诱生剂刺激细胞后所产生的高活性多功能蛋白,抗病毒活性较强,具有广谱的抑制病毒、抗肿瘤、调节免疫力和激素刺激等生物学活性,在细胞因子基础和临床研究中具有重要价值[3]。
由于IFN-β具有很强的疏水性,目前一直没有可靠稳定的色谱方法对其进行准确定量分析。目前IFN活性检测方法主要有:抗病毒活性检测方法,常利用水泡性口炎病毒(VSV)进行检测,但该方法敏感性和准确率较低,且具有一定的生物安全危险性[4];ELISA检测方法[5],检测方便快捷,但局限于检测IFN的抗原性,且不同IFN需要不同的单抗,通用性低;荧光定量RCR检测方法[6],该方法在提取宿主细胞mRNA的基础上进行,但由于RNA极不稳定,对检测结果的准确性有一定影响。因此,建立一种适用范围广、精确率高的检测方法对IFN的研究具有重要意义。
启动子是真核基因转录起始位点上游一段长度不等的特异性序列,该片段有多种调节因子的结合位点,能顺式调控基因的转录,因此可以通过检测启动子的激活程度间接定量蛋白(如Ⅰ型干扰素)的表达量。荧光素双报告基因系统具有检测快速、灵敏度高、线性范围广,且在大多数哺乳动物细胞无内源性表达等诸多优点[7]。本试验拟将鸭IFN-β的启动子片段插入带有荧光素酶基因的报告质粒上,若启动子被激活,则其下游的荧光素酶表达,通过对荧光素酶的检测可间接测定IFN-β的表达水平。
1 材料与方法
1.1 材料
实验鸭胚购自上海凌华绿头鸭养殖合作社;dsDNA质粒pCAGGS、pGU-GFR、RIG-I真核表达质粒pCAGGS-RIG-I由上海交通大学上海兽医生物技术重点实验室构建及保存;Trans5α感受态细胞购自北京全式金生物技术有限公司;萤火虫荧光素酶报告基因载体(pGL3.0)、海肾荧光素酶报告基因载体(pRLTK)、双荧光素酶报告基因检测试剂盒均购自Rromega公司;去内毒素质粒提取试剂盒、组织DNA提取试剂盒购自OMEGA公司;一步连接酶、限制性内切酶Nhe I、BglⅡ购自大连宝生物工程(TaKaRa)公司;脂质体转染试剂盒购自上海翊圣生物科技有限公司;poly(I:C)购自Invivogen公司;高糖DMEM培养基、胎牛血清(FBS)、0.25%胰酶均为GIBCO公司产品;引物合成及测序由北京六合华大基因科技有限公司上海分公司完成。
1.2 鸭IFN-β基因启动子及5个逐段缺失片段的PCR扩增
按照组织DNA提取试剂盒说明书从鸭气管组织中提取鸭基因组DNA,于-20℃保存。根据GenBank上已公布的鸭IFN-β基因启动子序列(登录号:KM032183.1)设计6对分别用于扩增IFN-β启动子区域-1530位、-1194位、-792位、-390位、-180位、-90位至第一外显子+63位6个片段的引物(表1)。以提取的基因组DNA为模板,进行RCR扩增。RCR反应体系为:RrimeSTAR GXL 1.5 μL、5×buffer 10 μL、dNTR 4 μL、DNA 模板 1 μL、上下游引物各 2 μL、ddH2O 29.5 μL,总体积50 μL;反应程序:98℃变性10 s、58℃退火15 s、68℃延伸1 min,30个循环;68℃终延伸5 min。产物经1%琼脂糖检测后切胶回收,于-20℃保存待用。

表1 PCR扩增所用引物Table 1 Primers for PCR amplification
1.3 鸭胚成纤维细胞的制备
参照沈学怀等[8]方法取11日龄鸭胚处理,取出鸭胚用RBS洗净,去除残留血液及胚液,去掉头颈四肢,剪碎后以胰酶消化,将消化物用5倍体积的高糖DMEM培养基轻轻浸洗2—3次,至悬液清亮,经四层纱布过滤后3000 r∕min离心3 min,去上清后保留底部细胞,以7%胎牛血清(FBS)-高糖DMEM培养基重悬,转移至细胞瓶,置于37℃恒温培养箱培养4—6 h,然后于显微镜下观察其贴壁情况,贴壁细胞即为鸭胚成纤维细胞(DEF)。
1.4 鸭胚成纤维细胞转染条件摸索
按照脂质体核酸转染试剂说明书转染细胞。转染前将生长状态良好的DEF细胞以每孔2×105个细胞密度接种于24孔板,待细胞单层长至汇合度约为90%时进行质粒转染。转染前,培养基换为10%FBS的 DMEM,每孔 400 μL,用 DMEM 分别将 0.5 μL、1 μL、2 μL 和 4 μL 的脂质体与 0.5 μg 绿色荧光质粒pGU-GFR预混至100 μL,常温孵育20 min后均匀滴入每孔。转染6 h后换为10%FBS的DMEM(无双抗),转染20 h后于显微镜下观察拍照。
1.5 荧光素酶报告载体的构建及鉴定
将1.2中回收的片段与pGL3.0分别用Nhe I、BglⅡ进行双酶切处理,按照一步连接酶说明书进行连接,构建6个包含鸭IFN-β启动子不同长度片段的重组质粒pGL-IFN-β-1593、pGL-IFN-β-1257、pGL-IFN-β-855、pGL-IFN-β-453、pGL-IFN-β-243、pGL-IFN-β-153,转化 Trans5α 感受态细胞,测序正确后按照去内毒素质粒提取试剂盒说明书提取质粒。
1.6 报告基因载体瞬时转染细胞
为检测DEF细胞在pCAGGS-RIG-I、双链短RNA类似物poly(I:C)或pCAGGS刺激下IFN-β的激活情况,按照1.4中的方法,将各重组报告质粒、转染试剂及刺激物(表2)用DMEM稀释至100 μL,常温孵育20 min后均匀滴入每孔。每组设置3个重复,置于37℃、5%CO2培养箱中进行培养。6 h后换为10%FBS的完全培养基,并将poly(I:C)刺激组用双荧光素酶报告基因检测试剂盒收集细胞,测荧光值。其余组在20 h后测荧光值。

表2 各组转染试剂Table 2 Transfection reagents of each group
2 结果与分析
2.1 鸭IFN-β基因启动子的克隆
以鸭气管组织提取的鸭基因组DNA为模板,用设计的6对引物进行RCR扩增,扩增产物经1%琼脂糖凝胶电泳后表明,获得的6个片段大小与预期一致,分别为1593 bp、1257 bp、855 bp、453 bp、243 bp和153 bp(图1)。产物回收后与pGL3.0质粒连接,经转化、测序正确后提取质粒。
2.2 鸭胚成纤维细胞的制备
将制备的鸭胚成纤维细胞于培养瓶中培养,培养12 h后观察到细胞贴壁。如图2所示,细胞呈细长状,生长良好,可用于后续试验。
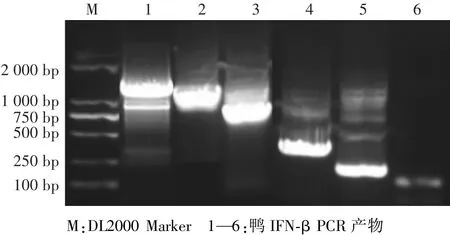
图1 鸭IFN-β启动子及各亚克隆琼脂糖凝胶电泳分析Fig.1 Analysis of duck IFN-β promoter and sub-clones by agarose gel electrophoresis
图2 鸭胚成纤维细胞显微镜观察(10×10)Fig.2 Microscopic observation of duck embryo fibroblasts(10 ×10)
2.3 鸭胚成纤维细胞转染条件摸索
如图3所示,在10×10倍放大倍数的两列图中,左侧为蓝色光激发的绿色荧光视野,绿色发光斑块代表荧光蛋白在细胞内表达,右侧是同一视野下普通显微镜拍摄图片;10×20倍放大倍数更清晰地展示了细胞形态。观察普通显微镜下拍摄的图片可发现细胞随着转染试剂浓度增高而凋亡增多,在绿色荧光视野下发现转染试剂为1 μL∕孔时,荧光强度最强,且细胞状态较好。因此,确定后续试验的转染体系为1 μL∕孔。
2.4 荧光素酶报告载体转录活性检测
分别以pCAGGS-RIG-I、poly(I:C)或pCAGGS为刺激物与重组报告质粒共转染DEF细胞,检测在不同刺激下IFN-β的激活情况。结果显示:在3种不同刺激物作用下,pGL-IFN-β-1593报告质粒荧光素酶的表达量均与空质粒转染组差异极显著。其中,在pCAGGS-RIG-I的刺激下,pGL-IFN-β-1593报告质粒荧光素酶的表达量是空质粒转染组的280倍,在双链RNA类似物poly(I:C)刺激下的表达量是空质粒转染组的380倍,在pCAGGS刺激下的表达量是空质粒转染组的14倍。

图3 不同转染试剂浓度下DEF细胞的绿色荧光素转染效果Fig.3 Transfection effect of green fluorescein in DEF cells with different transfection reagent concentration
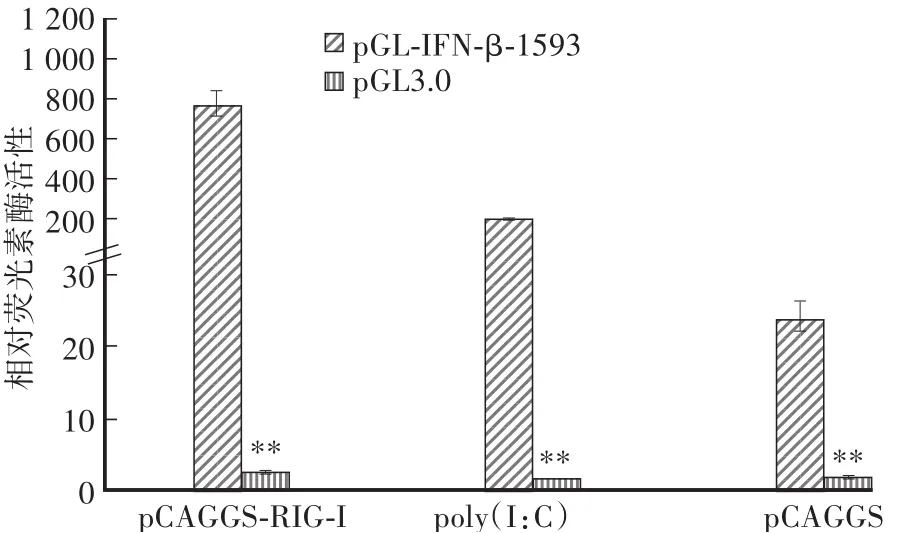
图4 不同刺激物对双荧光素酶报告基因的激活情况Fig.4 Activation of dual luciferase reporter gene with different stimulators
2.5 鸭IFN-β核心启动子区域确定
为探索鸭IFN-β的核心启动子区域,将不同截短片段连接入pGL3.0构建荧光报告质粒。将重组质粒转染DEF细胞,使用 poly(I:C)或 pCAGGS进行刺激。 结果表明:pGL-IFN-β-1593、pGL-IFN-β-1257、pGL-IFN-β-855、pGL-IFN-β-453、pGL-IFN-β-243 均能被poly(I:C)或pCAGGS 有效激活,pGL-IFN-β-453 表现出最高的荧光素酶活性。截短至启动子区仅含90 bp(pGL-IFN-β-153)时,报告基因完全不能被激活。综合激活强度及插入片段长度等因素,后续研究将选择激活强度高、插入片段短的pGL-IFN-β-453重组质粒用于鸭IFN-β启动子活性的检测。

图5 不同截短片段构建的双荧光素报告基因活性Fig.5 The activity of dual luciferase reporter gene constructed by different truncated fragments
2.6 鸭IFN-β报告基因用于RLR信号通路激活检验
为验证构建的鸭IFN-β报告质粒是否可用于检测先天性免疫信号通路中的激活情况,将不同截短片段连接入pGL3.0构建荧光报告质粒。将重组质粒转染DEF细胞,以RLR家族的RIG-I过表达质粒进行刺激,结果表明:在 pCAGGS-RIG-I过表达的 DEF 细胞中,pGL-IFN-β-1593、pGL-IFN-β-1257、pGL-IFN-β-855、pGL-IFN-β-453、pGL-IFN-β-243 均能被激活,而空载体和 pGL-IFN-β-153 均不能被 pCAGGS-RIG-I激活。
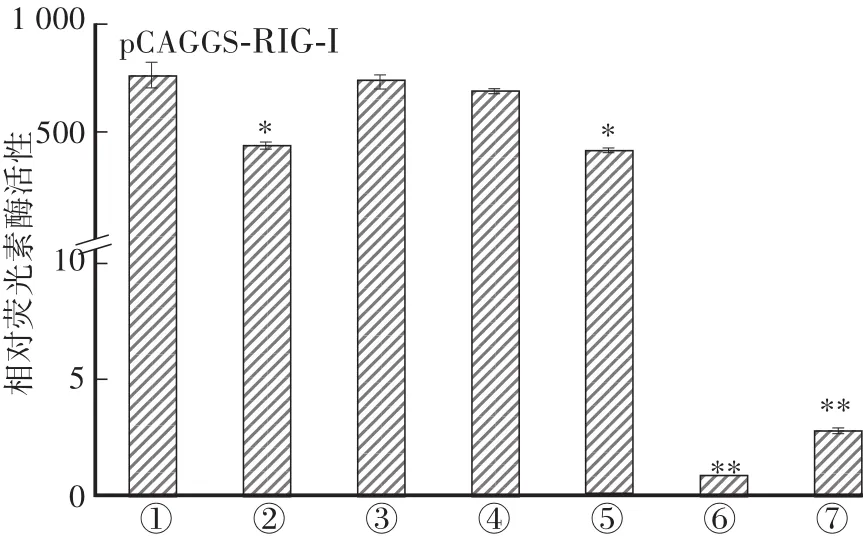
图6 不同截短片段在RLR信号通路中激活IFN-β的活性Fig.6 Activation of IFN-β by different truncated fragments in RLR signaling pathway
3 讨论
IFN-β作为机体重要的细胞因子,在先天免疫中发挥着至关重要的作用。许多研究发现,鸡源病毒如AIV、NDV等均能抑制IFN-β的产生。Megan等[9]研究发现,在鸡中不存在RIG-I基因,而在鸭中存在RIG-I基因,并且发现鸭RIG-I介导的抗病毒天然反应在抵抗流感病毒复制和清除流感病毒中起着重要的作用。干扰素调节因子(Interferon regulatory factors,IRFs)是一类在IFN信号通路中起重要调控作用的多功能转录因子,在IFN的诱导、病毒防御、免疫调节、细胞分化、细胞生长与凋亡和许多疾病的调节中具有重要作用。在哺乳动物中已证实具有诱导I型IFN作用的IRF3和参与信号转导、激活以及IFN级联反应中正反馈调节的IRF9在鸡中缺失[10-11],对于鸭是否也缺失这两个成员目前还未有报到。以上两个机制在某些程度上解释了鸭相对于鸡对高致病性禽流感等有着更强的抵抗力这一问题,因此研究鸭IFN-β免疫通路对于探讨流感等病毒与鸭的相互作用具有重要意义,同时也可为运用转基因方法改善鸡对病毒较低的抵抗力奠定理论基础。鸭IFN-β快速准确的活性定量检测是进行上述研究的前提。
报告基因检测系统具有灵敏度高、操作周期短等特点,目前在探讨启动子作用、细胞信号转导、药物诱导作用、病毒与细胞相互作用等研究中均涉及到报告基因的应用。维甲酸诱导基因I(RIG-I)是RIG-I样受体家族成员之一,能够识别细胞质中的病毒RNA并激活下游的线粒体抗病毒信号蛋白(MAVS),MAVS与干扰素基因刺激因子(STING)互作,激活NF-κB通路和 IRF3∕7通路,致使促炎症细胞因子和I型干扰素(IFN-I)表达[12-14]。poly(I:C)是双链短RNA类似物,常被认为是IFN-β的诱生剂,可模拟双链短RNA病毒感染细胞时模式识别受体(Rattern recognition receptors,RRR)的识别[15-16],进而诱导宿主细胞产生IFN-I等细胞因子;鸭乙型肝炎病毒(DHBV)等DNA病毒常引起家禽感染患病,病毒DNA注入宿主细胞后,胞内Toll样受体(Toll-like receptors,TLR)如TLR2、TLR3能特异性识别外源DNA,进而激活下游的I型干扰素信号通路[17]。pCAGGS为普通表达质粒,在本研究中作为dsDNA刺激物用于检测报告质粒在外源DNA刺激下的活性。因此,将poly(I:C)、pCAGGS-RIG-I或pCAGGS与构建的重组报告质粒共转染DEF,能激活IFN-β启动子,使得下游的荧光素酶得以表达,同时IFN-β启动子的激活程度与荧光素酶的表达量正相关,表明了IFN-β定量检测的可行性。
将包含鸭IFN-β启动子1530 bp、第一外显子63 bp的片段链接至荧光素酶报告质粒,与不同刺激物共转染DEF,荧光素酶的表达量均较高,且在不同的刺激物下表达量不同,表明可以利用此双报告基因系统定量检测不同条件下IFN-β的表达水平。将不同截短长度的鸭IFN-β启动子片段连接至报告质粒,通过检测荧光素酶的表达量可推测启动子的关键功能域。本研究中,将启动子截短至-180到+63位仍有大量荧光素酶的表达,说明该区域包含关键的转录因子结合区域,这与GenBank上已公布的鸭IFN-β基因启动子序列(登录号:KM032183.1)注释结果相同,其中-102位至-84位为干扰素调节因子1(IRF1)的结合位点,-81位至-71位为NF-κB的结合位点。截短片段-390到+63位与全长构建的重组报告质粒具有相同检测活性,因此在后续研究中可运用该片段构建的报告质粒检测IFN-β的表达水平,不仅可以达到较高的准确率,同时还可降低整个检测质粒的碱基数,除去冗余碱基的影响。
综上所述,本研究克隆了鸭IFN-β启动子,成功构建了具有转录活性的IFN-β荧光素酶报告载体系统,为鸭IFN-β免疫通路的研究奠定了基础。

