多杀菌素微乳注射剂在新西兰兔体内的药代动力学研究
钟恬田, 黎博宇, 赵建国, 杨雨辉, 兰坚强, 龚帮俊, 韩 谦
(海南大学热带农林学院, 海南 海口 570228)
多杀菌素(Spinosad)是20世纪90年代初期开发的一类大环内酯类抗生素,是由土壤中的放线菌刺糖多孢菌(SaccharopoLysporaspinosa)经有氧发酵后产生的胞内次级代谢产物[1]。相比其他杀虫药物,多杀菌素有着独特的作用机制,主要是通过作用于烟碱型乙酰胆碱受体(nAChR),极大地延长乙酰胆碱(Ach)的作用时间[2-3]。多杀菌素具有高效低毒、高选择性等优点,介于以上这些优点,该药于1999年赢得“美国总统绿色化学挑战奖”[4]。近年来,越来越多的人饲养宠物,研究发现多杀菌素对猫、狗、羊、牛等家畜的蚤类、蜱、虱子等体外寄生虫有较好的防制作用,多杀菌素的用途越来越广泛[5]。但该药难溶于水,口服吸收差,有较大的首过效应,且体内的半衰期短,这些性质严重削弱了多杀菌素口服制剂药效的发挥。多杀菌素微乳液具有热力学稳定性,可进行热压灭菌,其黏度较低,注射时刺激性小,且可以解决其难溶性的问题,药物从乳剂的油相中缓慢释放,可以适当延长持效期、减少用药量且降低给药次数,大大地提高生物利用度和药效[6]。
本试验分别采用了酶联免疫吸附测定方法(ELISA)和高效液相色谱法(HPLC)两种检测方法探索家兔皮下注射多杀菌素微乳注射剂后兔血液中药物的药代动力学规律,为临床应用该新剂型治疗相关疾病提供部分参考理论依据。
1 仪器与材料
1.1 仪器 高效液相色谱仪(日本岛津公司LC-20AD);氮气吹扫仪(北京优晟联合科技有限公司UGC-45);超声波清洗机(深圳市超艺达科技有限公司PS-40);高速离心机(Eppendorf AG 22331);磁力搅拌器(海门市其林贝尔仪器制造有限公司GL-3250A);电子天平(梅特勒-托利多仪器有限公司ME204E);超低温冰箱(海尔BD-226W);微型漩涡仪(上海泸西分析仪器厂有限公司XW-80A);酶标仪(美国伯腾仪器有限公司Elx808);洗板机(北京拓普分析仪器有限公司DEM-3)。
1.2 药品及试剂 多杀菌素标准品(纯度98.5%,由中国农业大学生物学院宋渊教授提供);油酸乙酯(山东西亚化学股份有限公司);吐温80(麦克林);丙二醇(广州化学试剂);甲醇(美国Tedia公司);乙腈(美国Tedia公司);乙酸乙酯(广州省化学试剂工程技术公司);异戊醇(广州化学试剂);肝素钠(生工生物工程有限公司);酒精;超纯水;0.22 μm微孔滤膜。
1.3 动物 健康新西兰兔6只,体重1.8-3.7 kg,雌雄各半,购自某新西兰兔养殖场,饲养于海南大学动物房饲养室。试验前自饲养2周,且未服用任何可能影响本品代谢吸收的药物,血液生化指标检查均正常。采样期间正常饲养,不限制饮水。
2 试验方法
2.1 多杀菌素的微乳制备 多杀菌素自乳化的处方含1%多杀菌素原药,由海南大学热带动物医学与病媒介生物学实验室研制。该剂型为澄清透明的液体,微带淡蓝色乳光,流动相较好,该处方所选用的辅料均无毒性。该制剂显著提高了多杀菌素在水中的的溶解度,将其制成自乳化制剂后,一方面不仅可以提高药物溶解度,而且制剂在体内可自发形成0/W型微乳液,促进药物吸收,且大大拓宽了该药的给药途径。
2.2 给药方法和血样采集 兔子分别编号为1~6号,所有兔子均按照0.25 mg/kg·bw剂量,皮下注射给药,并在给药前0.5 h由耳缘静脉采集空白血样5 mL,在给药后的0.5,1.0,2.0,4.0,8.0,12.0,24.0,48.0,96.0,144,192,240,336 h采集血样1 mL。1、3、5号兔血采集后迅速置于含肝素抗凝的离心管中,3 500 r/min离心10 min,吸取上层血浆转入另一离心管中,置于-20 ℃冰箱内保存;2、4、6号兔血采集后置于空离心管中,37 ℃下放置2 h,将析出的血清转移到另一离心管中,置于-20 ℃冰箱内保存。整个试验期间,严密观察兔子的精神状态和临床反应,包括食欲,饮水状况,大小便和可能出现的胃肠道等方面的不良反应。
2.3 酶联免疫吸附测定方法测定血清中药物浓度 向96孔板中加入200 μL由包被缓冲液稀释的多杀菌素包被原(多杀菌素-OVA),并于37 ℃ 孵育3 h。使用PBST溶液洗板3次后,每孔加入200 μL脱脂牛奶封闭0.5 h。洗板后每孔加入100 μL标准品或待测样品,随后加入100 μL mAb,于37 ℃ 竞争1 h。竞争结束后弃反应液,洗板3次,每孔加入200 μL的PBSTG稀释的羊抗鼠二抗(IgG-HRP)溶液,于37 ℃孵育0.5 h。洗板后每孔加入200 μL TMB底物显色液,室温孵育15~20 min,加入100 μL终止液(2 mol/L H2SO4),用酶标仪在450 nm处读取吸光度。
2.4 高效液相色谱法测定血浆中药物浓度
2.4.1 色谱条件 色谱柱:Waters C18(4.6 mm ×250 mm,5 μm);流动相:甲醇-乙腈-水(49∶49∶2),使用前经超声混匀备用;体积流量:1.0 mL/min;检测波长:246 nm;柱温:40 ℃;进样量:10 μL
2.4.2 标准曲线的配制 精密称取多杀菌素0.01 g 标准品,用甲醇配成0.1 mg/mL的标准溶液,使用甲醇逐级稀释为400,200,100,50,25,12.5 ng/mL的梯度浓度溶液,经HPLC检测,用峰面积A对浓度c(ng/mL)作线性回归,结果表明,多杀菌素在12.5~400 ng/mL内线性关系良好(R=0.9999)。
2.4.3 血浆样品前处理方法筛选 吸取适量的兔空白血浆,加入一定量的标准液,配制为终浓度为0.025 mg/mL的血浆样品1 mL,分别经加入样品量4倍、3倍、3倍的甲醇、乙腈、乙酸乙酯,漩涡10 min后,10 000 r/min离心10 min,吸取上清液于另一试管中,于40℃下氮气吹干,残渣复溶于1 mL乙腈中,过滤膜后经紫外检测器检测浓度,经3次重复试验后,测出峰面积并计算其萃取回收率。萃取回收率=(血浆中药物的峰面积/对应浓度非血浆中的药物的峰面积)×100% 最终选择乙腈蛋白沉淀法作为前处理方法,平均萃取回收率可达86.77%,提取方法可靠。实际测量未知浓度血浆时,应尽可能通过氮气吹扫的方法,使样品浓缩,从而减小误差。
2.4.4 加标回收率试验 将1 mg/mL标准品储备液,用空白血浆稀释配置成0.025、0.2、0.8 mg/mL这3个浓度的待测样,经2.4项操作后计算回收率和日内、日间精密度,每种溶液3个重复。由标准曲线求得各样品的浓度,将求得浓度与已知加入浓度相比,回收率=(所算浓度/已知浓度)×100%。其回收率分别为94.5%,表明该方法回收率符合要求;其日内和日间的精密度的相对标准偏差RSD值分别为1.06%,1.57%。结果表明,本试验条件下所用方法的精密度符合要求,测定方法可靠。
2.5 数据分析处理 采用基于 ExceL 的药动学数据分析程序-PKsoLver 1.0的非房室模型来处理药动数据,分别计算出每只新西兰兔的药动学参数,然后计算平均值及标准误,并对两种分析方法下的数据进行t检验分析,同时以血药浓度平均值对时间作药-时曲线。
3 结果
血药浓度曲线和药物动力学参数 6只家兔单次皮下注射多杀菌素微乳剂后分别经高效液相色谱方法和ELISA方法检测下不同时间下的血药浓度曲线见图1,将药-时数据输入药动学计算软件PKsolver,采用非房室模型对数据进行处理,确定药动力学参数[7]。其中Cmax 和Tmax为实测值,其结果见表1。
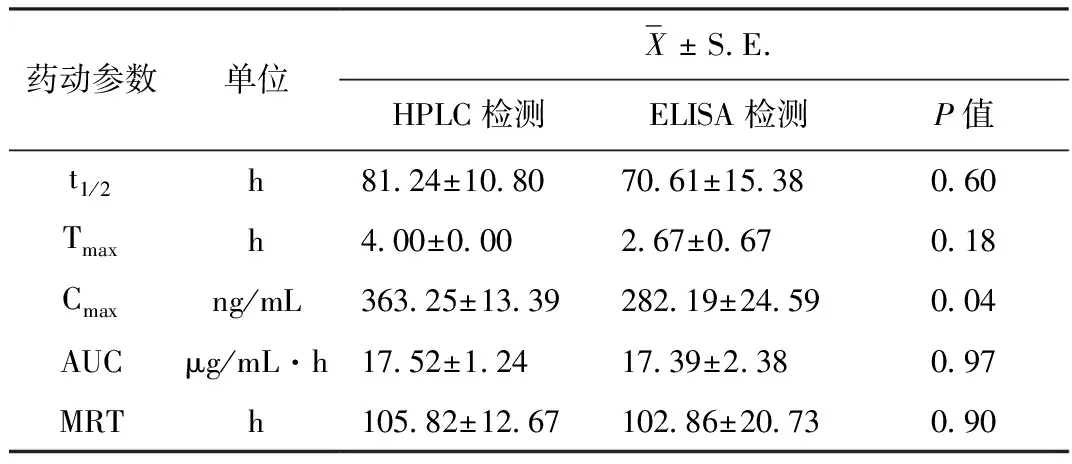
表1 新西兰兔皮下注射多杀菌素注射液(0.25 mg/kg·bw)后的药物动力学参数 (n=6)
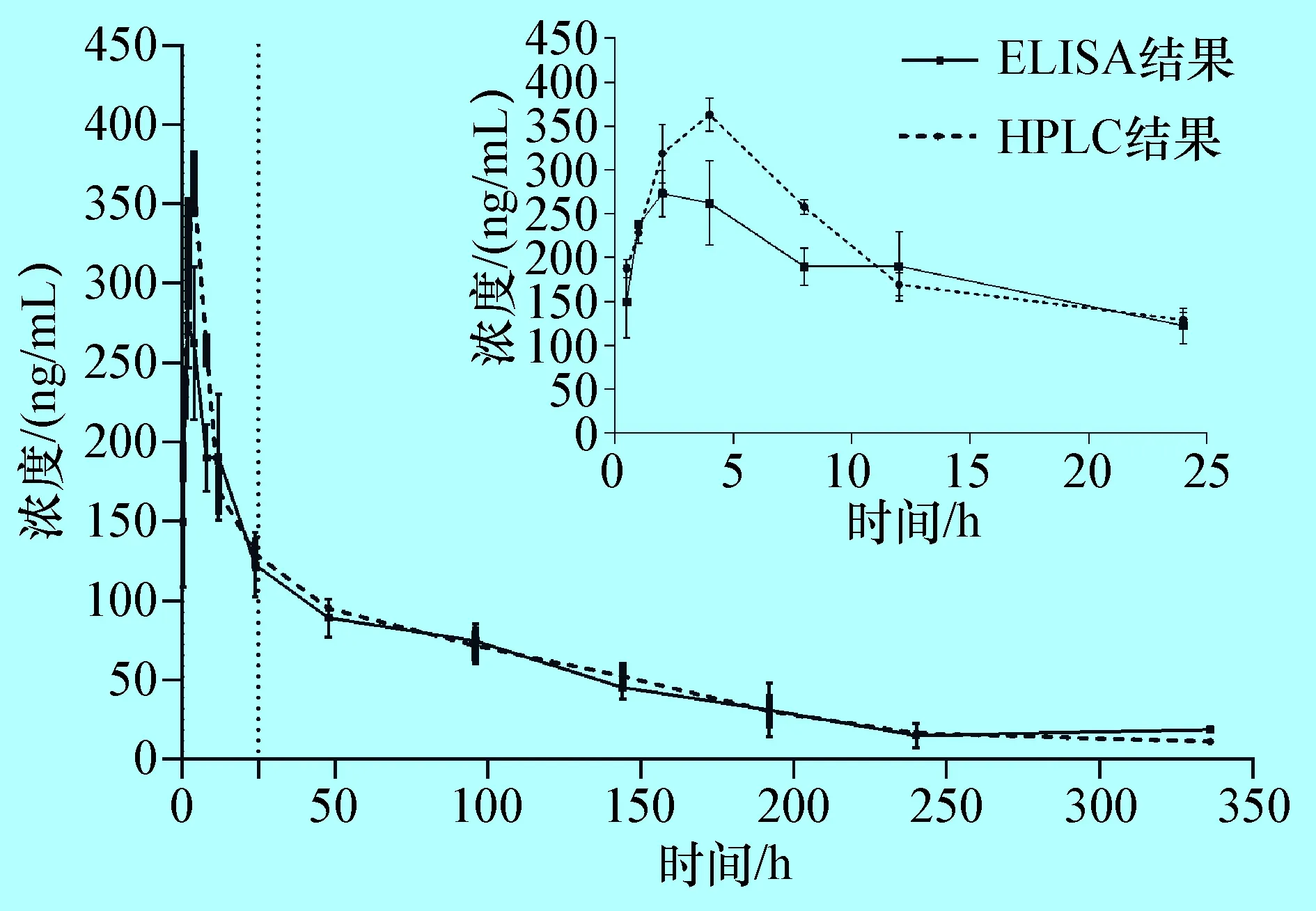
图1 分离菌16S rRNA序列PCR扩增产物的琼脂糖凝胶电泳结果
4 讨论
4.1 检测方法的建立 本试验中采用了两种方法检测家兔血液中多杀菌素的含量。经查阅国内外相关文献后,首先建立了检测血浆中多杀菌素的提取方法,通过对常用样品前处理方法:蛋白沉淀法,液液萃取法的比较筛选,最终选择乙腈作为蛋白沉淀剂对血浆进行处理。其次建立了多杀菌素含量的检测方法,所用的多杀菌素液相检测方法的标准曲线R大于0.99,日内与日间变异系数RSD值小于9%,血浆中的内源性物质不干扰多杀菌素的测定,实现了主峰与杂质峰的良好分离,满足药动学测定的要求。同时,通过制备多杀菌素单克隆抗体,从而通过间接竞争ELISA反应的方法检测血清中的多杀菌素含量,该检测方法的标准曲线R大于0.99,加标曲线回收率可达到稳定在90%以上,同样可满足药动学测定的要求。其中,ELISA分析方法操作方便、灵敏、检测限低、而液相方法准确、重现性好,但需要通过前处理方法将待测样品提纯后再进行检测。
4.2 药动学特征 液相色谱法及酶联免疫法检测药物浓度的半衰期、达峰时间,药时曲线下面积、平均滞留时间等主要药代动力参数均无显著差异,通过两种方法对血液样品的检测,可知多杀菌素在 2~4 h达到最大血药浓度,而后快速降低,而多杀菌素原药在口服给药后的2~8 h到达峰浓度,两者相比较,微乳注射剂起效更快,可作为动物急性疾病的治疗方案。在家兔体内的药代参数值与在狗体内的相比,动物体内代谢可见相似的趋势特征,但仍存在一定的种属差异,主要表现在药物半衰期在兔体内时间略短于在狗体内[8],这可能跟动物胃部pH值存在一定的联系,该制剂在新西兰兔体内分布广泛,持续时间较长。本试验中家兔按0.25 mg/kg·bw, 一次皮下注射后,30 min后血浆中多杀菌素即可达到187.13 ng/mL,60、90 min分别达到228.47、318.95 ng/mL,至48,96 h之后血浆中药物浓度维持在 94.98、71.28 ng/mL。在该制剂的药效预试验中可证明该给药剂量可对多种体内外寄生虫,比如虱子、螨虫、肠道线虫等起到有效的防制作用。
4.3 制剂特点 微乳作为一种新型的给药系统,大大增加了多杀菌素的溶解性,降低了在给药过程中对动物的刺激性和毒性。同时,微乳具有不良反应小,容易被机体代谢,可供注射使用的优点。多杀菌素微乳注射剂质地较稀,黏度不高,在注射剂过程中易于抽取和推注,具有较好的实用优势和应用前景。

