辅酶Q10对绒山羊精液冷冻保存效果的影响
霍 敏 ,栗瑞兰 ,林奕全 ,王瑞军 ,3,刘志红 ,3,李金泉 ,3,张家新 ,3
(1.内蒙古农业大学动物科学学院 动物遗传育种与繁殖自治区重点实验室,内蒙古 呼和浩特 010018;2.三亚雪古丽现代生态农业综合开发有限公司,海南 三亚 572000;3.内蒙古自治区山羊遗传育种工程技术研究中心,内蒙古 呼和浩特 010018)
精液冷冻保存作为人工授精的一个重要部分,不仅解决了精液长期保存的问题,而且对优良种畜遗传资源的保存、血统更新、引种以及降低生产成本等方面也有重要作用。精液冷冻保存技术的原理是利用干冰(-79℃)、液氮(-196℃)或其他冷源,将精子经过适当的处理,使精子细胞代谢在冷冻期间暂时处于休眠状态,在升温后可恢复其部分活性甚至全部活性,从而达到长期保存精液的目的[1]。在精液冷冻保存过程中,精子代谢产生的过量活性氧使精子易受到氧化应激的影响,导致精子质量下降,影响受胎率,进而限制了优良种畜的利用率[2]。所以,减少冷冻过程中精子受到的氧化损伤,提高精子质量显得极为重要。
哺乳动物的精子质膜中含有高浓度的多聚不饱和脂肪酸。这些多聚不饱和脂肪酸在活性氧簇(ROS)的作用下极不稳定,易发生精子膜脂质过氧化(LPO),导致膜结构破坏、细胞功能受损,以及精子运动性能降低甚至诱发精子凋亡,从而降低冷冻精子的受精能力[3]。有研究表明,在冷冻稀释液中添加抗氧化剂可以提高精液冷冻保存效果[4-6]。
近年来,许多研究表明,多种抗氧化剂可以减少精子在冷冻—解冻过程中所受到的氧化损伤,如:VC、谷胱甘肽 (glutathione,GSH)和辅酶Q10(coenzyme Q10)等[7]。辅酶 Q10作为线粒体电子传递链调节细胞质氧化还原的一个关键中间体,是一种比VE更强大的抗氧化剂,其可以中和自由基并使其以还原形式再生[8]。辅酶Q10的有益作用已在糖尿病、高胆固醇、高血压、神经退行性疾病和脂质过氧化等疾病中被证明[9-10]。 López-Lluch 等[11]证明精液中辅酶Q10的浓度与精子各项参数有关,如运动参数或质膜完整性等。到目前为止,辅酶Q10作为一种抗氧化剂在治疗男性不育中已得到很好的研究。相关结果显示,外源性补充辅酶Q10可以改善不育男性的精液质量[12-13]。但是,关于辅酶Q10对绒山羊精液冷冻保存效果的研究报道较少。因此,该研究在绒山羊精液冷冻稀释液中添加不同浓度的辅酶Q10,检测解冻后不同精液样本的精子各项指标,以期为绒山羊精液高效冷冻保存方法的研究提供理论基础,从而进一步提高绒山羊精液的冷冻保存效果。
1 材料与方法
1.1 试验材料
1.1.1 样品来源:精液采自内蒙古呼和浩特市某种羊场7只健康、繁殖性能良好的内蒙古绒山羊(3~4 岁)。
1.1.2 药品与试剂:三羟甲基氨基甲烷(Tris)、二水柠檬酸钠、葡萄糖、甘油、双抗、褪黑素,均购于Sigma公司。细胞凋亡试剂盒,购自碧迪快速诊断产品苏州有限公司;吖啶橙,购自上海羽朵生物技术有限公司;ROS检测试剂盒,碧云天生物技术有限公司产品;花生凝集素,上海哈林生物技术有限公司生产。
1.1.3 精液样本的采集及预处理:采用假阴道法采集绒山羊鲜精。将收集到的精液混匀后转移到实验室并保存在37℃水浴,然后进行精子品质检查,鲜精活力达到0.8以上方可用于冷冻保存。
1.2 试验方法
1.2.1 冷冻稀释液的配制:Tris基础液,配方为:Tris(300 mmol/L)、二水柠檬酸钠(95 mmol/L)、葡萄糖(56 mmol/L)。冷冻稀释液,配方为:在基础液中添加10%卵黄、5%甘油、1%双抗。在冷冻稀释液中分别添加 5、50、500 μg/mL 的辅酶 Q10, 设为试验组,其中辅酶Q10溶于浓度为0.08%的氯仿(CHCl3)。以不添加辅酶Q10的处理为空白对照组,以仅添加0.08%CHCl3的处理为阴性对照组。
1.2.2 精液的冷冻与解冻:将平衡后的精液加入4倍体积的等温稀释液中,使试验组中冷冻稀释液辅酶 Q10的终浓度分别为 4、40、400 μg/mL。 将稀释好的精液放入同温的水浴中,然后置于冰箱内,缓慢冷却降温到5℃后,转移到0.25 mL冷冻细管中,在距液氮4 cm高处熏蒸7 min,熏蒸结束后迅速将细管投入液氮冷冻保存。2周后取出冷冻细管,38℃水浴解冻30 s,然后用于各项参数的测定。
1.3 解冻后精子质量的评估
1.3.1 精子活率的测定:利用计算机辅助精液分析系统(computer assisted spermatozoa analysis system,CASAS)检测精子活率。
1.3.2 细胞中ROS含量和线粒体膜电位的检测:分别使用DCFH-Da荧光染料和JC-1荧光探针检测细胞内ROS含量和线粒体膜电位。将精液用PBS 洗涤并进行 2 次离心(1 000 r/min,3 min)。 然后用PBS悬浮沉淀精液,调整其终浓度为1×106个细胞/mL,加入40 μmol/L的染色液DCFH-DA,使其终浓度为1∶1 000,在37℃条件下用基础液孵育25 min,然后用PBS洗涤并离心2次(1 000 r/min,3 min),然后进行流式细胞仪检测。根据DCFH-Da荧光强度判断细胞内的ROS水平,其中,荧光强度=荧光值A (DCFH-Da)-荧光值B (细胞自发光),每次至少检测20 000个精子,要求流速小于100个细胞/s。绿色荧光(480~530 nm)采用FL1通道检测。
在上述相同浓度下检测线粒体膜电位,用PBS悬浮精液,1 mL精液加入4%的多聚甲醛,固定 30min。PBS 洗涤并离心 2 次(1000r/min,3min),并置于终浓度为10 μg/mL的JC-1工作液于培养箱孵育 30 min,随后离心 2 次(1 000 r/min,3 min)。最后,在5 mL的流式管中加入2 00 μL的PBS和50 μL的精液混合物,进行流式细胞仪分析。
1.3.3 精子结构检测:将精液用PBS洗涤并离心2次(1 000 r/min,3 min)。PBS 悬浮沉淀精液,调整其终浓度为1×106个细胞/mL。使用AnnexinVFITC和PI双染法检测精子质膜的完整性;在相同浓度下,使用PNA-FITC和PI双染法检测精子顶体形态;在相同精子密度下,用10 μmol/L吖啶橙染液避光染色15 min,检测精子DNA的完整性并进行流式细胞仪分析。每次至少检测20 000个精子,要求流速小于100个细胞/s。绿色荧光(480~530 nm)采用FL1通道检测,红色荧光(580~630 nm)采用FL2通道检测。
1.4 数据分析
所有试验测得数据均经Excel整理后,利用SAS 9.0软件进行单因素方差分析,P<0.05为差异显著,P>0.05为差异不显著。
2 结果与分析
2.1 辅酶Q10对精子活率的影响
由图1可知,随着辅酶Q10浓度的增加,精子活率也在逐渐增加。与空白对照组和阴性对照组相比,40 μg/mL 和 400 μg/mL 组的精子活率显著提高(P<0.05),但 2 组之间差异不显著(P>0.05)。
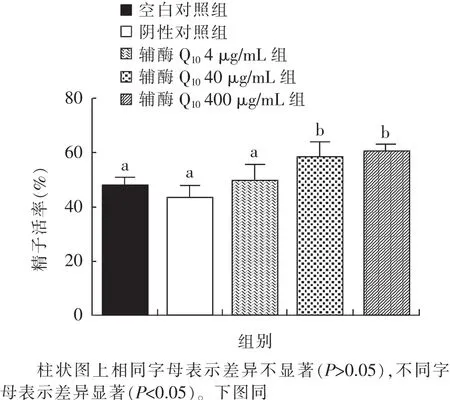
图1 不同浓度辅酶Q10对精子活率的影响
2.2 辅酶Q10对精子质膜完整率、顶体完整率和DNA完整率的影响
由图2(A~I)可知,随着辅酶Q10浓度的增加,精子各项指标均呈上升趋势。与空白对照组和阴性对照组相比,当辅酶Q10浓度为40 μg/mL和400 μg/mL时,解冻后精子质膜完整率和顶体完整率显著提高(P<0.05),其中,40 μg/mL 组的精子质膜完整率和顶体完整率略高于400 μg/mL组,但2组间差异不显著(P>0.05)。各试验组的DNA完整率与空白对照组相比差异不显著(P>0.05)。
2.3 辅酶Q10对精子线粒体膜电位和ROS含量的影响
采用JC-1荧光探针和DCFH-Da荧光染料分别检测线粒体膜电位和ROS含量。由图3可知,与空白对照组和阴性对照组相比,添加40 μg/mL和400 μg/mL辅酶Q10组的线粒体膜电位显著提高且 ROS 含量显著降低(P<0.05),其中,40 μg/mL组的线粒体膜电位略高于400 μg/mL组,但差异不显著(P>0.05)。
3 讨论
辅酶Q10是一种异戊二烯化苯醌,可将复合物Ⅰ和Ⅱ中的电子传输至线粒体呼吸链中的复合物Ⅲ,这对于复合物Ⅲ的稳定性至关重要[14]。研究表明,辅酶Q10是一种有效的抗氧化剂,应用于精液冷冻稀释液中能够减少冷冻过程由活性氧引起的氧化损伤[15]。此外,辅酶Q10作为一种脂溶性抗氧化剂,可以被用来作能量促进剂、膜稳定剂和线粒体通透性转换孔的调节剂[16]。
Safarinejad[13]研究表明,外源补充辅酶 Q10会影响精液的各项参数,推测其原因可能是由于辅酶Q10改变了氧自由基和抗氧化剂防御系统的平衡。为了确定这一推测,评估添加辅酶Q10后精子的抗氧化水平以及各项运动参数极为重要。Mancini等[17]分析了77例正常或病理精子精浆和精液中辅酶Q10的含量,注意到精子数量和精子活率与精液中辅酶Q10含量之间存在显著相关性:弱精子患者精浆中的辅酶Q10水平较低。另外,具有低运动性以及形态异常的精子,其细胞内均具有较低含量的辅酶Q10[18]。在该研究中发现,外源补充辅酶Q10提高了精子的活率。这些结果均支持上述的假设,即通过添加不同浓度的辅酶Q10可以改善精子质量,并恢复精子结构和功能的完整性。
线粒体对细胞凋亡具有重要的调节作用。它不仅是内源凋亡通路的感应器,而且还是凋亡信号的放大器。细胞凋亡有3个阶段,即启动、效应和执行[19]。在启动阶段,线粒体接受不同凋亡信号的刺激;在效应阶段,细胞对凋亡信号进行整合、处理并决定是否执行凋亡,一旦决定执行凋亡,细胞凋亡就会不可逆地发生并且线粒体会释放一些凋亡因子,如细胞色素c(Cyt c)等;在执行阶段,Cyt c激活细胞内的Caspase酶活性,后者能够直接引起细胞结构发生变化,如细胞内蛋白和DNA的降解[20]。该研究发现,试验组的线粒体膜电位呈上升趋势,说明添加辅酶Q10可以有效维持精子细胞内线粒体膜电位,初步显示辅酶Q10具有抗氧化作用,这与Duberley等[21]的研究结果一致。另外,有研究表明辅酶Q10能够清除氧自由基。在该试验中,添加不同浓度辅酶Q10的处理组,其精子细胞内ROS水平下降,说明辅酶Q10可以有效保护冻融精子的线粒体,抑制其体内ROS的产生,减弱或者避免精子细胞发生凋亡,这一结果与Yamamoto[22]报道的结果相似。

图2 不同浓度辅酶Q10对精子质膜完整率、顶体完整率和DNA完整率的影响
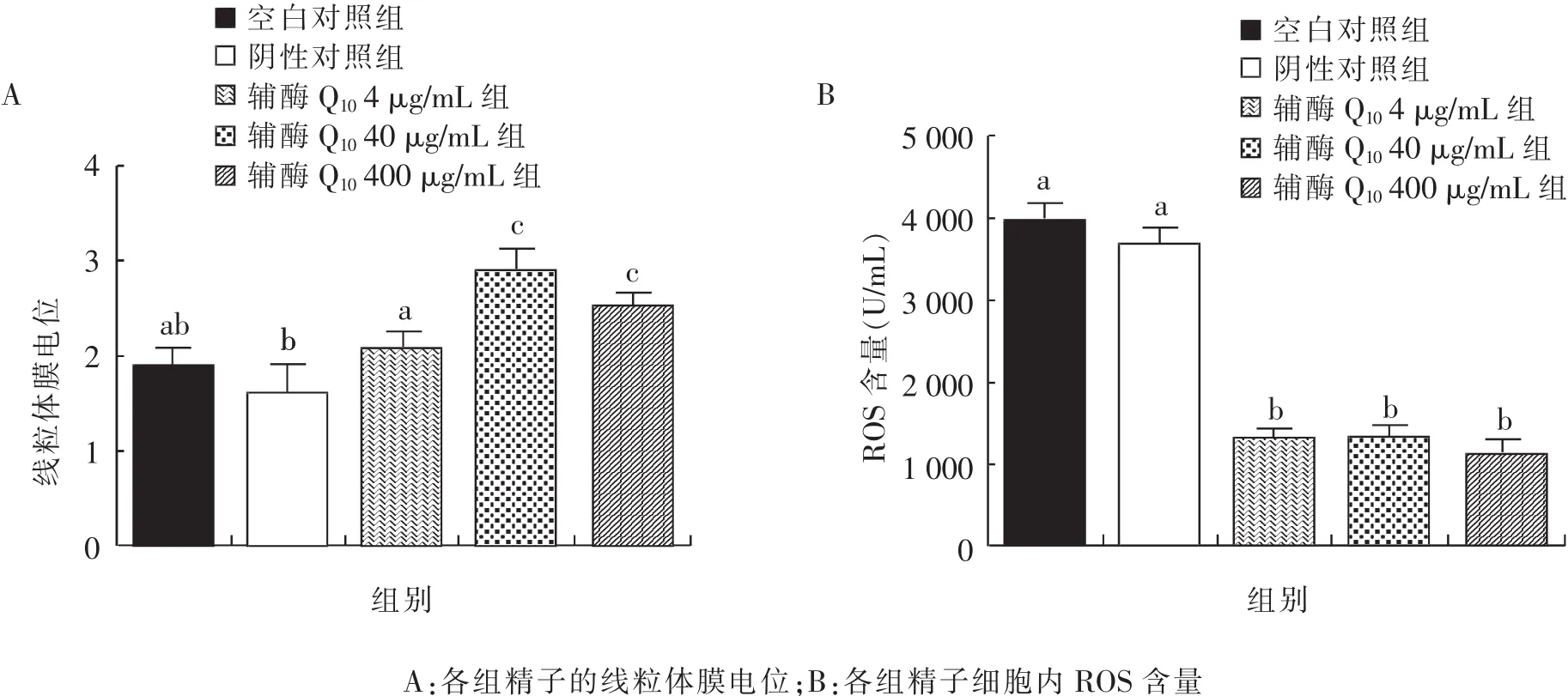
图3 不同浓度辅酶Q10对精子线粒体膜电位和细胞内ROS含量的影响
现今的研究结果表明,冷冻—解冻过程不仅会损伤精子线粒体,也会造成DNA片段化、质膜完整性破损和顶体缺失等形态学结构的损坏。众所周知,尽管精子DNA被高度压实的鱼精蛋白保护着,但ROS也可以直接作用于精子DNA的胞嘧啶[23],引起DNA解旋或者断裂。在该研究中,与对照组相比,40 μg/mL 和 400 μg/mL 辅酶 Q10处理组的质膜完整率和顶体完整率均显著提高 (P<0.05)。研究人员对20名具有弱精症的不育男性补充辅酶Q10进行治疗,结果显示,精子DNA完整率得到了改善[24]。有研究表明,辅酶Q10通过改变SOD活性和NO水平来保护精子DNA完整性。遗憾的是,在该研究中,笔者并没有检测SOD活性和NO水平。过氧化氢(H2O2)属于ROS的一种类型并且可以产生羟基自由基,该自由基可诱导脂质过氧化反应损害精子质膜完整性,从而完全抑制精子的运动和能量代谢。辅酶Q10作为可逆性的递氢体参与质子与电子的传递,影响某些酶的活性,是细胞自身的天然抗氧化剂和细胞代谢的激活剂,故具有保护和恢复生物膜的功能[25]。质膜含有参与维持电子传递链的抗氧化酶系统,如α-生育酚、辅酶Q和VC[11]。辅酶Q10被认为是保护膜脂质过氧化的中心分子,因为它可以直接参与细胞色素b5还原酶的生成[26-27],并维持VC和α-生育酚处于还原状态。已有研究证明细胞色素b5还原酶可以作为有效的抗氧化成分保护细胞免受氧化损伤[28]。在该研究中,外源添加一定浓度的辅酶Q10后,精子质膜的完整性得到了显著提高,证明辅酶Q10对绒山羊精液冷冻保存效果还是比较明显的。
4 结论
在冷冻稀释液中添加辅酶Q10可以提高经历冷冻—解冻过程的绒山羊精液精子质量,其中,添加40 μg/mL辅酶Q10的效果最好。

