猪流行性腹泻诊断方法研究进展
王 婧 ,刁小龙 ,牛蒙蒙 ,陈晓兰 ,张 龙
(1.江苏农牧科技职业学院,江苏 泰州 225300;2.中崇信诺生物科技泰州有限公司,江苏 泰州 225300)
1 猪流行性腹泻
猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)主要引起断奶仔猪出现呕吐、腹泻和脱水等症状,与传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV)同属于冠状病毒,二者均可引起猪肠道性传染病[1]。PEDV可感染多个年龄段的猪,尤其对仔猪的传染性较普遍。仔猪感染PEDV后死亡率较高,1周龄的仔猪可在发生腹泻后的4~5 d出现严重脱水从而导致死亡,死亡率高达50%,最高可达到100%。该病的主要传播途径是经消化道传播,病猪是主要的传染源。PEDV随粪便排出,传染速度较慢,通常在4~5周内传染整个猪场。由于该病的发病率较高,每年都会导致养猪行业的巨大损失。
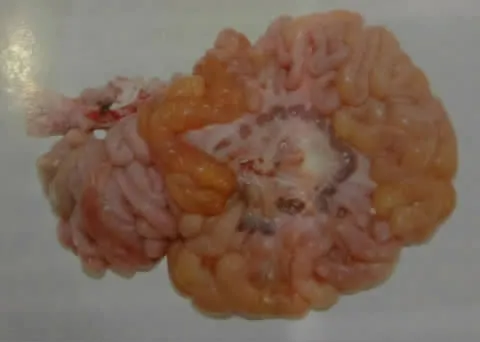
图1 病猪肠壁薄,肠内部出现黄色水样稀粪和黄色乳凝块[3]
1.1 流行病学特点
猪流行性腹泻的发生有明显的季节性,通常于冬季12月至第2年的2月发病,有时夏季也会发病。该病易感染各种日龄的猪,哺乳期、断奶期和育肥期猪感染率达15%~90%,仔猪的死亡率在50%,日龄越小被感染的概率越大。断奶猪、育肥猪感染该病后症状比较轻,成年猪则主要表现为呕吐和厌食等症状[2]。自20世纪80年代国内首次报道发现流行性腹泻病毒至今,该病毒的感染率在我国呈现逐年升高的态势,虽然在一定程度上疫苗起到了一定的保护作用,但是在2010年之后,该病在我国有了死灰复燃的趋势。
1.2 病理变化
感染PEDV的病猪发病前期腹泻主要排黄色黏稠便,后期为水样便并伴有精神不振[1]。病猪小肠扩张,肠内容物为黄色液体(见图1)或呈泡沫状,肠壁变薄(见图2)、变透明。小肠绒毛显著缩短。部分病猪胃呈空虚状态,或者充满黄色液体。
2 病原检测技术
2.1 病毒分离与鉴定
病毒分离鉴定技术是检测畜禽病毒的主要方法,也是最切实可行的方法[4],收集病变猪空肠和肠内容物,用加有双抗的PBS(磷酸盐缓冲液)配成5倍悬液离心,将离心后的上清液用微孔滤膜过滤,依照一定的比例在单层Vero细胞上接种,放置于37℃的培养箱中培养 3~4 d,观察细胞病变[5]。 感染 PEDV 的Vero细胞最明显的病变特征是细胞融合,形成多核体,并最终凋亡脱落。另外,也可将PEDV接种鸭小肠上皮细胞系,在胰酶存在的情况下病毒能够迅速繁殖。
2.2 免疫电镜观察
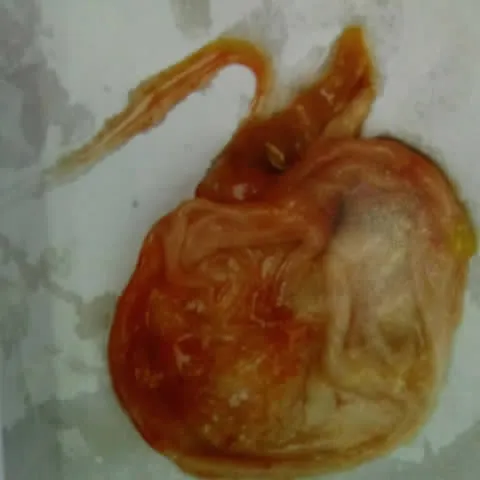
图2 病猪肠壁变薄[3]
免疫电镜技术是在超微结构水平上用来研究和观察抗原、抗体结合定位的一种方法,是免疫化学技术与电镜技术结合的产物。PEDV和TGEV都可引起各种年龄猪腹泻,两者同为冠状病毒属且借助普通电镜无法区分。免疫电镜能够准确地诊断病原体,可用已知的PEDV抗原检测未知抗体。该方法也可用于区分PEDV和同属冠状病毒科的其他病毒[6]。将含有抗原和抗体的溶液或血清离心,将2种溶液等量混合,37℃培养30 min,然后转移到恒温箱,然后再次离心样品,对沉淀物进行染色,放在免疫电镜下观察,可以观察到由病毒粒子形成的免疫复合物。电镜观察结果表明两者在形态上存在有细微差异,即猪流行性腹泻病毒粒子大小变化不一,呈多形性,纤突短小而密集,核芯呈多形性;猪传染性胃肠炎病毒粒子大小较均一,呈圆形或呈椭圆形,纤突大而稀疏,核芯为环形[7]。
3 免疫学诊断技术
免疫学诊断技术是根据抗原、抗体可进行特异性结合的原理,应用已知的抗原检测未知的抗体或应用已知的抗体检测未知抗原。该技术特异性高,简便安全,能快速准确地诊断感染性疾病,有利于疾病的早期诊断。
3.1 血清中和试验
中和试验是在测定病毒感染力的基础上,以比较病毒受免疫血清中和后的残存感染力为依据,用于判定免疫血清中和病毒的能力的一种方法,该方法具有检测结果准确、可靠,检测灵敏度高的优点。有学者以PK15(猪肾细胞)为指示细胞,采用适应Vero细胞的PEDV将醛化鞣酸化红细胞致敏,建立了PEDV微量中和试验,该方法特异性好,操作简便,可用于大规模的流行病学调查[5]。
3.2 酶联免疫吸附试验
酶联免疫吸附试验(ELISA)是一种成熟的实验室血清学检测方法,包含间接ELISA、双抗体夹心ELISA、竞争ELISA等,被定为国际贸易标准诊断方法之一[8]。ELISA 具备易于操作、价格低、灵敏度高、检测迅速等优势,ELISA既可以从病猪的粪便中检测出PEDV抗原,又可以从病猪的血清中检测出PEDV抗体[9]。ELISA法出现之前,许多国外科学家应用培养的病毒检测PEDV抗体。邓祖丽颖[10]等利用猪流行性腹泻病毒抗原重组蛋白包被96孔板建立了间接ELISA方法用于检测PEDV S蛋白抗体,并利用该方法对河南省不同地区猪场的母猪和育肥猪进行检测,阳性对照血清呈亮橙色,阴性对照血清孔无色或基本无色。结果表明来自河南不同地区23个猪场的279份血清中母猪阳性率为97.42%,育肥猪阳性率为71.74%。因为猪流行性腹泻病毒难以适应细胞培育,全病毒抗原制备的潜在危险,导致ELISA诊断技术仅限于实验室应用。
4 分子生物学检测技术
分子生物学检测技术是根据基因中的某一序列,检测出基因中所包含的抗体。可以弥补免疫技术的缺陷,缩短诊断时间,且该技术应用广泛,可用于各种病原微生物的检测。
4.1 荧光定量PCR技术
荧光定量PCR技术具备重复性好、灵敏性高等优势,检测技术要优于其他的分子生物学检测技术,被世界动植物卫生组织(OIE)引荐用于动物疾病的检测[11]。该技术是在PCR反应体系中加入荧光基团,应用荧光信号累积实时监测整个PCR进程,最后经过详细的数学原理对未知模板的定量剖析[12]。 刘邓等[13]根据 PEDV N 基因序列设计一对特异性引物和探针,建立了TaqMan荧光定量PCR方法,并检测了80份临床样本的PEDV病毒含量,阳性率为95%,而反转录PCR检测阳性率为85%,表明该措施灵敏性显著高于一般PCR,可以利用荧光定量技术对PEDV病毒进行检测。
4.2 反转录酶链式反应(Reverse Transcriptional PCR,RT-PCR)
RT-PCR方法简便、快速、灵敏、特异,是实验室中常用的分子生物学诊断方法之一。吴学敏等[14]建立了检测PEDV M基因的RT-PCR方法,该方法具备较好的特异性和灵敏性,能精准地检测到PEDV RNA 100 pg,可用于临床诊断猪流行性腹泻病毒。郭容利[15]等采用RT-PCR方法检测江苏、安徽、河北、山东等地的146头仔猪腹泻样品,82份样品为PEDV阳性。
4.3 多重PCR技术
多重PCR技术是一种特殊形式的PCR,分子生物学的多个领域研究应用到多重PCR,例如病原体鉴定、遗传性疾病诊断等[12]。临床不能确定病猪被何种病毒感染时,通常采用多重PCR方法,一次反应就可以鉴别样品中的TGEV和PEDV,甚至鉴别更多病原种类,结果较准确,从而达到诊断和治疗的作用。多重PCR和一般PCR比较,更加快速、方便,可短时间内提供结果。
4.4 胶体金免疫技术
胶体金免疫技术由于其灵敏性和特异性高的优势,无需特殊仪器,直接可以判断结果,适用于基层兽医部门。张利勃[16]等对金黄色葡萄球菌蛋白A(SPA)的胶体金进行标记作为指示介质,用重组表达的PEDV M蛋白抗原和抗金黄色葡萄球菌蛋白A(SPA)的基因抗体作为检测线和指控线,开发出用于检测PEDV血清抗体的胶体金免疫层析试纸条,进一步试验证明该试纸的灵敏度和ELISA几乎相同,符合率达96%。该试纸还具有灵敏度高、简洁快速等优点,为基层检测抗体提供便捷的措施。
5 其他检测技术
环介导等温扩增技术(LAMP)是利用体外核酸反应,在恒定的温度下,添加酶和特异性引物,得到迅速的核酸扩增技术,该方法设备简单、易于掌握、有效节省时间[17]。 郑新添[18]等将 PEDV 的 NP 基因,进行序列分析,成功设计了LAMP引物,优化反应体系,在65℃下扩增60 min,借助核酸染料染色后只需肉眼便可观察、判定结果。王伟[19]等根据PEDV的M基因建立了特异性强、灵敏度高的LAMP检测方法。罗亚坤[20]等基于PEDV的N基因设计6对引物,对建立环介导等温扩增检测方法进行了优化,成功建立了PEDV LAMP检测方法。
6 预防途径
猪场的环境卫生对预防病原感染具有重要的作用,因此保持猪场的环境卫生、保持地面整洁,定期清理排泄物、立即隔离患病猪[21]等措施对有效控制该病的传播具有重要意义。定期对猪场内部的通道、圈舍、相关用具进行清理和消毒,消毒时间应该安排在清理粪便之后,消毒次数为每天2次左右。同时还要经常对猪舍内的鼠、苍蝇、虫类进行消灭处理。对新引进的猪进行隔离观察,一旦疫情发生,及时焚烧和掩埋死亡的猪,最大限度将疫情控制在最小范围。
7 结语
腹泻类疾病是影响猪只健康的一类重要疾病,尤其是危害仔猪健康,而引起仔猪腹泻的病因复杂,包括饲养管理、断奶应激、病原感染等,其中PEDV是引起仔猪腹泻的病毒性疾病最重要的病原之一。该病传播迅速,在我国猪场中广泛存在,一旦发病较难控制,给养猪业造成严重的经济损失,增加养殖成本,同时若通过投放大量的药物进行预防或治疗,由于药物残留问题给食品安全带来隐患[22]。猪群发病时可以采取药物治疗和饥饿疗法相结合的方法进行治疗,对于一些严重的仔猪可以考虑静脉注射和腹腔注射给药[23]。随着生物科技的不断进步,对于该类疾病的诊断技术日趋完善,只有尽早对该病进行确诊才能及时采取相应的治疗手段,最大限度减少养殖户的经济损失。

