重组双基因鸭源大肠杆菌菌蜕的制备
,
埃希氏大肠杆菌(Escherichiacoli,E.coli)属革兰氏阴性菌,其血清型众多、能感染动物和人类并引起严重疾病。鸭埃希氏大肠杆菌病的发病率与死亡率均很高,已给我国养鸭业造成了巨大的经济损失[1-3]。为防治该病,临床上大量的使用抗生素,导致E.coli耐药菌株频繁出现,这不但给养殖业造成严重的经济损失,同时对动物和人类的健康都造成了危害。因此,免疫预防已成为防治埃希氏大肠杆菌病的首选方法。但是传统的疫苗一般采用物理和化学因素灭活,抗原决定簇可能被破坏或部分破坏,这导致了这些疫苗出现免疫保护力差。此外,也有的学者考虑由于传统灭活细菌疫苗接种的是全菌细胞,因此接种过程可能将细菌耐药基因和毒素基因带入被接种动物。
1985年Lubitz等[4]对大肠杆菌噬菌体 phiX 174 的裂解E基因进行研究,他们将 phiX 174噬菌体的裂解E基因克隆在质粒上并转化大肠杆菌,E基因表达后使菌体形成跨膜孔道,之后宿主菌内容物通过此跨膜孔道逸出形成没有内容物的菌蜕(Bacterial ghost)。随后,许多研究者证实菌蜕制备技术可广泛应用于革兰氏阴性细菌。菌蜕疫苗对菌体的灭活过程不会损坏菌体的任何抗原结构,不影响其免疫原性,因此菌蜕有望成为优良的候选灭活菌体疫苗。金黄色葡萄球菌核酸酶A(Staphylococcusnuclease A,SN),是一种活性依赖于钙离子及镁离子浓度的胞外核酸非专一性磷酸二酯酶,能降解单链或双链DNA(或RNA)[5-6]。在制备菌蜕时,如果将SN基因也克隆在细菌中表达,该核酸酶可将细菌 DNA 降解为100 bp左右的片段,这个过程不仅可以提高菌蜕致死率,而且同时也将细菌的耐药基因和毒素基因降解,避免了通过接种带入被接种动物的风险,从而提高了菌蜕的安全性。
本研究中我们将含E基因和SN基因的重组质粒转化入鸭源E.coliO92,双基因表达后不仅可对菌体实现双重杀灭作用,提高致死率,同时把菌体DNA降解为小片段。该菌蜕不仅免疫原性好,同时也消除也耐药性基因和毒素基因可能带来的潜在风险,因此本研究有着重要的理论意义和应用价值。
1 材料与方法
1.1 材料
1.1.1菌株及质粒 本研究所用的大肠杆菌菌株为本课题组从广东省珠三角地区某发病鸭场分离,并鉴定为血清型O92。双基因重组质粒 pET29a-E-S,带有裂解E基因和SN基因,由本室构建;其结构见图1;E.coliDH5α(pET29a-E-S)由本室保存。
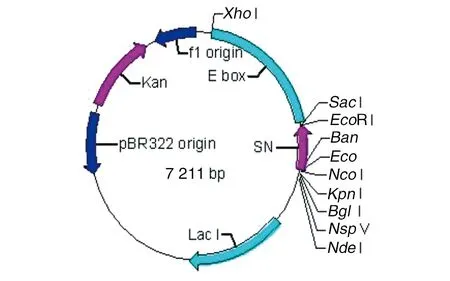
图1 质粒pET29a-E-S图谱Fig.1 Map of plasmid pET29a-E-S
1.1.2主要试剂和仪器 主要仪器有:3 K18 高速冷冻离心机(美国 Sigma 公司);GNA100 电泳仪、Ultrospec 2000 紫外/可见分光光度计(美国 Amersham 公司);ULT-1386-3V -80 ℃ 超低温冰箱(美国 REVCO 公司);Image Master VDS 凝胶成像分析系统(瑞士 Amersham 公司)。KpnI、BamH I、XhoI、1 kb DNA Marker、5 kb DNA Marker购自大连宝生物有限公司。
1.2 大肠杆菌菌蜕的制备
1.2.1质粒pET29a-E-S转化E.coliO92参照文献[7]方法进行,从E.coliDH5α(pET29a-E-S)提取质粒,并用氯化钙法将质粒pET29a-E-S转化入E.coliO92,接种于含卡那霉素(50 μg/mL)的 LB 平板上进行筛选,挑取单菌落接种于 LB 液体培养基培养,提取质粒后用XhoI进行单酶切鉴定;用KpnI与XhoI,BamH I 与XhoI进行双酶切鉴定。
1.2.2E.coliO92菌蜕的制备 上述转化成功的E.coliO92,涂布接种于新制备的含卡那霉素(50 μg/mL)的LB固体培养基上,于37 ℃培养,挑取单个菌落转接于含卡那霉素(50 μg/mL)的LB液体培养基,37 ℃过夜振荡培养,待测得菌液OD600值为0.6~1后,取1 mL菌液转接于200 mL含卡那霉素(50 μg/mL)的LB液体培养基中,继续37 ℃振荡培养,在菌液OD600值在0.4~0.6时,开始把温度迅速升温至42 ℃,升温前45 min加入 IPTG 使其最终浓度的为 5 mmol/L,升温后90 min加入MgCl2,CaCl2使最它们的最终浓度分别为1 mmol/L、10 mmol/L,进行诱导。
1.3E.coliO92(pET29a-E-S)溶菌动力学试验 按1.2.2培养菌液至OD600在 0.4~0.6 时,将培养物分成 3 组继续培养。①非诱导对照组:37 ℃培养;② E 基因单诱导表达组,42 ℃培养;③双基因诱导表达组:42 ℃培养,升温前 45 min加入 IPTG使其最终浓度的为 5 mmol/L ,升温后 90 min加入MgCl2,CaCl2使最它们的最终浓度分别为1 mmol/L、10 mmol/L。每隔 30 min 取样,测定OD600值,直到 42 ℃培养的OD600值趋于平稳为止。
1.4表达后上清所含DNA检测 为检测核酸酶对DNA的降解效果,将1.3溶菌结束后的菌液12 000× g离心2 min,取上清用酚氯仿法[7]提取DNA后进行电泳检测。
2 结 果
2.1转化菌E基因和SN基因的酶切鉴定 将pET29a-E-S 转化E.coliO92后提取的重组质粒进行酶切鉴定,结果如图2所示,用BamH I 和XhoI 进行双酶切后显示有约 5 365 bp 和 1 878 bp 预期的两条带,此分别为线性质粒 pET29a与片断 E-S;用KpnI与XhoI进行双酶切后显示有约 5 783 bp 和 1 428 bp 两条带,此分别为线性质粒 pET29a-S 和 E 基因盒;用XhoI酶单酶切仅一条约7 211 bp 条带,与线性质粒 pET29a-E-S大小一致。上述酶切结果与预期一致,说明质粒 pET29a-E-S 已经成功转化进入E.coliO92。
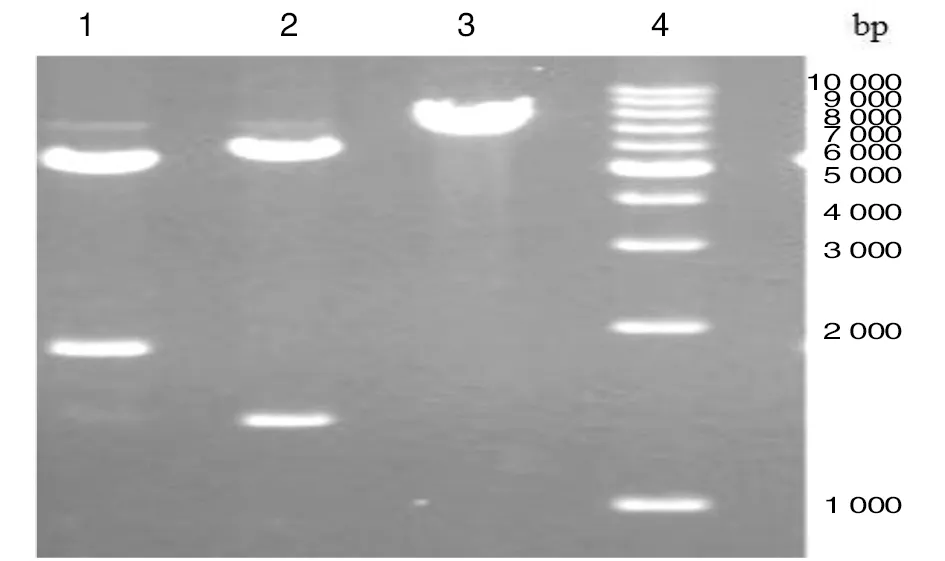
1: BamH I 和XhoI双酶切; 2: KpnI和XhoI双酶切; 3: XhoI 单酶切; 4:1 kb DNA Ladder Maker图2 重组质粒pET29a-E-S酶切鉴定结果Fig.2 Digestion map of recombinant plasmid pET29a-E-S
2.2E.coliO92(pET29a-E-S)溶菌动力学试验 含双基因重组载体的E.coliO92经诱导表达后,OD600先上升后下降,3 h 后逐渐趋于平缓;而含空载体的对照组OD600一直上升,见图 3,表明在诱导过程中细菌发生裂解。E 基因单表达和双基因共表达生长曲线差异不明显,但裂解死亡率却有差异,仅E基因表达时为99.7%,双基因共表达时为99.999%。

图3 含有重组表达质粒的E.coli O92生长曲线和两种不同表达的裂解曲线Fig.3 Growth and two different expression lysis curves of E.coli O92 harboring recombinant plasmid
2.3表达后上清所含DNA检测 E基因单诱导与双基因诱导共表达不同诱导时间上清液中所提取 DNA 电泳结果如图 4 所示, 当E 基因单诱导表达时,上清中含有较多的DNA,且随着诱导时间的延长,上清中提取的 DNA 片断无明显变小的趋势,在诱导6 h后,其 DNA 的片断大小大约在 2 000 bp至 10 000 bp之间,这说明菌体DNA通过E基因形成跨膜孔道进入上清液。而双基因诱导共表达中,上清中亦含有较多的DNA,而且随着诱导时间的延长,DNA片断的大小变小趋势明显,在诱导6 h后,其 DNA 片断大小在 50~400 bp左右,从此可以看出:菌体DNA不仅通过E基因形成跨膜孔道进入上清液,而且这些DNA还被共表达的葡萄球菌核酸酶降解为50 ~ 400 bp的小片断。
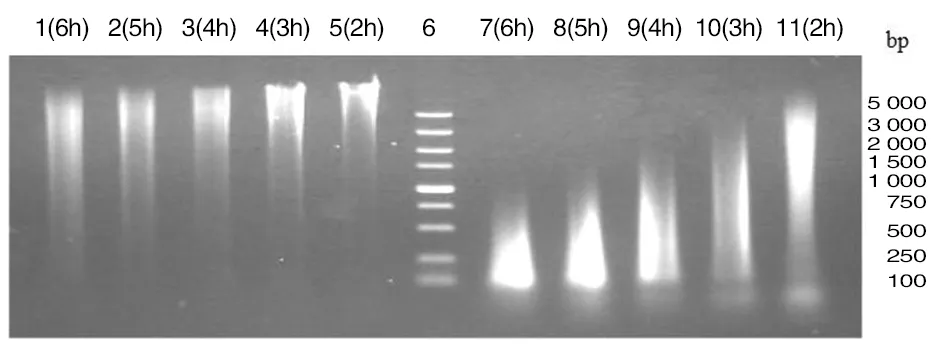
1、2、3、4、5: E基因表达 6:DNA DL5000 DNA Maker; 7、8、9、10、11:E基因和SN基因表达 图4 上清液中提取的总DNA电泳分析结果Fig.4 Electrophoretic analysis of the total DNA content in the supernatants
3 讨 论
菌蜕是经phiX 174的裂解E基因介导制备的,若要成功制备菌蜕, E 基因在宿主菌中不仅要高效表达,而且必须通过诱导表达进行控制,这就需要选择合适的表达诱导系统。早期选择的溶菌载体是通过温度诱导表达的调控系统λpL/pR-cI857,该系统在28 ℃及以下E基因不表达;升温至28 ℃时,裂解E基因开始表达,在42 ℃时表达效率最高。这种表达系统具有诱导方式简便且成本低的优点,但对于多数细菌来说采用28 ℃作为培养温度偏低,影响细菌生长,从而影响了制备菌蜕的效率。后来,Jechlinger等[8]对λpR启动子的阻遏子结合操纵区域进行点突变,得到了新的表达系统,采用此表达系统制备菌蜕,可在37 ℃培养细菌,此时E基因不表达,但当温度上升至42 ℃时即能启动裂解E基因表达导致细菌死亡从而获得菌蜕。本研究采用新的表达系统,因为37 ℃时E基因仍不表达,因此可以在37 ℃培养E.coliO92后升温至42 ℃诱导E基因表达,大大提高了制备效率。
与至今仍广泛使用的化学试剂如福尔马林灭活细菌疫苗相比较,菌蜕制备过程并没有损坏细菌菌体的各种抗原结构,因此不会因为制备过程影响其免疫原性,因此近些年来已经成为疫苗研究的热点。目前,国内外已有很多报道采用该技术制备了多杀巴氏杆菌(Pasteurellamultocida)[9]、溶血巴氏杆菌(Pasteurellahaemolytica)[9]、胸膜肺炎放线杆菌(Actinobacilluspleuropneumoniae)[10]、肠出血性大肠杆菌(EnterohemorrhagicEscherichiacoli,EHEC)[11]、肺炎克雷伯氏菌(Klebsiellapneumoniae)[12]和迟缓爱德华氏菌(Edwardsiellatarda)[13]菌蜕的报道,但大都采用E基因单独表达来实现遗传灭活。本研究采用E基因和SN基因共表达对鸭源E.coliO92实现遗传灭活,裂解率达到99.999%,高于E基因单表达,并且共表达的葡萄球菌核酸酶把DNA降解为400 bp 以下的小片断。这对细菌而言既通过裂解蛋白形成了跨膜孔道又通过对葡萄球菌核酸酶遗传物质DNA进行了降解,可谓“完全彻底”灭活。这与E基因单一对细菌体进行灭活相比既增加了灭活效果,又消除了耐药基因和毒素编码基因随着免疫接种进入动物(或人)的潜在风险。

