他克林体外抗细粒棘球蚴作用研究
,,, , ,
包虫病又称棘球蚴病(Echinococcosis),是由棘球绦虫中绦期幼虫感染所致的重要人兽共患疾病。目前,细粒棘球绦虫(Echinococcusgranulosus)和多房棘球绦虫(E.multilocularis)是两种最为重要的致病病原,呈世界性分布[1-2]。我国首次包虫病全国流行病学调查结果显示,我国包虫病流行范围广,患病数量和疾病负担均居全球首位[3]。人们通过误食虫卵污染的水源和食品等感染,棘球蚴囊可产生占位性病变,其中多房棘球蚴可直接浸润肝组织,使患者肝功能严重受损,随着病程的发展,棘球蚴病严重危害患者生命健康,甚至导致死亡[1]。目前,该病的临床化疗药物较为局限,仅有甲苯达唑(mebendazole)和阿苯达唑两种,且治愈率均不高[4],因此寻找新的治疗药物或者治疗方案是目前亟待解决的科学问题。
近年来,一些广谱抗寄生虫药物和抗癌药物被报道具有潜在的抗棘球蚴作用,可观察到其体内外对细粒棘球蚴和多房棘球蚴的作用效果[5-6]。本课题组前期亦对一些临床药物的抗棘球蚴效果进行了评价,从中发现了多个潜在的治疗包虫病药物。本研究对临床治疗阿尔兹海默病药物—他克林(Tacrine)在体外对细粒棘球蚴作用进行了观察。
1 材料与方法
1.1虫体和实验动物 昆明小鼠体重(20±2)g购自上海斯莱克实验动物有限责任公司。细粒棘球蚴原头节来源于青海自然感染的绵羊细粒棘球蚴囊,从囊液中取出的原头节用生理盐水清洗5~8次后弃去囊液及残留的囊壁组织。用0.1%的亚甲基蓝溶液对原头节进行染色,并在倒置显微镜下观察其活性,其中死亡的原头节被染成深色,原头节活性大于95%的用于后续的研究。用含有500 U双抗的生理盐水调整细粒棘球蚴原头节密度为4 000个/ mL,向昆明小鼠腹腔注射0.5 mL原头节悬液,模型建立8个月以上可用于生发层细胞的分离。
1.2主要试剂 他克林和甲苯达唑均购自于美国Sigma公司, RPMI 1640培养基和其他细胞培养相关试剂为美国Gibco公司产品,二甲基亚砜(dimethyl sulfoxide,DMSO)购自上海林峰化学试剂有限公司,亚甲基蓝(methylene blue)购自上海三爱思试剂有限公司,CCK-8试剂盒购自于日本Dojondo公司。
1.3细粒棘球蚴原头节和生发层细胞体外培养 将细粒棘球蚴原头节加入完全培养基(PRMI 1640培养基中包含10%胎牛血清、10%囊液、2 mmol/L谷氨酸、1 mmol/L丙酮酸钠、100 U/mL青霉素以及100 μg/mL链霉素)中,在5% CO2,37 ℃条件下培养,每4~5天换液1次。按照每200 μL培养基包含50~200个原头节加入96孔培养板中培养过夜后用于药效观察实验。解剖细粒棘球蚴感染的昆明小鼠,取出其腹腔内的囊,用生理盐水清洗3~5次后经37 ℃的2.5%胰酶消化10~30 min后以500 ×g离心5 min后弃上清并加入完全培养基调整生发层细胞密度至5×104个/mL,置于5% CO2,37 ℃培养箱中孵育,每2~3 d换液1次。将培养后的生发层细胞悬液按照1×104个/200 μL加入96孔培养板,培养过夜贴壁后可用于药效观察实验。
1.4细粒棘球蚴原头节和生发层细胞体外给药方案 用DMSO配制的浓度为4、8、10、20和40 μg/mL的他克林分别同细粒棘球蚴原头节和生发层细胞在5% CO2,37 ℃条件下进行孵育,同时以0.5% DMSO作为空白对照。孵育3 d后的原头节用0.1%的亚甲基蓝溶液染色并在倒置显微镜下计数,分别记录死亡原头节数和原头节总数,计算原头节死亡率。原头节死亡率(%)=(死亡原头节数目/原头节数目总和)×100%。生发层细胞的活性用CCK-8试剂盒测定,计算细胞活性抑制率。细胞抑制率(%)=[(对照细胞活性-药物作用后细胞活性)/对照组细胞活性]×100%。
1.5透射和扫描电子显微镜观察 将40 μg/mL 他克林作用后的原头节和生发层细胞置于2.5%的戊二醛4 ℃固定过夜。透射电镜实验步骤:用PBS清洗3次,用2%的锇酸4度固定2 h,再用PBS清洗3次(每次15 min),分别用50%、70%、80%和90%乙醇梯度脱水各15 min,再用100%乙醇脱水3次(每次20 min),丙酮置换2次(每次15 min)后用丙酮:包埋剂(体积比)=2∶1的浸渍液浸渍4 h,再用丙酮:包埋剂(体积比)=1∶2的浸渍液浸渍4 h,用纯包埋剂浸渍2次(每次12 h)。将样品放入盛有纯包埋剂的包埋板中置于65 ℃条件下聚合48 h以上,修理包埋头后制备厚度为70 nm的包埋切片,用乙酸双氧铀染色10 min,用柠檬酸铅染色10 min后上机检测。扫描电镜实验步骤:用PBS清洗3次(每次10 min),分别用30%、50%、70%、80%和90%乙醇梯度脱水各15 min,再用100%乙醇脱水3次(每次15 min),叔丁醇置换3次(每次30 min)后,用真空冷冻干燥机干燥样品过夜。将样品用导电胶带粘到样品台上,用离子溅射仪镀10 nm金膜后上机检测。
2 结 果
2.1他克林对细粒棘球蚴原头节的体外作用效果
在倒置显微镜下观察0.1%亚甲基蓝染色后的原头节以判断其活性,其中对照组中的原头节经DMSO作用3 d后活性仍然较高(94.28±2.31%),其形态未见明显的改变(图1A,2A)。不同浓度他克林对细粒棘球蚴原头节活性的影响可见图1A,经20 μg/mL和40 μg/mL的他克林作用3 d后,原头节的死亡率高达100%,其中死亡原头节的体壁出现轻微肿胀伴随着外部轮廓的消失(图2B)。但当药物作用浓度降低至10 μg/mL以下时,未发现对原头节活性的影响。
2.2他克林对细粒棘球蚴生发层细胞的体外作用效果 他克林对细粒棘球蚴生发层细胞活性的影响呈现剂量相关性(图1B),当其浓度为40 μg/mL时,对细胞活性的抑制率可达100%。而当他克林浓度降低至20 μg/mL时,细胞活性抑制率减少到(40.42±4.67)%。随着药物剂量的进一步降低,由他克林造成的生发层细胞活性抑制率低于20%。经40 μg/mL的他克林作用后3 d后,细粒棘球蚴生发层细胞粘附于培养介质的基质消失,同时伴随着非正常的细胞聚集以及细胞数目的减少(图2D)。而在正常状态下,生发层细胞经过夜培养后贴壁生长,均匀平铺于培养板(图2C)。

注:A: 他克林对原头节剂量反应关系曲线;B:他克林对生发层细胞剂量反应关系曲线。图1 他克林对体外培养的细粒棘球蚴原头节和生发层细胞活性的影响Fig.1 Activity of E. granulosus metacestodes and germinal cells treated with tacrine in vitro
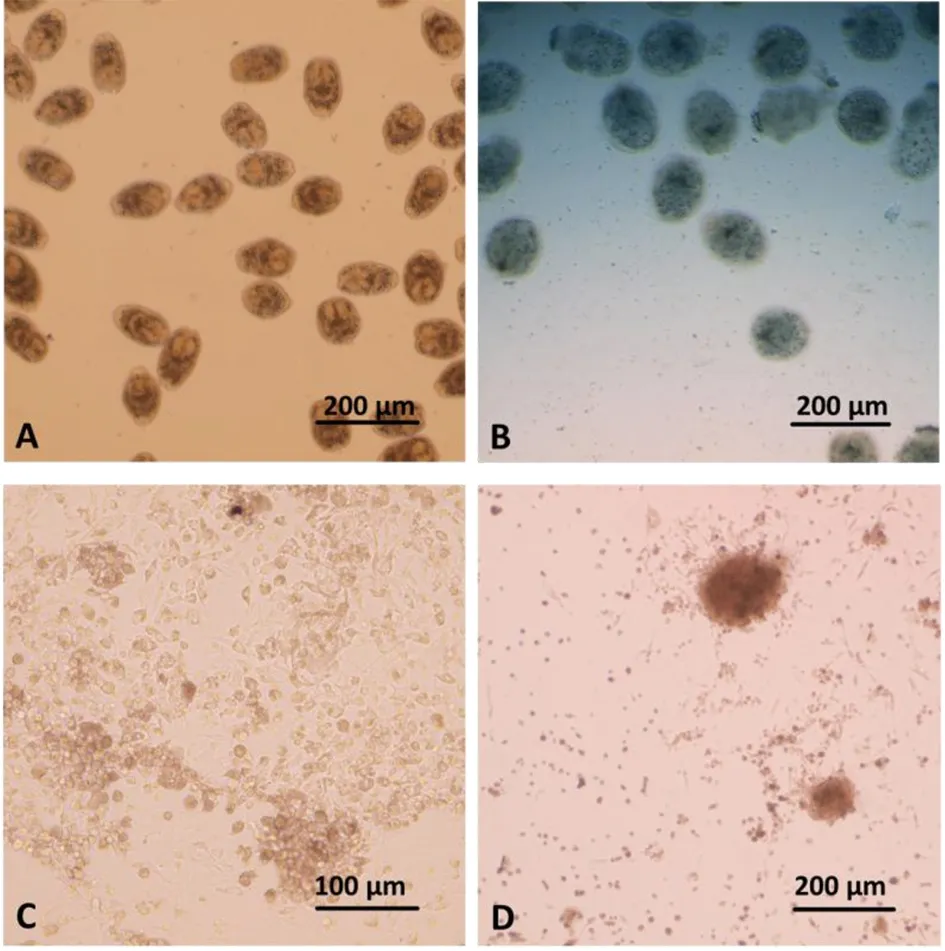
注:A:DMSO对照组正常原头节;B:他克林作用3 d原头节;C:DMSO对照组正常生发层细胞;D:他克林作用3 d生发层细胞。图2 体外培养的细粒棘球蚴原头节和生发层细胞经40 μg/mL的他克林作用后的形态变化Fig.2 Morphylogical changes of E. granulosus metacestodes and germinal cells caused by 40 μg/mL tacrine in vitro
2.3透射和扫描电子显微镜观察结果 透射电镜结果表明,DMSO对照组的原头节形态正常,其体壁结构完整,包括远端胞浆、肌肉束以及糖原储存细胞等有序排列(图3A)。而经40 μg/mL的他克林作用3 d后,原头节的超微结构发生了明显的改变,主要体现在其体壁结构被破坏,出现了大量的空泡和脂肪滴(图3B)。在扫描电镜下观察到DMSO对照组正常的生发层细胞为圆形,其形态均匀饱满,通过粘附基质附着于培养板(图3C)。当他克林作用3 d后,细胞形态发生了明显变化,主要表现在细胞出现塌陷或者萎缩,细胞粘附基质消失(图3D)。

注:A:DMSO对照组正常原头节;B:他克林作用3 d原头节;C:DMSO对照组正常生发层细胞;D:他克林作用3 d生发层细胞。图3 他克林(40 μg/mL)体外作用导致细粒棘球蚴原头节和生发层细胞的超微结构变化Fig.3 Ultrastructural changes of Echinococcus granulosus metacestodes and germinal cells caused by 40 μg/mL tacrine in vitro
3 讨 论
他克林作为乙酰胆碱酯酶抑制剂,于1994年由美国食品药品管理局批准上市,用于治疗轻到中度阿尔兹海默病[7]。本研究报道了他克林对棘球蚴的作用效果,实验结果表明他克林对体外培养细粒棘球蚴生发层细胞和原头节的活性均有直接影响,尤其是20 μg/mL和40 μg/mL的药物浓度可造成大部分寄生虫的死亡。药物作用可引起原头节超微结构的改变,在死亡的原头节中可见大量的空泡和脂肪滴,该变化在其他药物的作用中亦有报道[8-13]。根据此次实验结果,发现细粒棘球蚴原头节对于他克林相较于生发层细胞更为敏感,提示其主要通过影响原头节的活性发挥抗包虫作用效果,因此其不仅有作为抗包虫药物的潜能,亦可作为原头节杀灭剂使用。
目前,治疗包虫病的药物仅有甲苯达唑和阿苯达唑两种,而上述药物因为口服吸收较差,限制其药效的进一步发挥。他克林作为临床治疗药物,其系统的药代动力学研究结果表明,其亲脂性的特点使得口服他克林可被机体快速以及充分吸收[14-15],可在肾脏、肝脏、膀胱等组织中检测到较高的药物浓度[16],这些部位都是棘球蚴囊可能的寄生位点,提示其在经口服给药后可在棘球蚴治疗靶位点达到有效药物浓度,从而实现治疗效果。根据本研究结果,他克林的对细粒棘球蚴原头节的体外作用效果较好,但是需要较高药物浓度才能对生发层细胞的活性有较强的抑制效果,因此在后续研究中应该重点关注他克林在治疗包虫病的给药方案的优化,尤其联合用药的可能性。据报道,在他克林治疗阿尔兹海默病的临床治疗中,患者可出现转氨酶的升高,但停药后可恢复正常。鉴于包虫病药物治疗的特点,通常需要长期给药,因而他克林作为抗包虫治疗药物的后续研究仍需考虑药物毒性对治疗带来的影响。
他克林除了治疗阿兹海默病,还对慢性脑缺血起到一定的保护作用[17]。其主要的作用机制为该药物可通过抑制突触间隙内乙酰胆碱的降解,从而活化及保护毒蕈碱和烟碱受体,以此改善患者的胆碱能系统功能,提高其认知能力[18]。另外,他克林可抑制K离子和Ca离子通道等一些电压门控离子[19]。上述的乙酰胆碱酯酶以及离子通道等是否可作为他克林抗棘球蚴的药物作用靶点还需进一步的研究加以证明。
综上所述,本研究报道了他克林对细粒棘球蚴的作用效果,探索其作为治疗包虫病药物新药的应用前景。经实验验证,他克林作用于体外培养的细粒棘球蚴原头节和生发层细胞,均表现出显著的杀灭和抑制效果,提示其是潜在的包虫病治疗药物。

