2015-2016年深圳市登革Ⅲ、Ⅳ型分离病毒株E/NS1基因序列特征
, , ,,,,
登革热(dengue fever,DF)是由登革病毒(dengue virus,DENV)引起的病毒感染性疾病,主要通过埃及伊蚊和白蚊伊蚊对人类和灵长类动物的叮咬传播[1]。人类感染登革病毒后临床症状为发热、头痛、全身肌肉骨骼关节痛、皮疹等。2009年WHO对登革热临床分型分为登革出血热和重症登革热[2]。登革病毒含有3个结构蛋白,即包膜蛋白E,膜蛋白M和衣壳蛋白C,和7个非结构蛋白质(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)[3]。根据包膜蛋白E的抗原不同,登革病毒分为4个血清型(DENV1-4), 4种DENV血清型均有传染性和致病性[4]。E蛋白是参与中和及血凝抑制作用的主要抗原,而登革病毒的非结构蛋白NS1也具有抗原亚组和型特异的抗原表位。NS1是一种可溶性补体结合抗原,能引起保护性免疫[5]。
登革热广泛流行于热带和亚热带国家[6]。近年来,我国登革热也频发流行。广东省深圳市一直是全国登革热防控的重点地区,2015年由医院送检排查登革热疑似病例102份,检出阳性46份,2016年由医院送检排查登革热疑似病例327份,检出阳性24份,4个亚型在深圳市均有检出,并出现了Ⅲ、Ⅳ型登革病毒。本研究收集2015-2016年深圳市流行的登革热血清样本,进行分离鉴定,并对登革Ⅲ、Ⅳ型病毒的E基因和NS1基因进行分析, 探讨其地理迁移和输入源头。
1 材料与方法
1.1样本采集 采样对象主要是登革热疑似病例和临床病例等,有必要时采集疑似病例密切接触者的样本,采集5 mL血液标本,血清、血浆均可。48 h内进行病毒分离,可存放于4 ℃-8 ℃;存放时间较长,应将血清分离出来,存放于-70 ℃,避免反复冻融。
1.2样本来源 样本为深圳市疾病预防控制中心病原生物所实验室保存的2015-2016年登革热患者的血清。
1.3试剂及仪器 DMEM细胞培养液、0.25%Trypsin-EDTA、胎牛血清为美国Gibco公司产品,青链霉素为美国Invitrogen公司产品,DMSO为美国Sigma公司产品,C6/36细胞为深圳市疾病预防控制中心病原生物所保存,PCR试剂盒和琼脂糖购自宝日医生物技术(北京)有限公司,High Pure Viral RNA kit为德国Roche公司产品,登革病毒Ⅰ、Ⅱ、Ⅲ和Ⅳ型核酸检测试剂盒购自深圳澳东检验检测科技有限公司。
1.4病毒分离培养 患者血清用2%的细胞维持培养液稀释20倍并过滤,待C6/36细胞培养至细胞铺至培养瓶80%~90%时,将稀释后的血清接种在C6/36细胞中,28 ℃ 5% CO2培养,每天在镜下观察细胞病变情况,当75%的C6/36细胞出现肿胀变圆、空泡状等细胞病变时,收集细胞培养液上清,并与-80 ℃保存。
1.5登革病毒血清型鉴定 取200 μL血清样本,用RNA提取试剂盒提取病毒RNA,以提取后的RNA为模板,用登革病毒Ⅰ、Ⅱ、Ⅲ和Ⅳ型分型试剂盒进行FQ-PCR反应,对登革热样本进行血清型鉴定。
1.6E基因和NS1基因引物设计 从 GenBank中查找登革病毒的E基因和NS1基因序列(E基因GenBank登录号:AY099337.1、EF440435.1等,NS1基因GenBank登录号:JN406515.1、JF262783.1等),运用Primer Express 3.0软件,分别设计登革Ⅲ、Ⅳ型病毒E基因和NS1基因上下游PCR引物(Primer F、Primer R),详见表1。
1.7E基因和NS1基因PCR扩增 取200 μL细胞培养液上清,用RNA提取试剂盒提取病毒RNA,以提取后的RNA为模板,65 ℃ 5min变性后立即放在冰上,配制逆转录反应液:5×RT Buffer 2 μL,RT Enzyme Mix 0.5 μL,Primer Mix 0.5 μL,RNA 7 μL。在PCR仪上进行逆转录反应,37 ℃ 15 min,98 ℃ 5 min。逆转录产物cDNA于-20 ℃保存。以登革Ⅲ、Ⅳ型病毒E基因和NS1基因cDNA为模板,PCR扩增E基因和NS1基因片段。PCR反应体系:5 μL 10×Buffer,4 μL dNTP,1 μL Primer F,1 μL Primer R,0.25 μL Enzyme,3 μL cDNA,35.75 μL H2O。反应条件:94 ℃3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min, 30循环;72 ℃12 min。PCR产物经浓度为1%的琼脂糖电泳成像。
表1 登革Ⅲ、Ⅳ型病毒E基因和NS1基因上的引物序列
Tab.1 Sequences of primers for gene E and NS1
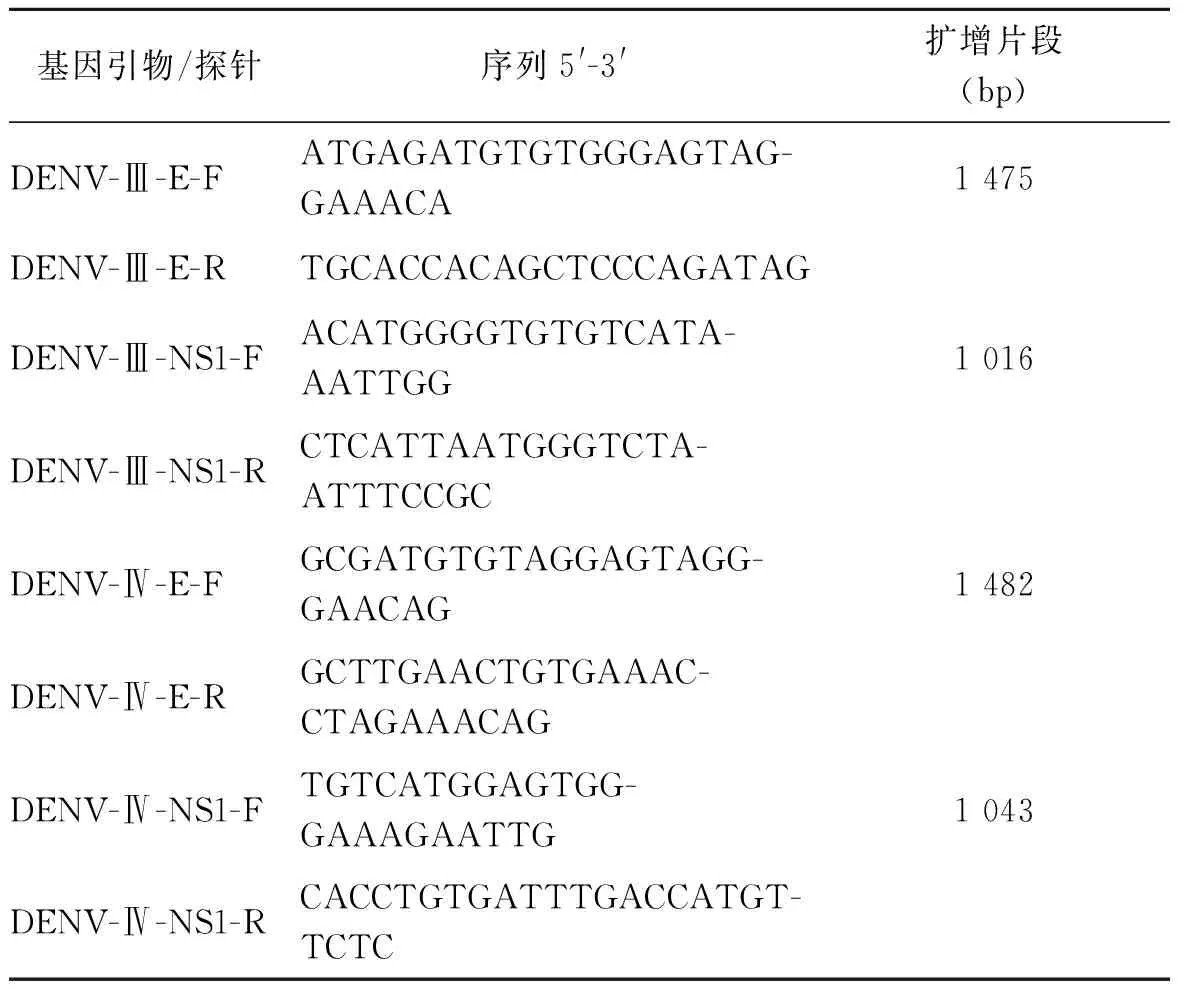
基因引物/探针序列5'-3'扩增片段(bp)DENV-Ⅲ-E-FATGAGATGTGTGGGAGTAG-GAAACA1 475DENV-Ⅲ-E-RTGCACCACAGCTCCCAGATAGDENV-Ⅲ-NS1-FACATGGGGTGTGTCATA-AATTGG1 016DENV-Ⅲ-NS1-RCTCATTAATGGGTCTA-ATTTCCGCDENV-Ⅳ-E-FGCGATGTGTAGGAGTAGG-GAACAG1 482DENV-Ⅳ-E-RGCTTGAACTGTGAAAC-CTAGAAACAGDENV-Ⅳ-NS1-FTGTCATGGAGTGG-GAAAGAATTG1 043DENV-Ⅳ-NS1-RCACCTGTGATTTGACCATGT-TCTC
1.8E基因和NS1基因PCR扩增产物的序列分析
PCR产物经琼脂糖电泳后,用无菌刀片切下特异性目的条带,胶回收纯化DNA,测量纯化后的DNA浓度并通过琼脂糖凝胶电泳检测DNA模板的质量,进行测序反应;测序反应后利用96孔板离心机进行纯化,去除反应产物中的dNTP、ddNTP和盐,得到DNA测序反应产物后经DNA测序仪自动测序并进行数据分析。
1.9基因序列的同源性和进化分析 利用NCBI BLASTn对GenBank基因数据库进行同源性检索,并从GenBank下载世界上其他地方流行的登革病毒基因序列,用Clustalx进行同源性比较,并用MEGA5.0构建Neighbor-Joining进化树,模型采用Kimura2-Parame-ter model,Bootstrap值设定为1000。用DNAMAN5.2.2对NS1序列进行翻译,并分别进行DENV 1-4、DENV-3和DENV-4分离株NS1基因的氨基酸序列比对。
2 结 果
2.1DENV-3和DENV-4分离鉴定及E/NS1基因PCR扩增 用C6/36细胞对8份血清样本进行分离培养,在接种病毒的第4 d,7份C6/36细胞出现细胞肿胀、圆亮、脱落和空泡等病变,见图1A-B。收集出现病变的C6/36细胞第4 d的细胞培养上清液,并进行FQ-PCR扩增,进行分型鉴定,见图1C-D。结果显示,成功分离到5株DENV-3和2株DENV-4,将成功分离的病毒依次命名为:SZ2016/1/DV-3、SZ2016/2/DV-3、SZ2016/3/DV-3、SZ2016/4/DV-3、SZ2016/5/DV-3、SZ2015/6/DV-4、SZ2015/7/DV-4。将成功分离的5份DENV-3病毒和2株DENV-4病毒分别进行E基因和NS1基因PCR扩增,7份病毒PCR扩增产物电泳均在1 000-2 000 bp之间出现明显目的条带,与预期片段位置一致,见图1E-F。经测序及序列Blast验证,7份病毒E基因和NS1基因成功扩增。
2.2DENV-3和DENV-4的E基因和NS1序列及其基因进化分析 利用NCBI BLASTn对5株DENV-3分离株和2株DENV-4 E基因序列进行同源性检测分析结果显示,与DENV-3分离株相似性最高(99%)的毒株主要是印度尼西亚2010和2015年分离株、菲律宾2015年分离株。与DENV-4分离株相似性最高(99%)的毒株主要是菲律宾2013年分离株、印度尼西亚2010分离株、意大利2009年分离株。将5株DENV-3分离株和2株DENV-4的E基因与基因库中下载的世界其他流行区分离株的序列相比对,并绘制基因系统进化树,见图2。

图2 登革病毒Ⅰ、Ⅱ、Ⅲ和Ⅳ型E基因系统进化树分析Fig.2 Dengue virus Ⅰ, Ⅱ, Ⅲ and Ⅳ E gene system evolutionary tree analysis
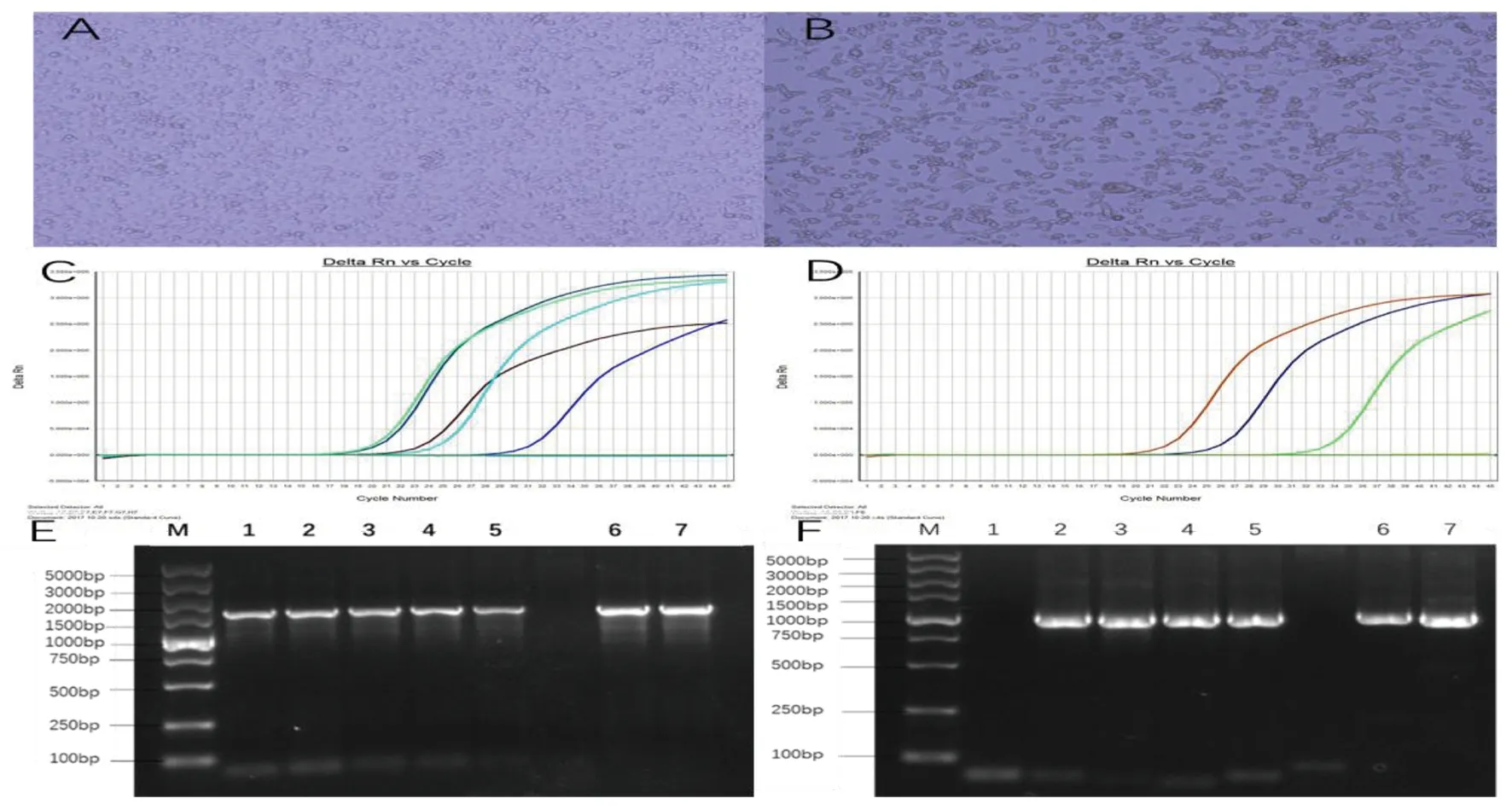
A:未接种DENV的C6/36细胞;B:接种DENV的C6/36细胞; C:DENV-3分型鉴定,依次是阳性对照、SZ2016/1/DV-3、SZ2016/2/DV-3、SZ2016/3/DV-3、SZ2016/4/DV-3、SZ2016/5/DV-3;D: DENV-4分型鉴定,依次是阳性对照、SZ2015/6/DV-4、SZ2015/7/DV-4; E:E基因PCR扩增结果,F: NS1基因PCR扩增结果1:SZ2016/1/DV-3;2:SZ2016/2/DV-3;3:SZ2016/3/DV-3;4:SZ2016/4/DV-3;5:SZ2016/5/DV-3;6:SZ2015/6/DV-4;7:SZ2015/7/DV-4图1 C6/36细胞分离鉴定及E/NS1基因PCR扩增结果Fig.1 The results of DENV were cultured with c6/36 cells and Dengue Ⅲ, Ⅳ virus PCR amplification
DENV1-4 E基因进化树显示,4种血清型分别在不同的分支上,血清型间核甘酸序列同源性在80%左右,同型血清型间的核苷酸同源性均在90% 以上。DENV-1和DENV-3同在一个大分支上,DENV-2和DENV-4同在一个大分支上。SZ2016/4/DV-3与新加坡2010年分离株SG(EHI)D3/34473Y10、印度尼西亚2009年分离株0907a在同一个分支上;SZ2016/5/DV-3与印度尼西亚2010年分离株1008a、1009a和2013年分离株(080)在同一分支;SZ2016/3/DV-3与印度尼西亚2015年分离株D3/Hu/niid17和WGY-031在同一分支;SZ2016/2/DV-3与深圳DENV-3分离株与菲律宾2015年分离株Philippines2015和澳大利亚2006年分离株Townsville在同一个分支。SZ2016/6/DV-4与意大利2015年分离株DENV4-12489和菲律宾2015年分离株DENV4-15983在同一分支;SZ2016/7/DV-4与印度2010年分离株VCRC/DEN4/01/10、斯里兰卡2012分离株SL2590 G、巴基斯坦2009年分离株0907aTw在同一分支。
DENV 1-4 NS1基因氨基酸序列比对结果显示,所选4株不同血清型的病毒株氨基酸相似性为77.69%。4株DENV-3深圳分离株间NS1相似性为92.75%,见图3、4、5。2株DENV-4深圳分离株间NS1相似性为94.94%。同E基因序列相似,4种血清型间NS1氨基酸相似性比同型血清型间氨基酸相似性小。图中蓝色显示的氨基酸序列为不同病毒株的共有序列,4个不同血清型的登革热NS1抗原存在5-7个氨基酸保守区域,为高度保守区。DENV-3和DENV-4 NS1基因氨基酸序列比对结果显示,NS1氨基酸序列在同一个血清型间存在个别氨基酸变异。
3 讨 论
近几年来,DENV-1为广东省主要流行血清型,其次为DENV-2血清型,DENV-3和 DENV-4均为散发病例[7],但在2010年秋季,广东省广州市发生了DENV的本地暴发事件,致病毒株被确定为DENV-4[8]。深圳作为经济特区,经济贸易频发,人口流动大,增加了登革病毒输入的可能性,且深圳属于沿海城市,气候温暖潮湿,适宜白纹伊蚊和埃及伊蚊的孳生,而且登革病毒还可通过轻症病例和隐性感染者输入,一旦病例输入未能及时发现并识别,极易造成疫情蔓延[9]。
登革病毒是RNA病毒,基因组易发生变异。登革病毒基因组全长约10 700核苷酸序列,编码了3 411个氨基酸。其中E基因含1 485个碱基,编码495个氨基酸,包含促进病毒结合和进入易感细胞的位点,其突变可能会影响病毒介导的膜融合和病毒毒力,可诱导保护性中和抗体[10]。也有实验表明,E蛋白氨基酸序列的改变将增强病毒与单核巨噬细胞的吸附,进而引起登革热/登革热出血热 的发生[11]。NS1基因含有1 056个碱基,编码352个氨基酸,具有强烈的免疫原性,在患者感染急性期血液中含量较高[12],刺激机体产生高滴度保护性抗体,在病毒感染过程中具有重要作用。Gong Cheng通过对不同年代寨卡毒株的研究发现,亚洲系寨卡病毒非结构蛋白NS1上的一个氨基酸位点发生了突变,导致NS1蛋白的分泌能力增强,使得病毒可以更高效的感染蚊虫,进而导致蚊虫的病毒感染率和传播率大幅上升,这可能是造成寨卡病毒的大范围流行的原因[13]。NS1蛋白的C末端缺失可能为登革热疫苗的发展提供了可能的策略[14],也可以不同菌株的共有高度保守序列作为抗原表位研制疫苗。因此本研究选择E基因和NS1基因进行序列分析,为下一步研究提供其分子病毒学特征。
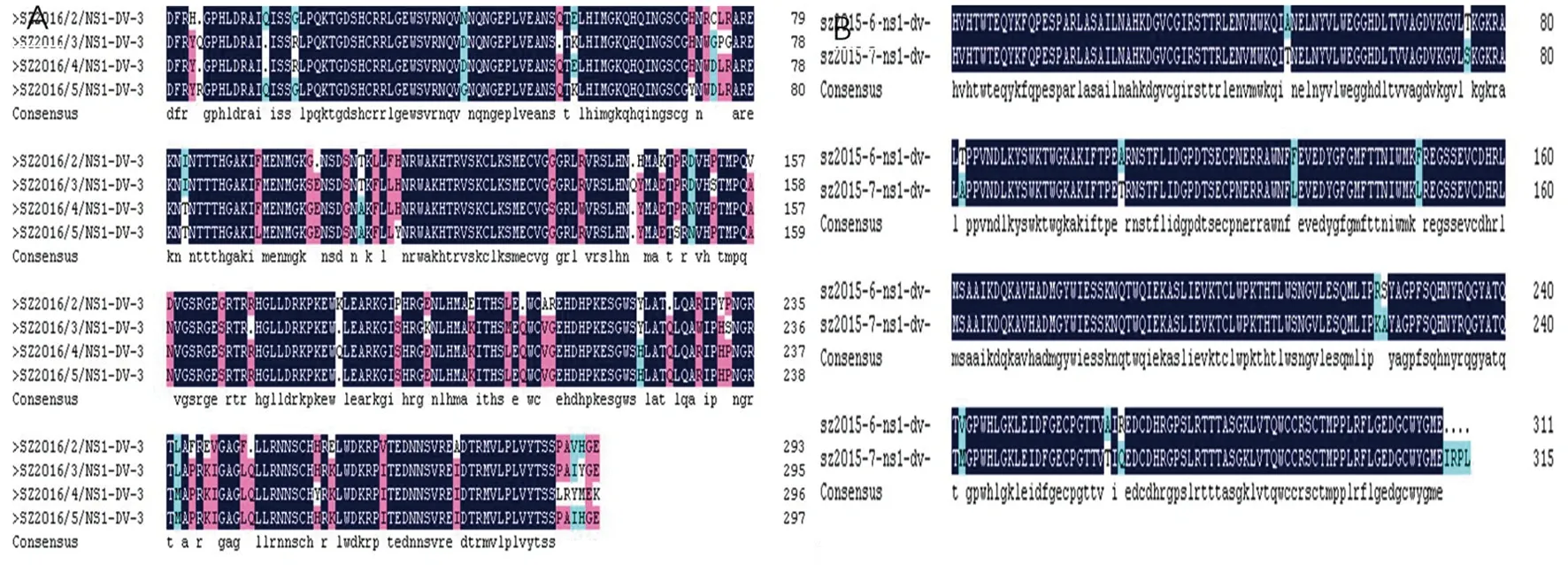
A: 深圳分离株DENV-3 NS1氨基酸序列比对B: 深圳分离株DENV-4 NS1氨基酸序列比对A: The amino acid sequence of DENV-3 NS1 was compared in Shenzhen B: The amino acid sequence of DENV-4 NS1 was compared in Shenzhen图4 深圳分离株DENV3-4 NS1氨基酸序列比对Fig.4 The amino acid sequence of DENV3-4 NS1 was compared in Shenzhen
E基因序列进化树显示,深圳DENV-3和 DENV-4分离株均在不同的小分支上,深圳登革病毒3型4型的散发之间并无直接联系。DENV-3和 DENV-4分离株显示与印度尼西亚、菲律宾、新加坡、斯里兰卡有较高的同源性,表明深圳登革病毒3型4型很有可能是由输入性病例引起。深圳分离株DENV-3和 DENV-4的 E基因和NS1基因序列同源性均超过90%,且核苷酸突变具有一定的随机性。4个不同血清型的登革热NS1抗原存在的5-7个氨基酸保守区域。本研究采用分子流行病学方法对DENV株的分布和进化进行监测,从登革热病例中分离出的DENV-3和 DENV-4毒株及其基因组序列数据库将有助于更好了解登革热的扩张和遗传进化,为了解病毒差异、其地方性分布和疫苗开发提供数据[15]。

