MR导引聚焦超声术姑息性治疗骨转移瘤疼痛近期效果和安全性初步研究
王升平, 孙志荣, 信 超, 杜春春, 许立超, 顾雅佳, 李文涛, 彭卫军
骨是仅次于肺和肝脏的恶性肿瘤常见转移器官之一[1]。随着医疗进步,越来越多骨转移患者生存期延长。骨转移瘤疼痛是癌痛最常见原因[2],而越来越多骨转移瘤患者带病生存,因此提高患者生活质量成为一项重大挑战。MR导引聚焦超声术(magnetic resonanceguidedfocusedultrasoundsurgery,MRgFUS)作为一种新的无创手段,已有报道用于疼痛性转移性骨肿瘤姑息性治疗,2012年获美国食品药品管理局(FDA)批准应用于临床[3-8]。本研究就复旦大学附属肿瘤医院2014年11月至2015年5月采用MRgFUS姑息性治疗的21例骨转移瘤疼痛患者近期效果和安全性作一报道。
1 材料与方法
1.1 患者入组和排除标准
本研究获得复旦大学附属肿瘤医院伦理委员会批准(编号:1404134-16-1408)。所有患者均被告知治疗相关获益和风险,并均在术前签署了知情同意书。患者入组标准:①病理证实恶性实体肿瘤,骨转移瘤临床和影像学诊断明确;②骨转移瘤病灶位于肋骨、四肢(包括关节)、骨盆、肩关节及第3腰椎(含)以下椎体后部,病灶在CT或非增强MR上清晰可见;③疼痛部位可识别,靶病灶疼痛数字评价量表(NRS)评分≥4分,且拟治疗靶病灶NRS评分比其它部位评分>2分;④疼痛程度稳定,服用或未服用止痛药;⑤拒绝放疗或无法放疗,近2个月未接受过放疗和/或化疗;⑥预期生存期>3个月;⑦年龄>18岁,自愿并同意参加本研究。排除标准:①疼痛性病变数>5个;②最近2周内新开始进行旨在缓解疼痛的化疗或放疗;③预计生存期<3个月;④伴有不稳定性心脏病或活动性感染疾病等严重疾病;⑤骨折风险评分>7;⑥Karnofsky行为状态评分(KPS)<60;⑦无法完成 MR检查,如幽闭恐惧症、体内有金属植入物、既往有对比剂过敏史。
1.2 MRgFUS方法
采用美国GE公司Signa HDX 3.0T型MR扫描仪,以色列InSightec公司ExAblate 2100型MRgFUS治疗系统、SET000016型治疗附件包、ASM000830型/ASM000352-AA型治疗胶垫(根据病灶部位选用)进行手术。术前1个月内CT检查,明确病灶解剖结构、性质、范围及与毗邻脏器关系;术前1周内行血常规、血生化、凝血功能及心电图等检查;术前6 h禁食、水;术前2 h治疗区域备皮,常规留置导尿管,建立静脉通路。治疗前及随访时,患者填写NRS、简明疼痛问卷-生存质量量表(BPI-QOL)和KPS。
手术开始前,在患者体表标记疼痛部位,根据标记摆放患者于合适体位,使其病灶最大横截面位于超声换能器正上方,且尽可能垂直于声束路径方向,从而保证声束最大范围覆盖靶区病灶;体位摆放后束带固定患者,予以毛毯覆盖保暖,给予患者治疗时紧急制动按钮,告知术中感觉不适可随时主动停止治疗。
先行在横断面、矢状位和冠状位3个方向以 T2加权序列(需要时采用其它序列)进行MR平扫,基于获得的MR图像三维描绘靶病灶,确保声束路径上无神经、钙化后确定治疗计划;予患者静脉麻醉,待充分镇静后开启靶病灶逐个区域聚焦超声消融。整个手术过程中保持心率和氧分压(pO2)监测,MRgFUS系统每次消融后2 s会自动给出一幅回波平面成像(echo planar imaging,EPI)序列图像和温度图,用于实时监控治疗范围和目标区域温度变化,保证治疗安全性和有效性;每次消融后系统会有45~90 s冷却间歇,以保证治疗区域安全。治疗过程中操作医师依据实时MR图像和温度时间曲线调整治疗方案,如聚焦超声能量、聚焦点位置和角度等,以保证治疗靶病灶温度在65~85℃并持续5 s以上,直至完成全部目标区域治疗。
术后即刻行横断位T1加权成像(T1WI)平扫、脂肪抑制T2加权成像(T2WI)平扫和T1WI对比增强(CE)扫描,对比剂使用钆喷酸葡胺(商品名Magnevist,上海拜耳先灵公司),注射剂量15 mL,注射速率1.5 mL/s;将CE-T1WI图像减去T1WI图像获得减影图像,计算对比剂非灌注体积比率(nonperfused volume ratio,NPVR),评价靶区血供阻断情况(图1);将患者护送至恢复区,度过观察期(6 h)后出院。
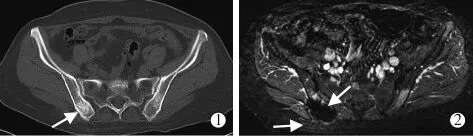
图1 右髂骨转移MRgFUS术前及术后影像学表现
1.3 疗效与安全性评价
术前1周和术后1周、1个月、2个月、3个月,对患者治疗区作NRS评分,术后3个月NRS评分下降>2分为止痛有效;记录患者与疼痛相关BPIQOL评分(日常活动、情绪、行走能力、正常工作、社会关系、睡眠、兴趣爱好等7个项目评分的总和,每个项目为0~10分,其中0表示该项目不受疼痛影响,10表示受疼痛影响最严重);记录患者术前周1和术后1周、3个月 KPS评分,评价患者总体身体健康状态。
根据美国国立癌症研究所不良事件通用术语标准(NCI-CTC)中不良反应分级,记录手术首日至术后3个月时手术相关不良反应。
1.4 统计学方法
采用Shapiro-Wilk法检验计量资料分布,符合正态分布的以均数±标准差(±s)表示,不符合正态分布的以中位数(四分位间距)表示;配对样本t检验(正太分布数据)或Wilconxon配对秩和检验(非正太分布数据)比较术后和术前各个疗效评分差异。所有统计分析和统计作图均采用3.4.3版本R软件,P<0.05差异有统计学意义。
2 结果
患者一般情况见表1。疗效评价显示,患者术前1周,术后1周、1个月、2个月、3个月NRS评分分别为 7.7±1.6、3.6±2.6、3.9±3.2、4.3±3.3、3.7±2.7,术后分别有16例、14例、12例、14例较术前下降≥2分(P<0.001)(表 2),表明止痛有效,生活质量未恶化,且能持续3个月;术前1周,术后1周、1个月、2个月、3个月BPI-QOL评分差异均无统计学意义(P>0.05),术前 1周,术后 1周、3个月KPS评分差异均无统计学意义(P>0.05)(表3),表明患者术后3个月内身体状态平稳,健康状况未恶化。

表1 患者一般情况 n=21

表2 手术前后患者NRS比较

表3 手术前后患者BPI-QOL和KPS评分比较
术后1例左第10后肋转移患者出现皮肤1度灼伤,最大径约2 cm,经对症处理1 d后症状减轻;1例右骶骨转移患者术后1 d出现大小便功能受损,经对症处理后逐步好转,2 d后功能恢复;1例右第6后肋转移患者术后1周出现低热,随访1周后症状消失。术后2个月3例患者死亡,死因为肿瘤进展导致多脏器衰竭,与MRgFUS治疗无相关性。
研究期间共有15例患者应用止痛药物,其中3例同时用2种阿片类药物。6例报告增加了止痛药用量,NRS下降≥2患者中2例于术后1个月因其它脏器转移疼痛开始服止痛药,2例于术后2个月因其它脏器转移疼痛开始服止痛药,1例因肿瘤进展于术后3个月开始服止痛药;NRS下降<2患者中1例于术后3个月因骨转移疼痛加剧开始增服止痛药。
3 讨论
本研究显示,MRgFUS缓解骨转移瘤疼痛的近期效果确切,与国内外类似研究结果[5-8]相当。顾坚骏等[7]采用MRgFUS治疗23例骨转移瘤疼痛患者,结果显示术后NRS下降明显,BPI-QOL评分在术后3个月明显改善。熊海芮等[8]采用MRgFUS治疗14例骨转移瘤疼痛患者,结果显示术后NRS下降明显,9例患者NRS下降≥2分,达到预期止痛效果。Liberman等[6]对25例骨转移瘤疼痛患者采用 MRgFUS治疗,获得72%疼痛改善率,且有67%患者减少了止痛药应用。本研究显示患者生活质量评分在手术前后无显著差异,但生活质量并未进行性恶化,术后各随访时间点BPI-QOL评分与术前基线水平相比差异无显著统计学意义,这与熊海芮等[8]报道类似,与顾坚骏等[7]研究结果不同(术后3个月BPI-QOL评分明显改善)。本研究显示,MRgFUS姑息性缓解骨转移瘤疼痛的近期效果确切,但对晚期肿瘤患者整体生活质量改善的贡献目前尚不明确。虽然MRgFUS短期内能缓解部分患者骨转移所致疼痛,从而提高生活质量,但肿瘤进展导致其它部位骨转移或其它脏器转移造成疼痛加剧或出现新的疼痛,会抵消MRgFUS治疗带来的疼痛缓解获益。未来需要开展全身治疗与MRgFUS治疗有效结合研究,以期有效缓解局部骨转移瘤疼痛的同时还能促进全身肿瘤遏制,从而使患者能最大获益。
本组发生手术相关不良反应共3例,均很轻微,对症处理或随访后短时间内恢复。1例术区皮肤轻度灼伤,考虑是患者在治疗过程中移动,皮肤离开水体导致皮肤和声束之间短暂出现空气所致,因此术前患者教育和术中沟通很重要,可使患者充分理解治疗过程,消除恐惧,信任治疗医师并获得足够的心理暗示,从而能尽可能配合治疗,避免出现身体移动或频繁终止操作等情况发生;1例治疗后大小便功能受损,考虑是治疗引起局部软组织水肿压迫骶丛神经所致,经过神经营养等对症治疗后恢复,故提醒治疗靠近神经区域时,需仔细设计治疗方案,小剂量多次聚焦可能较为安全有效;1例术后出现低热,考虑可能是肿瘤进展所致吸收热,未予处理,1周后症状解除。本组共有3例患者术后2个月死亡,死因为肿瘤进展导致多脏器衰竭,经详细评估均为非MRgFUS治疗相关死亡。这也提示,尽管MRgFUS安全性较高,但术前详细评估患者病情进展情况、实验室检验及影像学资料是必要的。重视术前与患者沟通,详细告知治疗相关每一细节和术中、术后可能出现的反应,充分与麻醉科医师沟通,术前、术中详细分析治疗靶区MR图像,均对保证治疗安全具有重要作用。
MRgFUS是一项创新性安全无创技术[9-12]。骨皮质对超声能量吸收是软组织的50倍,MRgFUS通过聚焦超声能量在骨皮质聚集转化为热效应,消融转移病变处骨膜上神经末梢,达到缓解疼痛目的[9]。其实,MRgFUS和超声导引高强度聚焦超声(ultrasound guided high intensity focused ultrasound,USgHIFU)均属无创超声热消融技术。超声成像装置具备时间分辨率高、成本低等优势,目前USgHIFU已广泛应用于子宫肌瘤[13-14]、肝脏肿瘤[15]等领域,但其仍无法提供治疗温度等相关信息。MRgFUS与USgHIFU的主要区别在于影像导引方式不同,MR可提供三维高分辨率图像,更加精确地描绘肿瘤;同时,基于质子共振频率理论的MR测温算法可通过提供组织温度变化的量化信息监测和控制治疗过程,实现能量沉积反馈或闭环控制,从而能让治疗医师既能完整消融病灶,又尽力保证治疗区域外组织安全[11];此外,MRgFUS还能即刻评估治疗反应,并允许重复治疗。MRgFUS相比USgHIFU的另一区别,是其应用多元相控阵超声探头,通过机械和电调制技术调整焦点位置和聚焦方向,以避开敏感组织,确保治疗精准安全。这些特征组合——治疗前高分辨率目标显像、治疗期间实时测温及治疗后立即验证有效治疗区——使MR导引成为聚焦超声治疗骨转移过程中极具吸引力的组成部分[16]。
本研究尚存局限性:①单臂小样本量研究,未设对照组(比如放疗),期待以后开展大样本多中心双盲随机对照研究进一步验证;②未对其系统性抗肿瘤治疗作用进行评估,有待将来进一步完善研究;③未对疗效预测标记物进行分析,需寻找有效的影像标记物进一步探讨。
综上所述,基于无创性、可重复性等优点,MRgFUS有望成为缓解骨转移性疼痛的一种有前途的替代手段。此外,三维MR成像可视化具有制定精确治疗计划的能力,利用MR测温技术连续绘制被治疗组织温度图,可实时监测靶区热损伤,治疗后还能即刻评估疗效。MRgFUS缓解骨转移瘤疼痛近期疗效确切,远期疗效有待进一步研究。