不同标本巨细胞病毒 DNA 检测在新生儿巨细胞感染中的应用
付 慧
(河南省儿童医院,河南 郑州 450003)
巨细胞病毒(HCMV)是导致患者出现巨细胞病毒感染的主要原因,主要分为先天性感染和后天性感染。孕妇在妊娠期间出现巨细胞感染时,其临床体征及症状并不明显,为隐匿性感染,少数会出现死胎、早产、流产以及胎儿发育迟缓[1]。新生儿免疫机制并不成熟,在出现巨细胞感染后,会增加脑膜脑炎、肺炎、智力下降、肝炎以及先天性耳聋等的发生概率[2]。因此,加强新生儿巨细胞感染患者的早期诊断和治疗十分必要。本研究对不同标本巨细胞病毒DNA 检测在新生儿巨细胞感染中的应用价值作一分析,报告如下。
1 资料与方法
1.1 基本资料 选取新生儿巨细胞感染患者50例,时间为2016年7月20日至2017年5月30日,年龄0~28 d,采集其尿液、淋巴细胞、母乳中的相关标本进行巨细胞病毒DNA检测,同时对其血清标本进行巨细胞病毒的IgM检测。
1.2 方法
1.2.1 淋巴细胞HCMV-DNA检测 采用FQ-PCR法(荧光定量PCR法)进行检测,将EDTA抗凝全血 1 mL加于含有生理盐水1 mL的离心管中,之后轻摇混匀,将混合液沿试管壁加于含淋巴细胞分离液1 mL的试管中,不能混匀、震荡,以2000 r/min的速度离心20 min,之后取淋巴细胞层再次进行离心处理(12 000 r/min,时间为5 min),取沉淀物,将DNA提取液50 μg加入沉淀物中,并打匀,离心数秒,100 ℃保温10 min,离心处理(12 000 r/min,时间为5 min),取2 μL上清进行PCR扩增。
1.2.2 尿液HCMV-DNA检测 采用FQ-PCR法(荧光定量PCR法)进行检测,充分混匀尿液样本,将100 μL样本加于含DNA浓缩液100 μL离心管中,充分混匀,并进行离心处理(12 000 r/min,时间10 min),将沉淀物加于DNA提取液20 μL中充分打匀,离心数秒,100 ℃保温10 min,离心处理(12 000 r/min,时间5 min),取2 μL上清进行PCR扩增。
1.2.3 乳汁HCMV-DNA检测 采用FQ-PCR法(荧光定量PCR法)进行检测,将1 mL乳汁加于离心管中,进行离心处理(12 000 r/min,时间为5 min),将沉淀物加于DNA提取液50 μL中充分打匀,离心数秒,100 ℃保温10 min,离心处理(12 000 r/min,时间为5 min),取2 μL上清进行PCR扩增。
1.2.4 血清HCMV-IgM检测 采用化学免疫发光法进行检测,采集其静脉血,加于促凝管中,血液样本在凝固后进行离心处理,取上清液进行相应检测。
1.3 观察指标 对不同标本HCMV-DNA的检测结果以及血清的HCMV-IgM检测结果进行观察分析。其中HCMV-DNA的增长曲线为S型,且定量结果>500 copies/mL则为阳性,其余为阴性;HCMV-IgM≥18 U/mL为阳性,<18 U/mL为阴性。
1.4 数据处理 研究数据均录入SPSS 22.00软件进行统计学处理,不同标本HCMV-DNA以及血清的HCMV-IgM检测阳性情况等计数资料采用χ2检验。P<0.05表示差异有统计学意义。
2 结 果
联合检测的阳性率显著性高于尿液、淋巴细胞、母乳细胞的HCMV-DNA以及血清HCMV-IgM的阳性率,尿液标本中HCMV-DNA检测阳性率显著性高于淋巴细胞、母乳细胞的HCMV-DNA以及血清HCMV-IgM的阳性率(P<0.05)。详见表1。
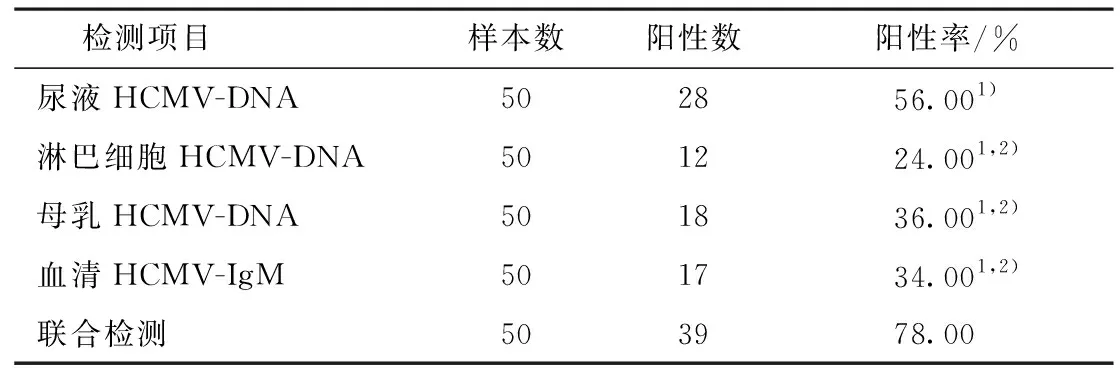
表1 各项检测阳性情况比较
注:1)与联合检测比较P<0.05;2)与尿液HCMV-DNA比较P<0.05
3 讨 论
HCMV是常见的先天性感染病毒,人体在受到HCMV感染后的3~5 d后会出现IgM抗体,其抗体的阳性是对其感染进行早期诊断的主要指标,表明患者处于活动性的感染状态,但是IgM抗体释放量的多少会受到患者的免疫反应状态、HCMV感染量等多种因素的影响,使得临床以IgM抗体作为患者疾病诊断的指标存在一定的局限性[3]。
HCMV是DNA病毒(双链)的一种,属于疱疹病毒属,对组织培养细胞或宿主有着较为明显的特异性。HCMV可以在人体的平滑肌、上皮、内皮等多种细胞中存在,其主要的靶器官包括胰、肾、肺、肝等[4]。巨细胞感染患者的唯一传染源是CMV,病毒可以从患者的宫颈、尿液、乳汁、血液、精液、阴道分泌物等多个部位排出,传染性较高。
HCMV感染具有多部位、间歇性排毒的特点,不同患者的个体差异以及感染部位存在一定的差异性,且其不同标本对病毒的释放量也存在一定的差异,因此,临床为新生儿巨细胞感染患者实施检测时,应将尿液、淋巴细胞的HCMV-DNA与其血清HCMV-IgM进行联合检测,若受到相关条件的限制不能联合进行检测,则应首选尿液HCMV-DNA检测,以提高患者的疾病检出率,为临床治疗提供依据。

