聚乙烯醇-羧甲基纤维素钠复合膜预防血管开放术后黏连的实验研究
何楠,龙安妮,胡畅,刘思博,王迁,邱菊,陈东,李雷
近20年来,心血管外科技术飞速发展,一些较高难度的手术例数与日俱增,同时再次手术的比率亦有增多的趋势[1]。然而,首次手术区域组织黏连增加了再次手术解剖的难度、手术干预时间及组织损伤的风险。研究显示,血管周围黏连程度,也影响手术血管的通畅性[2-5]。物理屏障是临床上预防术后黏连最有效的方法,但目前尚无针对人体血管的防黏连产品,且市售材料不能满足血管开放手术所需的高标准及要求。研制一种针对血管手术的防黏连膜,并兼具生物相容性好、柔韧性佳、黏附性强、存留时间足够、可吸收、抗感染能力强的优势,势在必行[1]。聚乙烯醇(PVA)及羧甲基纤维素钠(CMC)这两种聚合物材料已经美国食品与药物管理局(FDA)批准用于人体,均具有良好的水溶性和组织相容性。PVA既可制成黏度较大的水凝胶,也可做成软膏于创伤处成膜而发挥其他药物作用,CMC则具备防黏连和一定的止血效果,其干预黏连的机制主要是降低成纤维细胞的活性以及机械隔离作用[6,7]。通过对两种材料的复合与改性,有望生成一种新型的较理想的血管外科术后防黏连产品。本文采用新西兰大白兔动物模型,通过皮内刺激实验、动物实验等对PVA-CMC复合膜预防血管术后黏连的安全性及有效性进行研究评价。
1 材料与方法
材料 :PVA-CMC复合膜(三层)规格为5 cm×5 cm,制备方法见后。新西兰大白兔:体重2.5 kg,不分雄雌。实验过程中对动物的处置符合2006年科技部《关于善待实验动物的指导性意见》的规定。
防黏连膜的制备及理化性质检测:(1)复合膜制备:中间凝胶膜层中PVA-1799:CMC以30 : 2的比例同时溶解于120份离子水中得到混合溶液,并以5 mg/ml的剂量加入塑形剂,将此混合溶液流延至玻璃培养皿中至厚度500 μm,然后冷冻-解冻过程循环三次后即制备完成。上下薄膜层中PVA-1788:CMC以2:1的比例同时溶解于离子水中得到混合溶液,以上述方法经过3次冷冻-解冻过程即可。将制作完成的复合膜成分放入环氧乙烷保鲜袋中行环氧乙烷灭菌,并在常温下保存备用。(2)厚度测定:将干态膜干燥至恒质量,千分尺测定膜的9个不同位置的厚度,取平均值为干态膜的厚度。将膜浸泡在蒸馏水中24 h,吸干其表面水分,如上同法测定并取平均值为湿态膜的厚度。(3)含水率测定:将膜浸泡在常温的蒸馏水中24 h,用滤纸吸干其表面的水分,从膜上均匀裁剪数个1.0 cm×1.0 cm的样品,并称质量取得平均值(w1)。将这些样品放于70℃的烘箱中烘干至恒质量,取平均值(w)。膜的含水率(%)=(w1-w)/w×100%。(4)溶胀比测定:将干态膜裁剪成直径为2.5 cm的圆片,浸泡在蒸馏水中溶胀24 h。用千分尺测量圆片的直径(φ)和干态及湿态膜(σ)的厚度。溶胀比。(5)力学性能测定:将膜裁剪成宽20 mm、夹持长度40 mm,通过电子拉力测试机以20 mm/min的拉伸速率测量其拉伸强度、断裂伸长率。(6)结构相容性表征:用超高分辨场发射扫描电镜JSM7401观测复合膜的表面形态结构并分析共混相容性。样品尺寸2.5 cm×2.5 cm,加速电压为3.0 kV。
细胞毒性实验:依据国家标准GB/T 16175-2008[8]进行测试,对PVA-CMC膜进行毒性分级。同时用显微镜观察法对细胞毒性反应进行综合评分。
皮内刺激实验:采用3只体重约2.5 kg的新西兰大白兔,按顺序进行生理盐水(背部最左)、生理盐水浸提液(背部最右)、芝麻油(脊正中线右侧)、芝麻油浸提液(脊正中线右侧)皮内注射,注射剂量为0.2 ml/每注射点,注射点之间间隔2 cm,共10个注射点。注射完成后在1 h、24 h、48 h和72 h时分别进行拍照,并观察注射的部位有无红斑或水肿等情况,按照皮内刺激反应记分系统进行评分,并计算原发性刺激指数(PII)。
动物颈动脉模型建立:新西兰白兔16只(体重2.5 kg,雌雄不限),将兔进行自身对照, 即一侧颈动脉PVA-CMC复合膜植入(实验组)和对侧颈动脉实施假手术(对照组)。于气管旁胸锁乳突肌深面,分离兔颈总动脉,小心游离颈总动脉周围组织,并摩擦使之明显渗血,注意保护伴行神经。将PVACMC三层膜裁剪成适合大小约15 mm×8 mm,置入并包裹一侧颈总动脉,用6-0 PROLENE缝线标记及固定其位置,于对侧颈部单纯游离颈总动脉,摩擦使之明显渗血后用6-0 PROLENE缝线标记其手术位置。
动物实验标本采集与观察:(1)大体观察:术后4周、12周分别处死实验兔各8只,肉眼观测术区颈动脉与周围组织黏连的程度,并行黏连程度分级:0级(无黏连)、Ⅰ级(黏连轻薄,分离不易出血)、Ⅱ级(中度黏连,需要一些锐性分离,这个过程导致中度出血)、Ⅲ级(黏连致密、弥漫,需要大量的锐性分离,容易出血)。(2)组织学观察:将兔双侧颈动脉与周围黏连最明显部位的组织一起取出,于10%甲醛固定48 h后石蜡包埋并切片,苏木精-伊红(HE)染色并封片。显微镜下观察血管与材料及周围组织的病理情况,微观黏连评分系统将组织炎症进行分级:0级(无炎症反应,未见炎性细胞)、Ⅰ级(轻度炎症反应,可见少量淋巴细胞和浆细胞、偶可见巨细胞)、Ⅱ级(中度炎症反应,可见嗜中性粒细胞、嗜酸性粒细胞、巨细胞)、Ⅲ级(许多炎性细胞,可见微小脓肿);同时再对组织周边纤维化反应进行分级:0级(无纤维化反应)、Ⅰ级(轻度、疏松、局限性纤维化)、Ⅱ级(中度纤维化,薄层局灶纤维结缔组织,纤维素沉积)、Ⅲ级(致密、厚层、弥漫性纤维化)。
统计学处理:采用SPSS 23.0统计软件进行分析。两组独立样本比较采用Mann-Whitney U检验,以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
16只实验兔术后精神、饮食、活动正常,均存活,切口愈合好,无红肿、渗出或窦道形成。取材前可见颈动脉周围组织无损伤。
2.2 复合膜的理化检测及生物相容性测试
理化检测:(1)厚度测定:干态膜厚度为(0.320±0.185) mm;湿态膜厚度为(0.819±0.210) mm。(2)含水率测定: 94.85%。(3)溶胀比测定:(3.22±0.21)%。(4)力学性能测定:干态膜拉伸 强度 为(27.19±2.43)MPa,断 裂伸 长率 为(84.5±4.7)%。湿态膜拉伸强度为(19.63±1.01)MPa,断裂伸长率为(97.2±8.0)%。(5)结构相容性表征:扫描电镜在放大倍数104下可见复合膜表面略粗糙,但完整、未见层次分离。
细胞毒性实验(MTT法):PVA-CMC膜1级细胞毒性。
皮内刺激实验:计算得出复合膜+生理盐水浸提液的原发刺激指数(PII)为0;复合膜+芝麻油浸提液PII最高值为0.27,平均PII值为0.17低于国家标准1.0的规定要求,可判定PVA-CMC复合膜无皮内刺激作用。
2.3 动物实验
颈动脉模型大体观察:术后4周、12周分别处死实验兔并取材,肉眼观察可见实验组(图1A)手术区域辨识度极高,膜与周围组织(气管、颈前肌群等)的黏连程度低,极少见纤细丝状黏连,膜的活动度高,可轻松与周围组织分离,暴露其包裹的颈动脉,过程未见出血。实验组4周取材的黏连程度评级分布如下:0级7例、Ⅰ级1例、Ⅱ级和Ⅲ级均0例;12周取材情况如下:0级8例,Ⅰ级、Ⅱ级和Ⅲ级均0例。肉眼观察对照组(图1B)血管与周围组织黏连致密、弥漫,难以分辨术区组织结构,需要大量的锐性分离,极易出血。对照组4周取材结果:0级、Ⅰ级均为0例,Ⅱ级2例,Ⅲ级6例;12周取材结果:0级、Ⅰ级均为0例,Ⅱ级1例,Ⅲ级7例。不论术后4周还是12周,对照组血管与周围组织的黏连程度均明显高于实验组,差异有统计学意义(P=0.0002)。同组内术后12周与术后4周的取材结果差异无统计学意义。
颈动脉模型组织学观察:对术区取材并行HE染色、封片,显微镜下观察组织周围的炎症反应及纤维囊化形成情况。术后4周,实验组复合膜周围少量中性粒细胞、淋巴细胞及多核巨细胞,少许纤维母细胞增生;对照组血管扩张充血,血管内皮无炎症浸润,周围脂肪组织中可见灶状细胞团,血管周围有一条细长、薄层局灶纤维结缔组织。术后12周,实验组复合膜膜片与相邻组织呈分离状态,由少量纤维条索包裹,未见炎性细胞,少许纤维组织增生(图1C);对照组血管扩张充血,血管内皮无炎症,血管周围可见一条致密、厚层、弥漫性纤维化组织(图1D)。就组织周围炎症反应程度而言,无论实验组还是对照组的术后4周及12周取材结果均是0级8例、其他0例,两组样本差异无统计学意义(P=1.000)。而颈动脉周围组织纤维化反应程度上,实验组4周取材结果为0级0例,Ⅰ级2例,Ⅱ级6例,Ⅲ级0例; 12周取材结果为0级0例,Ⅰ级4例,Ⅱ级4例,Ⅲ级0例;对照组4周取材结果为0级0例、Ⅰ级0例,Ⅱ级3例,Ⅲ级5例; 12周取材结果为0级0例,Ⅰ级0例,Ⅱ级2例,Ⅲ级6例。统计学分析显示,术后4周及12周对照组纤维化程度均明显强于实验组,差异有统计学意义(P=0.015,P=0.002)。
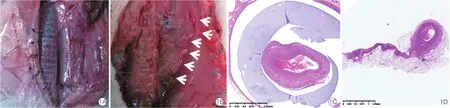
图1 颈动脉模型大体观察和组织学观察结果
3 讨论
血管开放手术后经常面临着二次甚至多次手术的需求。术后血管周围组织黏连为二次手术的安全性带来巨大挑战。另有研究表明,血管重塑与血管术后再狭窄相关,其机制包括外周组织源性平滑肌细胞通过炎症、黏连迁移至术区靶血管周边进而造成内膜增生[9,10]。由于血管结构及其自身搏动和受外力较多等特殊性,对防黏连材料的柔软性、粘附性及强韧性方面有更高的要求。到目前为止,仍没有一种理想的、价格适中且适用于血管的防黏连产品。国外虽然已有PVA-CMC复合凝胶材料完成Ⅱ期临床试验的安全性报告[11],但因为血管搏动及长期受外力的特性,其胶态无法为血管提供全周向防黏连效果。为降低其流动性而更好地适应于血管手术特殊要求,本研究所用的PVA-CMC防黏连材料设计成了粘附性强的复合膜状,分为中间凝胶膜层及上下薄膜层。理论上可以大大降低血管搏动及外部力量对手术血管的摩擦及轴向剪切力,保持全周向抗黏连能力的同时保护血管外膜结构。本研究表明,该复合膜柔软、强韧、黏附性好,有望成为开放性血管手术较为理想的防黏连材料。
已有研究提示随着时间进展,机体对于PVACMC复合膜免疫应答逐渐减弱[12],其组织相容性良好。本研究将复合膜植入实验兔颈动脉周边,以术后4周、12周为节点进行取材,是因为此时间已经超过了术后黏连发生的关键时期(1周)及黏连的完全成熟期(4~8周),便于观察复合膜对防止术后血管周围黏连的最终效果。实验通过肉眼观察和组织学观察均可显示复合膜包裹的血管周围组织黏连极少、纤维化程度小,且正因复合膜周围形成了非常薄的纤维囊腔,使之极易与周边组织分离,大大减少了二次手术解剖时可能出现的副损伤。术后12周,血管周围组织内的炎症及免疫应答基本消失殆尽,故此时观察两组术区均未见炎性细胞浸润,可解释实验组与对照组术区组织炎症反应程度一致这一结果。复合膜具有良好的抗纤维化、防黏连作用,作为植入体内的异物却未在术后较早期(4周)导致术区炎症反应,提示复合膜除了物理隔绝作用外,还可能存在一定的抗炎作用,推测其机制可能与该复合膜上下两层水溶性膜有关,该膜植入体内后最先发生水溶性膜的缓慢溶解,其中CMC成分被缓慢释放出来,CMC具有一定的防止感染和止血效果,其与血液接触时可将血液中水分溶胀产生黏胶状物,增强血液的浓度与粘性而降低了流速,形成粘性体后将毛细血管残端封闭,达到止血效果的同时减少了血液内炎症介质和炎性细胞的渗出,以及它们在创面区域的聚集。
本研究结果证实PVA-CMC复合膜符合国颁标准GB/T 16886对生物材料、医疗器械的生物学评价(等同国际标准IS010993)。初步在体实验证明具备较佳的血管手术后防黏连效果。用于制备该国产新型生物防黏连膜的原材料容易获得,适合大规模生产,其多种优势有望应用于血管手术中。除此之外,对于心脏及主动脉的二次手术,黏连重者需要更多的锐性分离,破裂出血、手术时间及麻醉风险增高[13],本研究所用的复合膜是否在其他外科手术中也能提供良好的防黏连效果,值得考证和期待。

