全胸腹主动脉置换术患者围术期神经损伤标志物及炎性因子的浓度变化
董秀华,王嵘,金沐,杨彦伟,王岳锋,马月华,卢家凯,程卫平
全胸腹主动脉置换术(TAAAR)一般需要将左锁骨下动脉开口至髂动脉分叉之间的胸腹主动脉采用人工血管完全置换,术中需要实施高位胸主动脉阻断或深低温停循环,并伴有脊髓血供破坏,术中及术后不可避免发生脊髓缺血以及再灌注损伤,严重者术后可以发生截瘫或轻瘫[1,2]。本研究观察TAAAR患者围术期神经损伤标志物及炎性因子的浓度变化。
1 资料与方法
一般资料:本研究经医院伦理委员会批准,术前均签署知情同意书。选取我院2014-12至2016-07行TAAAR的胸腹主动脉瘤患者45例,男性26例,女性19例,年龄(37±9)岁,身高(176±8)cm,体重(70±14)kg。其中合并马凡综合征11例,高血压18例,糖尿病2例。
麻醉方法:采用舒芬太尼复合咪达唑仑为主的静脉复合麻醉,穿刺右桡动脉及右足背动脉(或股动脉)监测上下肢血压,双腔管气管插管。诱导后行第4、5腰椎间脑脊液穿刺置管,术中及术后如果脑脊液压力 >10 mmHg(1mmHg=0.133 kPa),即开启脑脊液引流。术中行单肺通气,主动脉近端阻断时行控制性降压。术中维持桡动脉收缩压95~130 mmHg, 心 率 70~100 次 /min, 中 心 静 脉 压 6~10 mmHg,维持脑电双频指数(BIS)值40~60之间(深低温停循环期间除外)。
手术方法:患者右侧卧位胸腹联合切口。首先采用4分支人工血管的一个分支与左髂总动脉行端侧吻合。全身肝素化后,常温高位阻断主动脉近端。如果主动脉近端游离困难,无法阻断,则建立体外循环在深低温停循环下行主动脉近端吻合,或体外循环辅助下行主动脉近端阻断。采用4分支人工血管主干与主动脉近端吻合,排气后开放主动脉近端,建立胸主动脉-左髂总动脉分流。之后人工血管依次吻合肋间动脉、腹腔干、肠系膜上动脉、左右肾动脉以及右髂总动脉,完成TAAAR。
观察指标:分别于切皮前、术毕、术后第1d、术后第2d抽取脑脊液标本,置于-70℃冰箱保存。采用酶联免疫吸附(ELISA)法检测脑脊液中下列神经损伤标志物及炎性因子的浓度变化:神经元特异性烯醇化酶(NSE)、S100β蛋白、胶质纤维酸性蛋白(GFAP)、离子钙接头蛋白1(Iba1)、髓鞘碱性蛋白(MBP)、白介素10(IL-10)、基质金属蛋白酶9(MMP-9)。
统计学方法: 采用SPSS19.0统计学软件进行分析。正态分布资料以均数±标准差(±s)表示,非正态分布资料以中位数表示,组内比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
45例患者手术结果:37例(82.2%)患者采用常温非体外循环下胸腹主动脉分段阻断下手术,8例采用体外循环下手术(2例采用并行体外循环下手术,6例深低温停循环下手术)。其中38例(84.4%)实施了肋间动脉重建,7例因肋间动脉细小或闭塞未实施肋间动脉重建。手术时间(573±129)min,体外循环时间(204±89)min,停循环时间(17±4)min,近端胸主动脉阻断时间(15.4±3.9)min,术后监护病房(ICU)停留时间1.7(0.5~14.8)d。术后脑脊液压力(11.4±3.4)mmHg。
45例患者围术期脑脊液神经损伤标志物及炎性因子的浓度变化(表1):围术期脑脊液NSE、S100β蛋白、GFAP、IL-10及MMP-9水平均在术毕时达到浓度峰值(P<0.01)。与切皮前比较,NSE、S100β蛋白、GFAP、IL-10水平在术毕时及术后第1 d升高,MMP-9水平仅在术毕时升高,差异均有统计学差异(P均< 0.05)。各时间点的Iba1及MBP水平在围术期差异无统计学意义(P>0.05)。
表1 45例患者围术期脑脊液神经损伤标志物及炎性因子的浓度变化(±s)
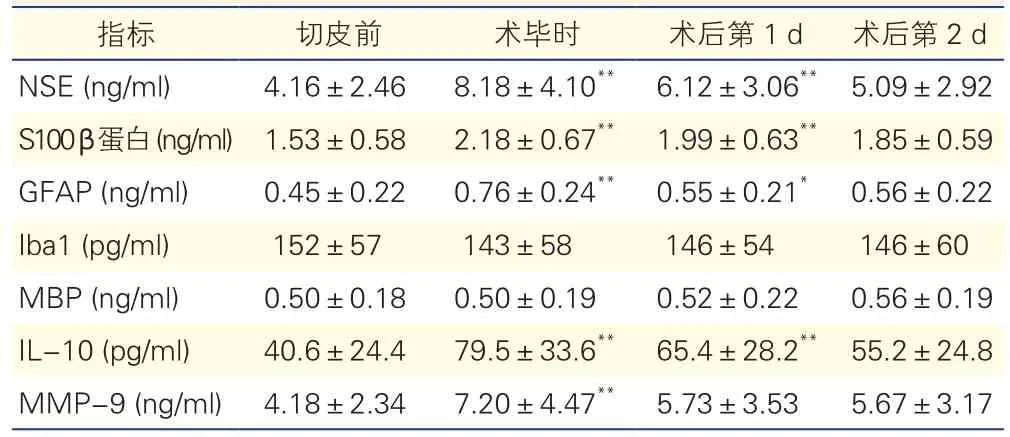
表1 45例患者围术期脑脊液神经损伤标志物及炎性因子的浓度变化(±s)
注:GFAP:胶质纤维酸性蛋白;Iba1:离子钙接头蛋白1;IL-10:白细胞介素-10;MBP:髓鞘碱性蛋白;MMP-9:基质金属蛋白酶-9;NSE:神经元特异性烯醇化酶。与切皮前比较*P<0.05 **P<0.01
指标 切皮前 术毕时 术后第1 d 术后第2 d NSE (ng/ml) 4.16±2.46 8.18±4.10** 6.12±3.06** 5.09±2.92 S100β 蛋白(ng/ml)1.53±0.582.18±0.67**1.99±0.63**1.85±0.59 GFAP (ng/ml) 0.45±0.22 0.76±0.24** 0.55±0.21* 0.56±0.22 Iba1 (pg/ml) 152±57 143±58 146±54 146±60 MBP (ng/ml) 0.50±0.18 0.50±0.19 0.52±0.22 0.56±0.19 IL-10 (pg/ml) 40.6±24.4 79.5±33.6** 65.4±28.2** 55.2±24.8 MMP-9 (ng/ml) 4.18±2.34 7.20±4.47** 5.73±3.53 5.67±3.17
45例患者术后并发症的发生情况:术后透析10例,肺部感染4例,二次开胸止血3例,切口愈合不良2例,一过性精神障碍(烦躁、不配合)2例,3例患者在拔除脑脊液置管后出现头痛,无截瘫或轻瘫并发症发生。死亡2例,死因均为多脏器功能衰竭。其余患者无术后并发症,术后恢复顺利。
3 讨论
TAAAR术后脊髓缺血是最严重的并发症之一,主要表现为截瘫或轻瘫。Coselli等[1]报道了3 309例TAAAR术,术后永久性截瘫或轻瘫的发生率分别为2.9%与2.4% (总的脊髓并发症发生率为5.3%)。Zhang等[3]报道了阜外医院81例TAAAR术,术后永久性截瘫或轻瘫的发生率分别为2.5%与1.2%(总的脊髓并发症发生率为3.7%)。本组45例患者术后无截瘫或轻瘫发生。
TAAAR术中脊髓保护措施主要包括:维持较高血压(平均动脉压>90 mmHg)、脑脊液引流、肋间动脉重建、主动脉分段阻断以增加脊髓血供;全身轻度低温(32~34 ℃)以降低脊髓氧耗;大剂量甲基强的松龙以减轻脊髓水肿等[4]。动物实验中,氙气延迟后处理可以减轻大鼠脊髓缺血再灌注损伤[5]。
脑脊液引流是有效预防与治疗TAAAR术后截瘫或轻瘫的重要措施之一。TAAAR术后发生截瘫或轻瘫的患者经脑脊液引流减压后运动功能可以完全恢复或好转[6]。胸腹主动脉瘤患者在介入治疗下使用主动脉覆膜支架治疗,同时行脑脊液引流,其术后截瘫发生率显著下降[7]。脑脊液引流也为本研究提供了可能。脊髓缺血再灌注损伤时,脊髓组织中的神经损伤标志物及炎性因子可以渗漏或分泌到脑脊液或血液中,因此,脑脊液中神经损伤标志物与炎性因子的浓度变化,可以反映脊髓组织受损程度及炎性反应程度。
研究表明,脑脊液中多种生化指标可以作为脊髓损伤的标志物,但目前在TAAAR术中研究脑脊液中神经损伤标志物及炎性因子的文献较少[8]。Winnerkvist等[9]检测了39例胸腹主动脉瘤患者脑脊液中GFAP、神经丝三联体蛋白(NFL)与S100β蛋白的浓度,发现术后出现脊髓损伤症状者GFAP、NFL 与S100β蛋白的浓度比无脊髓并发症者的浓度分别高571倍、14倍与18倍,但并没有分析术后这些神经损伤标志物的达峰时间。邹以席等[10,11]检测了胸腹主动脉瘤患者围术期血清NSE、S100β蛋白及GFAP 的浓度变化,但没有进行脑脊液分析;或虽然检测了脑脊液中NSE、S100β蛋白及GFAP的浓度,但并没有对各时点的浓度变化进行统计分析比较。本研究对TAAAR患者围术期脑脊液中多种指标进行了系统分析比较。
NSE为反映神经元受损的指标之一。在心肺脑复苏后仍然昏迷的患者中,血清NSE浓度> 97 ng/ml诊断患者预后差的特异度为100%,敏感度为49%[12]。本研究中,脑脊液NSE浓度在术毕达到峰值,反映了脊髓组织缺血再灌注后脊髓神经元损伤在术毕最严重,需要在术中、术后采取必要措施减轻脊髓神经元损伤。
临床上S100β蛋白是公认的反映脑脊髓损伤的标志物之一。S100β蛋白在中枢主要由星形胶质细胞与少突胶质细胞分泌,在外周主要由雪旺细胞分泌。生理浓度的S100β蛋白与神经系统的发育、胶质细胞的增殖及神经元的修复有关,病理浓度的S100β蛋白可以作为脑损伤严重程度及预后的观察指标[13]。和NSE一致,本研究中S100β蛋白在术毕达到峰值,反映脊髓组织缺血再灌注损伤在术毕时达到高峰。
GFAP为星形胶质细胞的特异性标志物,GFAP增加表明星形胶质细胞增殖与激活[14]。在创伤性脑损伤患者,血清GFAP浓度比S100β蛋白与NSE更能准确地反映脑损伤程度[15]。本研究中,GFAP在术毕达到峰值,说明脊髓星形胶质细胞在术毕时已显著激活。
Iba1与MBP分别为小胶质细胞与少突胶质细胞的特异性标记物,在本研究中各时点浓度无显著变化,说明在本研究中,脊髓缺血再灌注损伤后小胶质细胞与少突胶质细胞受影响较小。
脊髓缺血再灌注损伤可以诱发脊髓的炎性反应,导致脊髓组织炎性因子的分泌与释放。IL-10具有抗炎作用,在中枢神经系统中,其主要由神经胶质细胞,包括星形胶质细胞、小胶质细胞与少突胶质细胞合成与分泌[16]。本研究中,IL-10水平在术毕及术后第1d均显著增加,提示机体在经受了脊髓缺血再灌注损伤后,机体自身加强了抗炎能力。由于本研究中反映小胶质细胞与少突胶质细胞的Iba1与MBP水平均无显著变化,提示脑脊液中IL-10浓度增加主要由脊髓星形胶质细胞合成与分泌,对脊髓缺血再灌注损伤后的炎性反应起抑制作用。
虽然脊髓缺血再灌注损伤时可引发血脊髓屏障的破坏或改变,但临床上用于检测血脊髓屏障完整性的指标较少[11]。MMP-9参与血脑屏障与血脊髓屏障细胞外基质的破坏与重建,在脑脊髓损伤时,脑脊液中MMP-9是反映血脑屏障与血脊髓屏障改变的指标之一[17]。本研究中,MMP-9在术毕达到峰值,说明脊髓缺血再灌注损伤后,血脊髓屏障渗透性增加,但MMP-9于术后1d即恢复到切皮前水平,表明血脊髓屏障的较快恢复。
本研究也有不足之处。首先,本研究得出脊髓损伤反应高峰位于术毕的结论并不精确,应位于主动脉近端阻断时点与术后1d时点之间。其次,由于术中肋间动脉不能完全重建,甚至无法重建,可以导致脊髓直接的缺血损伤,此与脊髓再灌注损伤无法完全区分,则本研究脑脊液中神经损伤标志物及炎性因子浓度变化为此两者的综合反映。再次,由于本研究无法将患者按术后是否瘫痪分组,以判断哪些脑脊液指标对临床预测术后截瘫具有帮助,这需要以后进行大样本数据收集与脑脊液分析。另外,体外循环低温与血液稀释也可以对本研究产生影响。
TAAAR患者脑脊液中多种神经损伤标志物及炎性因子水平在术毕及术后第1d显著升高,其浓度峰值发生于术毕时,提示脊髓损伤反应高峰位于术毕,应在术中、术后采取必要措施,以减轻脊髓损伤反应及并发症发生。

