右心室流出道起源室性早搏消融压力分析
单亮,唐闽,陈柯萍,张澍
经导管射频消融可以有效治疗右心室流出道起源的室性早搏(RVOT-PVC),既往研究发现,消融导管-组织的接触压力是造成有效消融损伤的重要因素[1-4]。应用压力感知导管实时监控导管尖端的组织接触压力,一方面可以实现有效消融,另一方面可避免因压力过大引起的心肌穿孔等消融并发症[5],但目前缺少对RVOT-PVC放电过程中的压力进行分析的临床研究。本研究应用压力感知导管评价RVOTPVC消融放电过程中的压力,并对RVOT不同消融部位的压力和导管稳定性进行了分析。
1 资料与方法
研究对象:本研究连续纳入2014-03至2017-03期间本中心收治的RVOT-PVC患者,患者心电图表现为Ⅱ、Ⅲ、aVF导联QRS波呈高大直立R波,胸前导联移行在V3导联以后,并且动态心电图24小时室性早搏总数不少于8 000次。经病史采集、体格检查、实验室检查、影像学及超声心动图等辅助检查排除器质性心脏病(如慢性心力衰竭、高血压、瓣膜性心脏病、缺血性心脏病等)、糖尿病、甲状腺疾病、全身系统性疾病等患者,并排除既往曾行导管消融的患者。
射频消融治疗:(1)导管消融治疗时患者有室性早搏发作,手术在局部麻醉下进行,Thermocool SmartTouch压力感知消融导管(美国强生公司)监测术中消融压力,Carto 3电解剖标测系统(强生公司)和LabSystem Pro电生理记录仪(美国巴德公司)记录消融压力和心内电图等信息。标测前压力感知导管在非组织接触区域进行校准,X线引导下导管在右心室流出道内移动建立右心室流出道的电解剖模型,术中应用起搏标测和激动标测方法确定右心室流出道内室性早搏的消融靶点。(2)消融放电过程应用压力感知导管,消融条件设定为温控模式,温度55℃,消融时间60 s,功率25 W。在室性早搏的局部最早心室激动点或起搏标测的心室QRS波形态与室性早搏一致的位置定为消融靶点[6],Carto标测系统记录下此点;记录中所有点均无重叠,且保证消融放电中导管操作稳定。有效消融点定义为:放电后室性早搏明显减少或消失,并再次放电行巩固消融。消融即刻成功标准为:观察10 min且给予异丙肾上腺素室性早搏均未再出现。(3)消融导管的向量方向在Carto 3标测系统上呈现为彩色箭头(图1),消融过程中有效消融点的实时压力记录在Carto 3标测系统中,但术者看不到术中压力值且无确定的适宜压力供参考。根据消融靶点解剖位置,将患者分为右心室流出道间隔组和游离壁组,记录两组有效消融点的压力、双极电压、阻抗、压力-时间指数(FTI)[3]等电生理参数,计算有效消融点消融压力的相对标准偏差(RSD)反映导管的消融时的稳定性[7]。对不同室性早搏起源部位的消融压力情况进行分析。
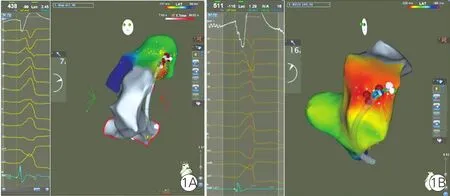
图1 Carto 3标测系统中右心室流出道消融靶点示意图
随访:术后3个月行动态心电图和心电图检查,记录所有患者的随访信息。
统计学方法:采用 SPSS 19.0软件进行统计学分析,正态分布计量资料以均数±标准差表示,非正态分布计量资料以中位数(四分位数)表示,计数资料以例(%)表示。计量资料采用配对t检验,计数资料采用χ2检验,P<0.05 被认为差异有统计学意义。
2 结果
患者的临床特征(表1):经消融标测确定46例患者的室性早搏起源于右心室流出道,经过3个月随访,1例患者失访,2例患者拒绝再次行消融治疗,43例RVOT-PVC患者未复发的, 共134个有效消融点,未出现心包积液等并发症。根据右心室流出道消融靶点的解剖位置,43例患者被分为间隔组(n=20)和游离壁组(n=23),两组在年龄、性别、体重指数、左心室收缩末期内径、左心室射血分数、室性早搏负荷等方面的差异均无统计学意义(P均>0.05)。
有效消融点的电生理参数分析(表2):134个有效消融点的平均压力为(12.0±7.5)g。间隔组有70个有效消融点,平均消融压力为(13.0±9.4)g ;游离壁组有64个有效消融点,平均消融压力为(11.0±4.4)g;两组的消融压力及压力-时间指数差异均有统计学意义(P均<0.05),而双极电压及阻抗差异无统计学意义(P均>0.05)。间隔组和游离壁组的消融压力RSD分别为71.5%和40.9%,差异有统计学意义(P<0.01)。
表1 43例未复发患者的临床特征(±s)
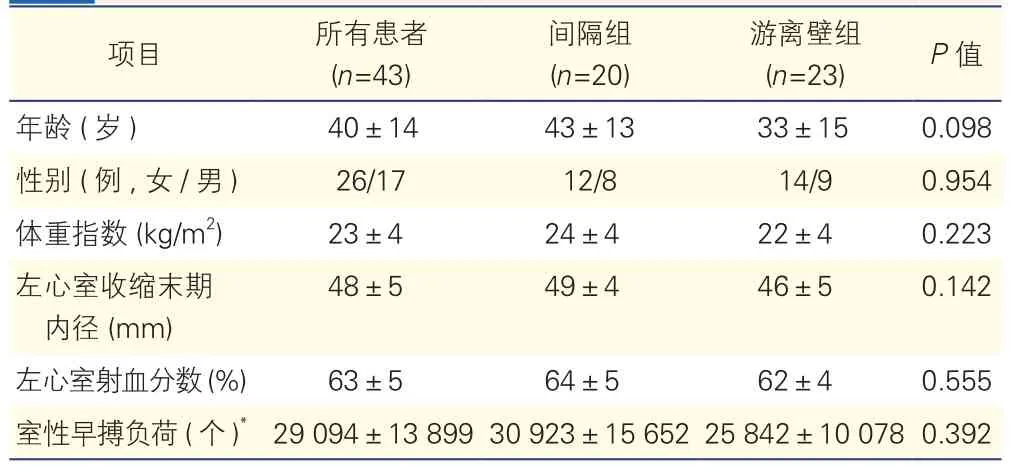
表1 43例未复发患者的临床特征(±s)
注: *室性早搏负荷为动态心电图24小时右心室流出道起源的室性早搏总数
年龄 (岁) 40±14 43±13 33±15 0.098左心室射血分数 (%) 63±5 64±5 62±4 0.555
表2 有效消融点的电生理参数分析(±s)
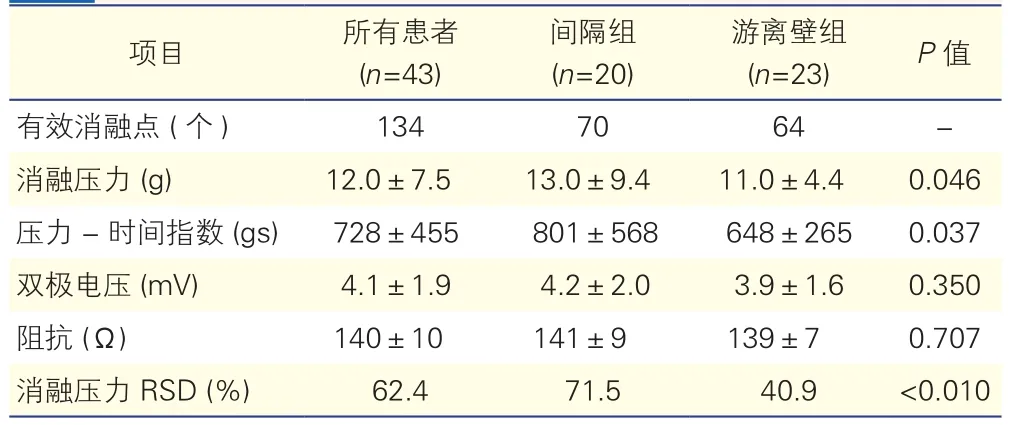
表2 有效消融点的电生理参数分析(±s)
注:RSD:相对标准偏差。-:无
有效消融点 (个) 134 70 64 -阻抗 (Ω) 140±10 141±9 139±7 0.707
有效消融点的消融压力分布情况:在134个有效消融点中,22个(16%)有效消融点的压力<5 g,71%有效消融点的消融压力在5~20 g范围内(图2)。间隔组和游离壁组分别有39%和74%有效消融点的消融压力分布在5~15 g(压力适中区),其余有效消融点的消融压力<5 g或>15 g,两组间压力分布差异有统计学意义(P<0.05),见图3。
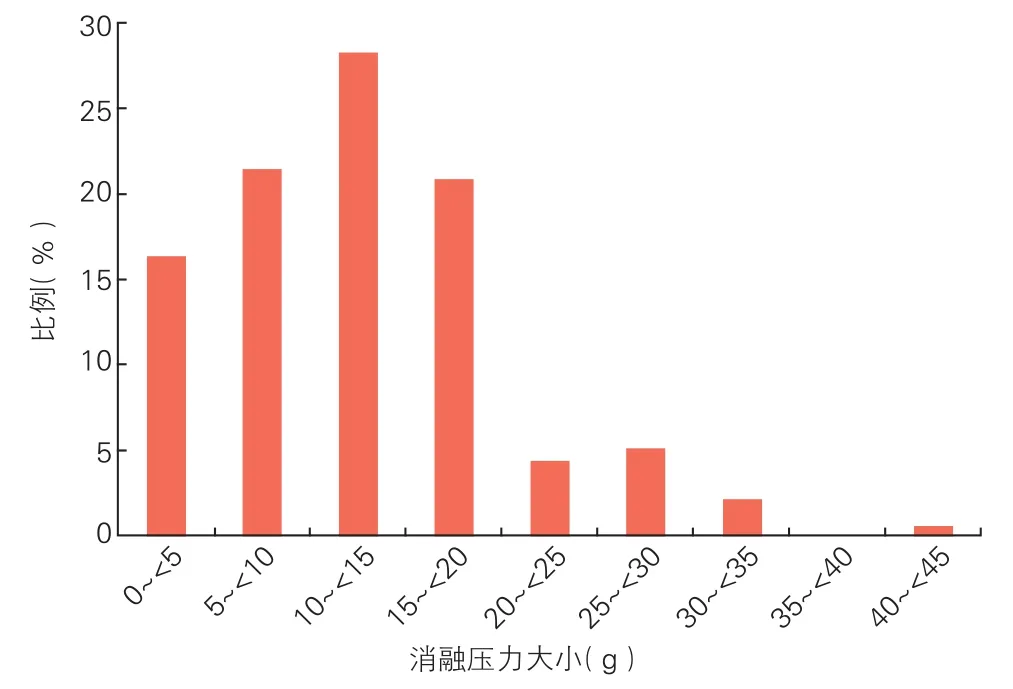
图2 134个有效消融点的消融压力分布情况
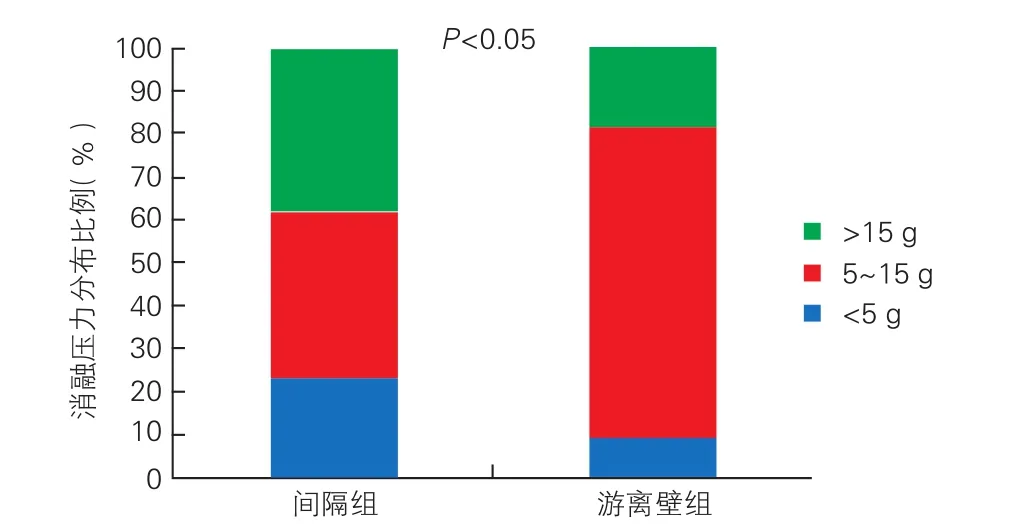
图3 间隔组和游离壁组有效消融点的消融压力分布情况
不同消融压力下电压及阻抗比较(图4):随着消融压力增加,电压和阻抗也相应增加,消融压力<5 g、5~15 g、>15 g三种情况下的电压和阻抗差异均有统计学意义(P均<0.05),但双极电压和阻抗在消融压力的分布下有数值重叠。
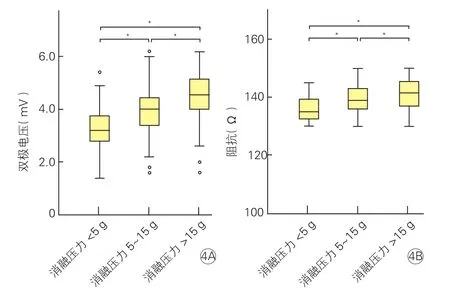
图4 不同消融压力下的双极电压和阻抗比较
3 讨论
本研究用压力感知导管消融RVOT-PVC,分析了消融放电时右心室流出道的消融压力。本研究发现,RVOT-PVC消融放电时的平均有效压力为(12.0±7.5)g,右心室流出道常见消融部位间隔侧和游离壁侧的消融压力大小存在明显差异,且两个部位消融压力分布趋势及相对标准偏差也显著不同,游离壁侧的压力集中在5~15 g之间,表明游离壁侧的RVOT-PVC需要更加适中且稳定的组织接触压力。
消融压力有很重要的临床价值,尽管阻抗、电压等因素可能影响治疗效果,但是消融导管与组织的接触压力是决定消融损伤的重要因素,消融导致的局部心肌损伤可以终止室性早搏[8]。在没有压力感知导管实时监测组织接触压力下,能否达到有效消融与术者的经验和技术密切相关[9]。压力感知导管对消融压力的实时监测可以使术者避免因导管-组织接触压力不足而造成无效消融损伤,从而改善治疗效果,降低心律失常的复发率。既往研究发现,消融时压力不足10 g时心房颤动复发率达100%,而消融压力超过20 g 时,随访12个月时80%的患者未复发心房颤动[10]。更重要的是,压力感知导管可以通过实时监测消融导管与组织的接触压力,从而避免过高的组织接触压力,降低心肌穿孔等手术并发症的发生[11,12]。动物实验发现,消融压力超过77 g时心包填塞的发生率明显升高,而应用压力感知导管实时监控消融压力并根据压力调整导管-组织接触压力可以使心肌穿孔发生率降低23%[13,14]。
本研究进一步确定了压力感知导管的有效性,它可以监测RVOT-PVC消融放电中的有效压力。由于本研究主要分析了有效消融点的消融压力,从而避免了标测点及非消融靶点对结果的干扰,因此对临床实际应用更有价值。本研究直接比较右心室流出道常见消融部位间隔和游离壁的消融导管放电时的组织接触压力,发现间隔和游离壁消融压力显著不同,表明右心室流出道不同部位应采用不同的消融压力。由于右心室流出道间隔侧和游离壁侧的解剖结构不同,使得导管与心肌组织的贴靠压力不同。同时,间隔和游离壁的压力分布也不同,游离壁的压力集中在适中的区域,表明游离壁消融需要更加适当而稳定的导管接触力;而间隔侧的压力分布离散,表明在间隔侧时导管操作灵活度高。
近几年室性心律失常的导管消融已经取得了长足的进步,压力感知导管可以协助术者对消融压力进行实时监控,术者可对过高或过低的消融压力进行即刻调整,从而达到安全、有效的消融效果。然而,本研究仅是室性心律失常压力感知导管消融的前导性研究,针对消融放电时不同压力对心肌损伤深度及效果的影响需要进一步研究,并且还需要进一步探索RVOT-PVC的机制和压力感知导管应用,从而改善患者的临床预后。

