根皮苷可增强索拉非尼抑制肝癌细胞能量代谢及活力
王德华, 刘云燕, 李敏然, 苗同国, 任桂芳, 董金红
河北省石家庄市第五医院介入肿瘤科,石家庄 050017
肝细胞肝癌(简称肝癌)作为一种高危恶性肿瘤,全球发病率占恶性肿瘤发病率的第6位,致死率占恶性肿瘤致死率的第3位[1]。由于肝癌早期症状不明显,且进展迅速,大多数患者发现时已属晚期,而此时鲜有有效治疗手段。近年来,索拉非尼在晚期肝癌患者的治疗中发挥了重要作用。索拉非尼作为一种多靶向激酶抑制剂,是目前唯一被批准用于经皮肝动脉化疗栓塞(TACE)失败后或极末期肝癌治疗的药物[2]。然而,研究[3]显示,索拉非尼对晚期肝癌患者的有效率仅30%,且患者常在用药6个月内产生耐受。因此,寻找有效增强索拉非尼抗肿瘤效应的方法并探索其机制显得急迫而重要。
肿瘤细胞的Warburg效应使其呈现不同于正常细胞依赖葡萄糖酵解供能的代谢模式[4-5],糖酵解产生的能量被用于肿瘤的快速扩增与迁移。肿瘤细胞与正常细胞代谢模式的差异有望成为调控肿瘤生长的靶点。而葡萄糖通过葡萄糖转运体进入正常或肿瘤细胞是糖酵解的第1步。根皮苷是一种葡萄糖转运抑制剂,本研究探讨了其对索拉非尼抗肿瘤效应的影响。
1 材料与方法
1.1 主要材料及试剂 人HepG2细胞购自上海细胞生物研究所;血清、培养基购自Abcam公司;索拉非尼由德国拜耳公司生产;根皮苷购自上海生命科学院。用CCK-8法确定50%细胞生长抑制(IC50)所须索拉非尼和根皮苷浓度,分别为5.01 μmol/L、4.98 μmol/L,均采用5 μmol/L。
1.2 细胞活力检测 采用CCK-8法检测细胞活力。索拉非尼组HepG2细胞给予索拉非尼5 μmol/L处理48 h;根皮苷组HepG2细胞给予根皮苷5 μmol/L处理48 h;索拉非尼联合根皮苷组(联合组)给予索拉非尼5 μmol/L+根皮苷5 μmol/L处理48 h。通过测定D450处光密度值,评估各组细胞活力。
1.3 细胞葡萄糖摄取 通过葡萄糖代谢比色试剂盒(Biovision公司)检测HepG2细胞葡萄糖摄取情况。各组HepG2细胞药物处理48 h后,按照试剂盒说明书顺次加入KRPH、葡萄糖摄取缓冲液、2DG,室温避光孵育30 min后检测荧光值。
1.4 细胞ATP检测 采用ATP Detection Assay Kit(Abcam 公司)检测细胞ATP。各组HepG2细胞药物处理48 h后,按照说明书制作标准曲线,顺次加入ATP工作液。用分光光度计通过检测光信号强弱,以此反映细胞内ATP水平。
1.5 细胞caspase-3活力与凋亡细胞计数检测 采用 caspase-3 assay kit试剂盒(Abcam 公司),通过比色法测定细胞caspase-3活力。凋亡细胞计数通过Annexin Ⅴ/PI双染色后,应用流式细胞仪进行定量计数。
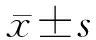
2 结 果
2.1 索拉非尼和根皮苷对细胞活力的影响 CCK-8检测结果(图1)显示:索拉非尼5 μmol/L处理48 h后,HepG2细胞活力降低(P<0.05);根皮苷5 μmol/L处理48 h后,HepG2细胞活力降低,但差异无统计学意义;联合组细胞活力进一步降低,与其他组差异均有统计学意义(P<0.05)。
2.2 索拉非尼和根皮苷对葡萄糖摄取的影响 细胞葡萄糖摄取实验结果(图2)显示:索拉非尼5 μmol/L处理48 h后,HepG2细胞葡萄糖摄取减少,但差异无统计学意义;根皮苷5 μmol/L处理48 h后,HepG2细胞葡萄糖摄取较对照组与较索拉非尼组均减少(P<0.05);联合组细胞葡萄糖摄取进一步减少,与其他组差异均有统计学意义(P<0.05)。
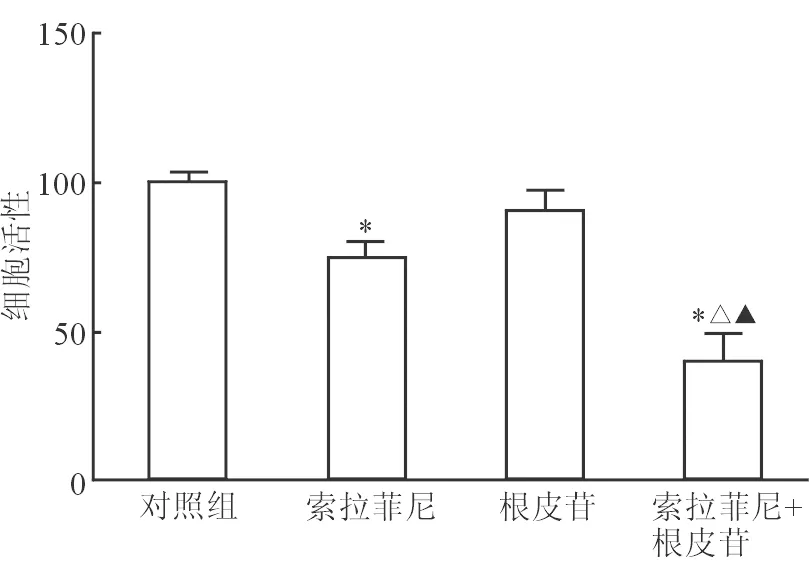
图1 各组HepG2细胞活力检测结果
*P<0.05与对照组相比;△P<0.05与索拉非尼组相比;▲P<0.05与根皮苷组相比

图2 各组HepG2细胞葡萄糖摄取检测结果
*P<0.05与对照组相比;△P<0.05与索拉非尼组相比;▲P<0.05与根皮苷组相比
2.3 索拉非尼和根皮苷对细胞内ATP含量的影响 细胞ATP检测结果(图3)显示:与对照组相比,索拉非尼5 μmol/L与根皮苷5 μmol/L处理48 h后,HepG2细胞内ATP生成均减少(P<0.05);联合组细胞内ATP进一步减少,与其他组差异均有统计学意义(P<0.05)。
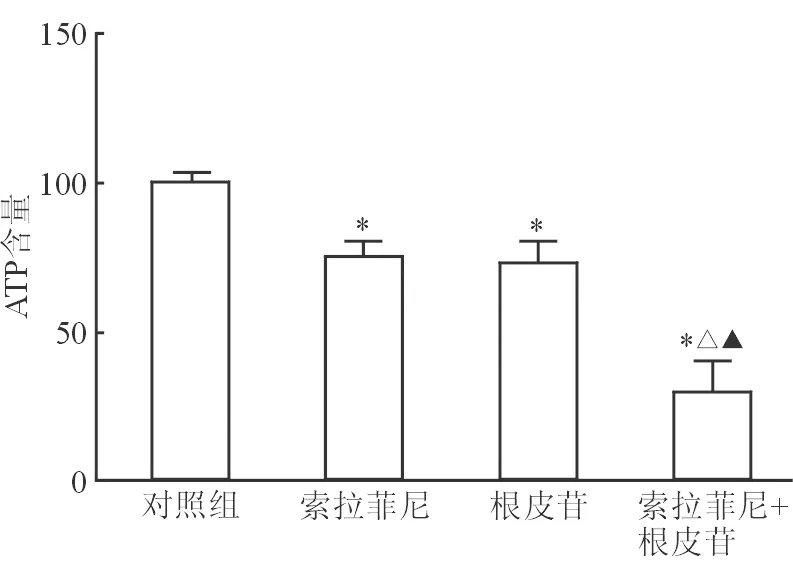
图3 各组HepG2细胞ATP含量测定结果
*P<0.05与对照组相比;△P<0.05与索拉非尼组相比;▲P<0.05与根皮苷组相比
2.4 索拉非尼和根皮苷对细胞凋亡的影响 Caspase-3活力检测结果(图4)显示:与对照组相比,索拉非尼5 μmol/L与根皮苷5 μmol/L处理48 h后,HepG2细胞内caspase-3活力均提高(P<0.05);联合组caspase-3活力进一步提高,与其他组差异均有统计学意义(P<0.05)。各组HepG2细胞凋亡与caspase-3变化情况一致(图5)。

图4 各组HepG2细胞caspase-3 活力检测结果
*P<0.05与对照组相比;△P<0.05与索拉非尼组相比;▲P<0.05与根皮苷组相比
图5 各组HepG2细胞凋亡检测结果
*P<0.05与对照组相比;△P<0.05与索拉非尼组相比;▲P<0.05与根皮苷组相比
3 讨 论
索拉非尼主要通过抑制Raf激酶活性和血管内皮生长因子受体、血小板衍生生长因子受体、c-kit活性等,进而抑制肿瘤细胞增殖及新生血管生成[6]。通过该作用,索拉非尼可以延长晚期肝癌患者生存时间,但有效率较低。因此,迫切须要探索可能的调控靶分子,并与索拉非尼联合应用,进而提高索拉非尼的疗效。
根皮苷可抑制多种葡萄糖转运体或通道[7],从而减少细胞内葡萄糖含量,抑制糖酵解,进而降低肿瘤细胞能量供给。本研究中,索拉非尼组与根皮苷组肿瘤细胞内ATP含量均减少,与研究[8]结论一致;根皮苷组细胞葡萄糖摄取减少,根皮苷引起肝癌细胞内ATP含量降低可能与其抑制葡萄糖摄取有关;索拉非尼联合根皮苷组肿瘤细胞葡萄糖摄取和细胞内ATP含量较单药组进一步减少,这种肿瘤细胞能量代谢抑制效应可能体现为细胞活力降低、凋亡增加。
本研究中,根皮苷组细胞活力与对照组差异无统计学意义。陈娟等[9]研究发现,低血糖能改善氧化损伤细胞的活力,维持细胞形态。根皮苷减少葡萄糖转运而可能不抑制细胞的活力的具体机制仍有待进一步研究。本研究中,索拉非尼可以促进肿瘤细胞凋亡,与文献[10]报道相似;索拉非尼联合应用葡萄糖转运抑制剂时,这种促凋亡效应进一步加强。这是因为索拉非尼可以降低肿瘤细胞内ATP含量,从而影响肿瘤细胞的能量代谢,而与葡萄糖转运抑制剂联合应用时,葡萄糖转运被抑制。此外,葡萄糖转运体在肝癌细胞中高表达,并与肝癌分期晚、分化差等因素相关[11-12],而索拉非尼可通过降低缺氧诱导因子-1(HIF-1)来下调葡萄糖转运体的表达[13-14]。因此,联合应用葡萄糖转运抑制剂时,索拉非尼疗效增强,肿瘤细胞内能量进一步减少、细胞凋亡增加。
综上所述,代谢抑制剂可以通过协同索拉非尼抑制肿瘤细胞葡萄糖摄取来减少细胞内能量,进而降低细胞活力、促进细胞凋亡,提高索拉非尼的疗效。本研究为晚期肝细胞癌患者索拉非尼的优化治疗,以及提高晚期肝癌患者生存率提供了新思路。

