急性缺血性卒中血管内治疗中国指南2018
中国卒中学会,中国卒中学会神经介入分会,中华预防医学会卒中预防与控制专业委员会介入学组
引 言
卒中是导致人类致残和致死的主要疾病之一,急性缺血性卒中(acute ischemic stroke,AIS)约占全部卒中的80%。AIS治疗的关键在于尽早开通阻塞血管,挽救缺血半暗带。目前被证实有效的AIS早期血管再通的治疗方法主要是静脉重组组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)溶栓[1-3]。静脉溶栓随机对照研究的汇总分析进一步证实发病4.5 h内静脉rt-PA溶栓有明确获益,而且溶栓时间越早,获益越大[4]。由于静脉溶栓具有严格的时间窗限制,能够通过其获益的患者不到3%,同时其治疗效果依然有巨大的优化空间:与对照组相比,静脉溶栓后3~6个月死亡率未明显降低,高达17.9%,且2/3的患者依然遗留有不同程度的残疾[4],尤其对合并有大血管闭塞或病情较重的患者效果不佳,其再通率低(13%~18%)[5]。因此国内外学者一直在探索对大血管闭塞AIS患者的血管内治疗方法。2013年初发表的3项多中心、前瞻性、随机对照试验(random control trial,RCT)均未能显示血管内治疗相比静脉溶栓的优越性[6-8]。随着技术材料以及筛选策略的更新,自2014年底开始,一系列相关研究相继公布了较为一致的研究结果:在经过筛选的前循环大血管急性缺血性卒中患者中,以机械取栓为主的血管内治疗可带来明确获益[9-13]。基于以可回收支架为主的6项机械取栓RCT研究的结果,2015年国内外相关指南对特定的人群取栓治疗给予最高级别的推荐[9-14]。2015年至今,机械取栓研究在多方面取得了进展,应用弥散加权成像(diffusion weighted image,DWI)或计算机断层扫描灌注成像(computed tomography perfusion,CTP)联合临床不匹配治疗醒后卒中及晚就诊卒中患者用Trevo装置行神经介入治疗(DWI or CTP Assessment with Clinical Mismatch in the Triage of Wake Up and Late Presenting Strokes Undergoing Neurointervention with Trevo,DAWN)研究和影像评估筛选缺血性卒中患者血管内治疗研究3(Endovascular Therapy Following Imaging Evaluation for Ischemic Stroke 3,DEFUSE 3)的发表将机械取栓时间窗由原来6 h扩展到24 h[15-16]。结合多项最新研究结果,美国心脏学会(American Heart Association,AHA)/美国卒中学会(American Stroke Association,ASA)在《2018急性缺血性卒中早期治疗指南》中对动脉取栓的推荐进行了大幅度修改,欧洲卒中组织(European Stroke Organization,ESO)也更新了其指南推荐[17]。中国动脉取栓的数量每年都在大幅增长,基于这些最新研究证据,结合中华预防医学会卒中预防与控制专业委员会介入学组发表的《急性缺血性卒中血管内治疗中国指南2015》,中国卒中学会组织国内本领域专家通过查阅文献、反复征求建议并讨论,制定了关于血管内治疗的2018版指南,旨在总结目前有关AIS血管内治疗的最新研究进展,提出适合我国AIS血管内治疗临床可参考的标准及管理方法。建议临床医师在参照本指南内容的基础上,结合实际情况对AIS患者采取有针对性的个体化治疗。
本指南采用的推荐分类及证据水平参照中国卒中学会2017指南制定指导手册中的推荐意见分类和证据等级(表1)。
1 急性缺血性卒中血管内治疗的循证医学证据
1.1 动脉溶栓治疗
AIS动脉溶栓的证据主要来自2项RCT研究:动脉内应用重组尿激酶原治疗急性脑血栓栓塞试验Ⅱ(Prolyse in Acute Cerebral Thromboembolism Ⅱ,PROACT-Ⅱ)和大脑中动脉栓塞局部纤溶试验(Middle Cerebral Artery Embolism Local Fibrinolytic Intervention Trial,MELT)。PROACT-Ⅱ试验是一项多中心前瞻性RCT研究,共纳入180例发病6 h内的大脑中动脉(middle cerebral artery,MCA)(M1或M2)闭塞患者,比较重组尿激酶原联合肝素动脉溶栓(试验组)与单纯肝素动脉溶栓(对照组)的安全性及有效性[18]。意向治疗(intention to treat,ITT)分析结果显示,试验组主要终点3个月良好神经功能预后[改良Rankin量表(modified Rankin scale,mRS)≤2分]的比例高于对照组(40%vs25%,P=0.04);试验组66%的患者MCA实现再通,而对照组仅为18%(P<0.001);症状性颅内出血(symptomatic intracerebral hemorrhage,sICH)发生率,试验组为10%,对照组为2%(P=0.06);两组死亡率相似。MELT试验比较了6 h内药物治疗与动脉使用尿激酶治疗的效果,治疗组主要终点3个月良好神经功能预后(mRS≤2分)比例较对照组高(49.1%vs36.8%,P=0.35),总体治疗效果及sICH发生率与PROACT-Ⅱ试验一致[19]。前期探索性试验应用小样本研究评估了静脉使用小剂量rt-PA联合动脉溶栓的疗效。卒中急诊管理试验(Emergency Management of Stroke,EMS)、卒中介入治疗(interventional management study Ⅰ,IMS Ⅰ)和IMS Ⅱ研究结果显示联合治疗组患者的神经功能预后显著优于对照组[20-22]。EMS试验旨在验证发病3 h内静脉溶栓联合动脉局部rt-PA溶栓的可行性、有效性及安全性,结果显示尽管静脉联合动脉溶栓不能改善临床预后,但其具有可行性且更容易达到再通。IMS Ⅰ试验探讨了静脉联合动脉溶栓的可行性和安全性,结果显示联合溶栓组3个月死亡率较对照组低,但无统计学意义;sICH与单纯静脉溶栓相似[20]。IMS Ⅱ试验比较了低剂量静脉rt-PA(0.6 mg/kg)溶栓和动脉rt-PA(22 mg)溶栓的有效性和安全性,并与美国国立神经疾病和卒中研究院(National Institute of Neurological Disorders and Stroke,NINDS)研究中的rt-PA组比较,结果显示3个月时mRS 0~2分的患者比例在IMSⅡ研究中更高(46%vs39%),然而有较高的sICH,但死亡率较低[21]。IMS Ⅱ研究中的完全再通率[心肌梗死溶栓分级(thrombolysis in myocardial infarction,TIMI)3级]仅为4%,部分再通(TIMI 2或3级)为60%。上述研究均为前循环AIS的试验研究,目前尚缺乏针对后循环及急性基底动脉闭塞(basilar artery occlusion,BAO)的前瞻性RCT研究。Perttu J.Lindsberg等[23]报道了使用静脉或动脉溶栓治疗420例基底动脉闭塞患者的效果,显示动脉溶栓再通率更高(65%vs53%,P=0.05),但死亡率和致残率与静脉溶栓无差异。基底动脉国际合作研究(Basilar Artery International Cooperation Study,BASICS)是一项前瞻性登记研究,分析了619例急性起病的BAO患者的临床治疗效果,其中592例患者资料最终纳入分析,使用抗栓治疗(183例)、静脉溶栓(121例)或动脉溶栓(288例),未显示出各种治疗方案的效果有显著差异[24]。
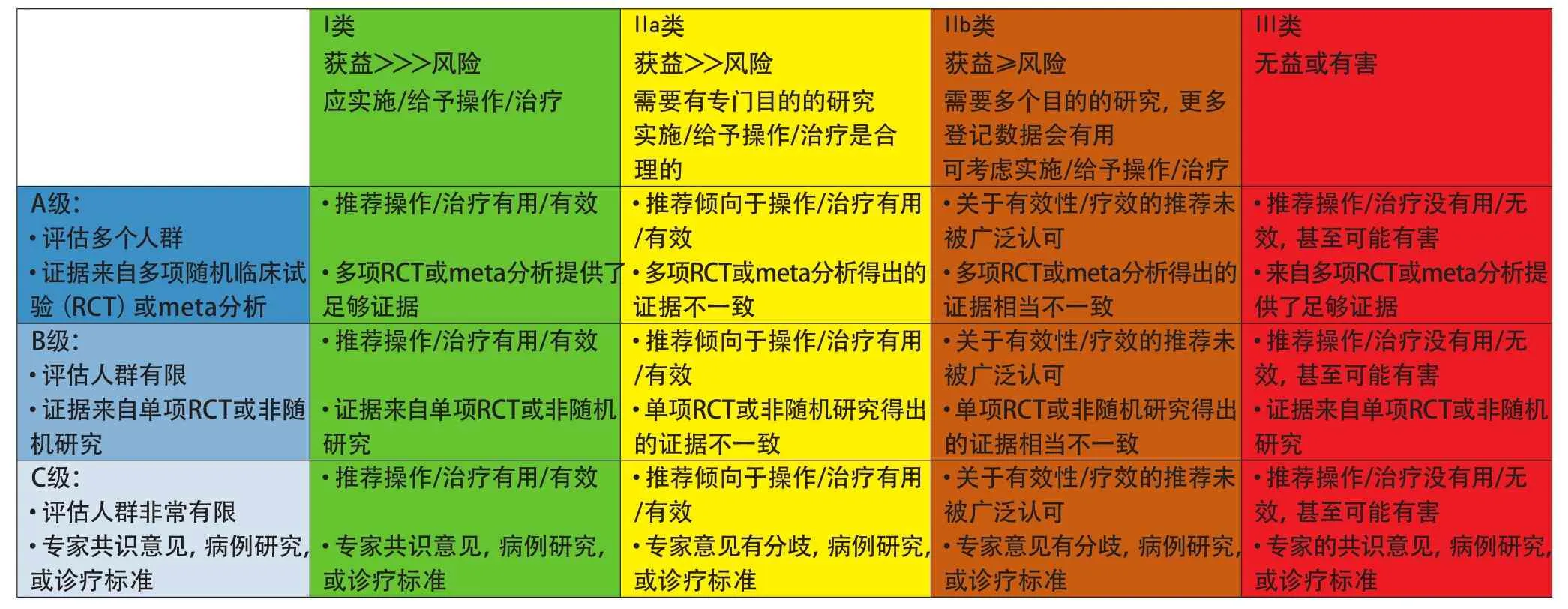
表1 推荐分类和证据级别
在近期的血管内治疗试验中,经动脉溶栓治疗起的作用有限,常作为挽救性治疗,而不是主要治疗。荷兰急性缺血性卒中血管内治疗多中心随机临床试验(Multicenter Randomized Clinical Trials of Endovascular Treatment of Acute Ischemic Stroke in the Netherlands,MR CLEAN)干预组中有24例患者(12.3%)使用机械取栓联合动脉溶栓治疗,仅有1例患者(0.4%)单纯使用动脉溶栓[25]。MR CLEAN试验动脉溶栓方案为静脉溶栓后动脉溶栓用量rt-PA不超过30 mg或尿激酶不超过40万单位,单纯动脉溶栓尿激酶最大剂量为120万单位[26]。来自法国的急性缺血性卒中动脉取栓试验及费效评估(Trial and Cost Effectiveness Evaluation of Intra-arterial Thrombectomy in Acute Ischemic Stroke,THRACE)中干预组将动脉内注射rt-PA(最大量为0.3 mg/kg)作为机械取栓后仍有远端血管持续闭塞患者的补充治疗之一,但必须是在尝试机械取栓效果不佳时。最终141例患者中有15例(11%)在机械取栓后动脉内使用rt-PA,平均用量8.8 mg,与单纯机械取栓相比,对临床预后没有影响[27]。
1.2 机械取栓治疗
机械取栓因为具有以下诸多理论上的优点,因而受到广泛关注:快速再通,更低的出血转化率及卒中介入治疗时间窗可延长[28]。美国食品及药品管理局(Food and Drug Administration,FDA)批准了MerciTMRetrieval(2004年)和Penumbra Aspiration SystemsTM(2008年)作为第一代机械取栓装置。
2013年,3项评估血管内机械取栓治疗AIS的试验——IMS Ⅲ,血栓切除术治疗卒中栓子的机械取栓血管再通试验(Mechanical Retrieval and Recanalisation of Stroke Clots Using Embolectomy,MR RESCUE)和动脉溶栓对比全身溶栓治疗急性缺血性卒中试验(Intra-arterial Versus Systemic Thrombolysis for Acute Ischemic Stroke,SYNTHESIS Expansion)均报道了阴性结果,由于这3项研究结果均发表在NEJM上,受到广泛关注[6-8]。这3项试验结果未能显示出血管内治疗的优越性,分析可能存在以下原因:从发病到治疗的时间较长,采用的影像学方法未能筛选出可能从血管内治疗获益的人群,再通率较预期低以及应用了老一代取栓装置等。
Penumbra取栓装置治疗急性卒中(Assess the Penumbra System in the Treatment of Acute Stroke,THERAPY)试验中,相比于接受单独静脉溶栓治疗,AIS患者利用PenumbraTM血栓抽吸系统进行治疗趋向于有更好的预后。该试验计划招募692例患者,但由于其他试验已获得血管内治疗有利的数据,该试验在仅入组108例患者后提前终止,因此结果不具统计学意义[29]。
美国FDA于2012年又批准了SolitaireTM和TrevoTM支架取栓装置。支架取栓装置的发明是卒中血管内治疗的一个巨大进步,取栓支架具有导航性和快速血管再通的优势,并且远期并发症的风险更低。支架取栓装置使用临时支架捕获血栓,通过与外周血管壁的挤压移动血栓来恢复血流。撤出支架时,血栓被捕获到支架间隙内与支架一同被移除。SolitaireTM(Covidien)和TrevoTM(Stryker)支架取栓装置是最早被FDA批准用于治疗大血管闭塞性卒中的两种支架取栓装置。
早期开展的RCT研究比较了支架取栓装置和MerciTM设备的差异性。Solitaire与Merci装置治疗急性缺血性卒中试验(Solitaire flow restoration device versus the Merci Retriever in patients with acute ischaemic stroke,SWIFT)比较了SolitaireTM和MerciTM装置,在入组113例患者后因有效性存在显著差异而提前终止。在主要终点中,再通定义为TIMI 2或3级,Solitaire组血管再通率更高,比值比(odds ratio,OR)为4.9[95%可信区间(confidence interval,CI)2.1~11.1]。同样,Solitaire组3个月后mRS≤2分的患者比例更多,OR值为2.8(95%CI1.2~6.2)[30]。Trevo与Merci装置治疗大血管闭塞所致急性缺血性卒中试验(Trevo versus Merci retrievers for thrombectomy revascularisation of large vessel occlusions in acute ischemic stroke,TREVO-2)在178例大血管闭塞患者中比较了TrevoTMRetriever和MerciTM的取栓效果。该研究使用脑梗死溶栓分级(thrombolysis in cerebral infarction,TICI)评价血流再灌注情况,Trevo组中TICI≥2级的患者比例更多,OR值为4.2(95%CI1.9~9.7)。同样,Trevo组3个月mRS≤2分的患者比例更多(40.0%vs21.8%),但有更高的死亡率倾向[31]。
在证实了新一代支架取栓装置的有效性和安全性后,多项以新一代支架取栓装置为主要设备的RCT证实了对大血管闭塞患者进行取栓治疗相比单纯静脉溶栓或药物治疗的优势。
MR CLEAN试验是第一个显示出血管内治疗相比标准内科治疗有显著获益的研究[9]。该研究纳入了500例发病6 h内经计算机断层扫描血管造影(computed tomography angiography,CTA)证实的前循环大血管闭塞且美国国立卫生研究院卒中量表(National Institutes of Health stroke scale,NIHSS)评分≥2分的患者,随机分为标准内科治疗或血管内治疗组,血管内治疗患者97%使用支架取栓装置(但无一放置支架),主要终点为90 d mRS,结果显示24 h血管再通率在血管内治疗组较高(80%vs32%,OR6.9,95%CI4.3~10.9),1周时脑梗死体积中位数较小(49 mlvs80 ml),并且3个月的良好预后(mRS 0~2分)比例更高(33%vs19%)。这项研究的阳性结果非常显著,血管内治疗显著提高了血管再通率、血流再灌注程度以及良好神经功能预后的比例。MR CLEAN试验2年的随访结果显示,介入取栓治疗后患者的长期神经功能获益性和90 d随访结果一致,取栓治疗仍然存在显著的获益[32]。
另外一项血管内治疗前瞻性R C T同时强调了从计算机断层扫描(computed tomography,CT)到血管再通的时间最短化,这项来自加拿大的血管内治疗小梗死灶和前循环近端闭塞并强调CT至再通时间最短化(Endovascular treatment for Small Core and Anterior circulation Proximal occlusion with Emphasis on minimizing CT to recanalization times,ESCAPE)试验同样证实了血管内治疗的显著效果[10]。该研究纳入了316例大动脉闭塞的AIS患者后因中期分析显示血管内治疗具有显著获益而提前结束。入组患者随机接受标准内科治疗或标准内科治疗联合血管内治疗,主要终点为90 d mRS,结果显示血管内治疗组显著获益,OR值为2.6(95%CI1.7~3.8,P<0.001)。此外,血管内治疗组90 d良好功能预后(mRS 0~2分)比例显著增加(53.0%vs29.3%,P<0.001),死亡率显著降低(10.4%vs19.0%,P=0.04)。所有亚组分析发现有相似的获益,包括老年及发病6 h后的患者。
Solitaire支架取栓治疗急性缺血性卒中(SolitaireTMWith the Intention For Thrombectomy as PRIMary Endovascular Treatment,SWIFT PRIME)试验在美国和欧洲的39家医院进行,比较静脉rt-PA溶栓与联合血管内治疗(均使用SolitaireTMFR支架)的有效性,结果显示支架取栓组90 d mRS评分变化OR值差异显著(P<0.001),取栓组90 d mRS 0~2分的患者比例更高(60.2%vs35.5%,P<0.001),需治疗人数(number needed to treat,NNT)为4,取栓治疗有降低死亡率的趋势。所有亚组患者均有相似的获益[33]。
来自澳大利亚的前瞻性RCT——急性神经功能缺损患者扩展时间窗溶栓后联合动脉治疗(Extending the Time for Thrombolysis in Emergency Neurological Deficits with Intra-Arterial therapy,EXTEND-IA)研究,旨在证明相比单纯静脉溶栓,对发病4.5 h内、有血管闭塞和可挽救脑组织的前循环AIS患者rt-PA静脉溶栓后尽早行SolitaireTMFR机械取栓是否能够提高缺血组织的早期再灌注率和改善患者神经功能预后。结果显示,相比单纯静脉溶栓,机械取栓组取栓后24 h缺血组织早期再灌注率显著提高(100%vs37%,P<0.001),3 d早期神经功能改善比例更高(80%vs37%,P=0.002),90 d mRS 0~2分的患者比例更高(71%vs40%,P<0.01,NNT=3),死亡率有降低的趋势[11]。
8 h内前循环卒中Solit aire取栓与最佳药物治疗比较研究(Endovascular Revascularization With Solitaire Device Versus Best Medical Therapy in Anterior Circulation Stroke Within 8 Hours,REVASCAT)为西班牙的一项前瞻性RCT,共入组206例患者,主要终点为90 d mRS[34]。结果显示,相比药物治疗组,血管内治疗组90 d mRS 0~2分的患者比例更高(43.7%vs28.2%,校正后OR2.1,95%CI1.1~4);1年随访结果提示取栓治疗相比对照组对患者神经功能预后的改善仍然存在显著差异[35]。
多项血管内治疗卒中试验高效再灌注评价(Highly Effective Reperfusion evaluated in Multiple Endovascular Stroke Trials,HERMES)研究是针对以上5项阳性RCT(MR CLE AN、E SC APE、R E VA SC AT、SWIFT PRIME和 EXTEND-IA)的荟萃分析,各亚组分析结果进一步证实了机械取栓的临床价值[36]。
评价桥接治疗效果的RCT,如THRACE试验的目的是比较单纯静脉治疗和桥接治疗的临床预后,研究从法国26个中心入选414例大动脉闭塞所致中至重度卒中的患者,在rt-PA再灌注治疗期间随机分配。结果表明,静脉溶栓+支架机械取栓组患者3个月良好预后(mRS 0~2分)的比例显著高于单独静脉溶栓组,但两组24 h和3个月sICH发生率无显著性差异[37]。
以上研究的结果为机械取栓提供了高质量的证据,在2015年改写了各国卒中急性期管理指南,推荐取栓的时间窗为6 h,近期取栓试验的关注点在拓展时间窗患者的取栓效果上。
DAWN试验是一项多中心、前瞻性、随机化、开放标签研究,其终点使用盲法评估[15]。该研究在美国、加拿大、欧洲、澳大利亚的26家中心开展,由于在进行预设的中期分析时,取栓组较对照组显示出显著优势而提前终止,最终共有206例患者入组。该研究较既往几大RCT的区别,除使用Trevo而非Solitaire外,入组标准有两大不同:①患者从最后看起来正常至随机化时间为6~24 h;②筛选方案为临床神经功能缺损症状严重程度与梗死面积不匹配——“临床-影像不匹配”(NIHSS评分和MRI-DWI/CTP-rCBF的梗死体积不匹配),定义为:A组:≥80岁,NIHSS≥10分,梗死体积<21 ml;B组:<80岁,NIHSS≥10分,梗死体积<31 ml;C组:<80岁,NIHSS≥20分,梗死体积<51 ml。最终试验结果显示:有效性结局[90 d效用加权mRS和神经功能独立(mRS≤2分)概率]取栓组都显著优于对照组;安全性结局(24 h的sICH和90 d任何原因所致的死亡)在两组间没有显著差异。
DEFUSE 3研究是DEFUSE系列研究中关于血管内治疗的试验,为一项多中心、随机、开放标签、盲法评价结局的临床研究,旨在明确距最后正常时间6~16 h的大血管(颈动脉/大脑中动脉M1)闭塞患者是否可以从取栓治疗中获益[16]。患者选择术前mRS≤2分,年龄18~90岁,脑梗死核心体积扩展至70 ml。发病到开始血管内治疗时间为6~16 h,要求缺血区/梗死区体积比≥1.8,缺血区与梗死区体积错配面积>15 ml。治疗方面可以应用FDA批准的任何取栓装置。结果显示:90 d mRS分值的中位数,机械取栓联合药物治疗组显著优于单纯药物治疗组;90 d良好预后(mRS 0~2分)的患者比例,取栓组显著优于药物组;90 d死亡率,取栓组和药物组无统计学差异;24 h 90%以上再灌注比例,取栓组显著优于药物组;24 h血管完全开通率,取栓组显著优于药物组;两组sICH差异无统计学意义,总体死亡率取栓组稍低。DEFUSE 3的结果表明对于发病6~16 h、半暗带阳性的患者,联合取栓相比单纯药物治疗有更好的90 d神经功能预后和更好的血管再通率,但24 h梗死体积无显著差异。
发病超过6 h卒中取栓治疗的随机研究汇总分析(Analysis of Pooled Data from Randomized StUdies of ThROmbectomy MoRe than 6 hours After Last Known Well,AURORA),选取了3项取栓支架治疗的Ⅲ期临床试验DAWN、DEFUSE 3和缺血性卒中患者适合血管内治疗的灌注影像选择研究(PerfusiOn Imaging Selection of Ischemic STroke PatIents for EndoVascular ThErapy,POSITIVE)的全部数据,以及含有超时间窗患者的ESCAPE和REVASCAT试验中发病超过6 h的患者数据。初步分析显示对于发病超过6 h的急性卒中患者,支架取栓血管内治疗仍然非常有效。
综上所述,应用血管内治疗AIS有明确的证据支持。采用新一代取栓装置的随机试验中不同机械取栓装置的血管成功开通率均较高。精准的患者筛选方案及高效的血管内治疗技术是急性大血管闭塞患者行血管内治疗获益的关键。
2 急性缺血性卒中血管内治疗的临床应用
2.1 血管内治疗的目标
机械取栓的目的是获得血流再灌注而不是仅实现血管再通,实现再灌注是改善预后的关键。临床常以改良脑梗死溶栓分级(modified thrombolysis in cerebral infarction,mTICI)2b/3级作为评估有效再灌注的标准[38-39]。目前全部血管内治疗试验,无论支架取栓还是抽吸研究,均使用mTICI 2b/3级作为实现有效再灌注的评估标准[40]。使用球囊导管或中间导管也能够提高血管内治疗的开通比例[41-43]。提高血管内治疗后血流达到mTICI 3级的患者比例是否更有效及如何实现是未来研究的方向。
2.2 麻醉方案
在近期血管内治疗试验中镇静麻醉被广泛使用(ESCAPE中90.9%、SWIFT PRIME中63%),对于患者预后没有明确的有益或不良影响。MR CLEAN研究中,事后分析提示全身麻醉(general anesthesia,GA)组患者90 d良好预后(mRS 0~2分)率显著低于镇静(conscious sedation,CS)麻醉组患者[44]。THRACE研究中,67例GA患者中51例达到TICI 2b/3级,69例CS患者中43例达到TICI 2b/3级,麻醉方案对预后没有影响(P=0.059);90 d时,GA组67例患者有35例达到mRS 0~2分,CS组74例有36例达到mRS 0~2分[14]。尽管很多回顾性研究提示全身麻醉操作临床预后更差,但前瞻性随机研究数据有限,均未显示出哪种麻醉方案对临床主要终点有影响。中国关于血管内治疗急性缺血性卒中的多中心前瞻性研究(Endovascular therapy for Acute ischemic Stroke Trial,EAST)中的麻醉结果分析表明,前循环大血管闭塞患者取栓时全身麻醉与非全身麻醉的患者预后无显著差异。3项小型单中心RCT比较全身麻醉和镇静麻醉的治疗效果,均未发现两种麻醉方案孰优孰劣[45-47]。
通常临床实践中对伴有严重躁动、意识水平降低(格拉斯哥昏迷量表评分<8分)、呼吸道保护反射丧失、呼吸障碍的患者使用全身麻醉[21],能配合取栓的患者使用局部麻醉或镇静更为适合。麻醉方法本身可能并不影响患者预后,而是麻醉管理策略(药物选择、使用方法,麻醉持续时间和深度,术中循环、呼吸管理)影响预后,任何麻醉药物的使用都需要专业人员去管理。根据患者及手术具体情况,个体化选择麻醉方案更为合理。
2.3 桥接治疗
桥接治疗是指在静脉溶栓基础上进行动脉血管内介入治疗,分为直接桥接治疗和挽救性桥接治疗。直接桥接治疗是指静脉溶栓后不观察等待溶栓效果,直接进行取栓治疗;挽救性桥接治疗是指静脉溶栓后观察患者神经功能变化,无效后再进一步考虑取栓治疗。目前,对于静脉溶栓时间窗内的患者,静脉溶栓是首选的治疗方案,在早期关于取栓的5项阳性随机对照研究中,90%以上的患者均为静脉溶栓基础上进行机械取栓的桥接治疗。
HERMES研究表明,机械取栓组患者90 d致残率较低,且随着发病到开始动脉穿刺时间的延长而降低[36]。在通过血管内治疗获得再灌注的390例患者中,再灌注每延误1 h,均会造成致残率显著增加和良好预后率显著降低,但不改变死亡率[48]。这些数据不能直接表明在取栓前患者接受静脉溶栓治疗后是否应该观察临床反应。然而,90 d的致残率与发病到开始穿刺的时间直接相关,任何导致取栓延误的操作,包括静脉溶栓后观察临床反应,都应避免。
对于桥接治疗和直接取栓的临床效果,随机对照研究正在进行中。HERMES研究的亚组分析提示桥接治疗(n=1090)和直接取栓(n=188)对患者预后影响无差异(P=0.43),但直接取栓患者多数是因为有静脉溶栓禁忌[36]。SWIFT PRIME、Solitaire装置取栓对急性血管闭塞再通研究(Solitaire FR Thrombectomy for Acute Revascularisation,STAR)及其他一些非随机对照研究也提示直接取栓和桥接治疗效果相似,机械取栓之前静脉溶栓较单独机械取栓并没有提高临床获益[49-51]。有研究提示桥接治疗预后好,死亡率低,血管开通率高,取栓次数少,缩短取栓时间且不增加sICH风险[52-55]。桥接治疗是把双刃剑,虽然提高再通率,但可能促进远端血管栓塞[56](表2)。也有研究指出桥接治疗与直接取栓相比,良好功能预后及sICH率无差异,但桥接组无症状性颅内出血率及死亡率更高;颈内动脉闭塞亚组中桥接治疗组死亡率更高[57]。近期发表的缺血性卒中血管内治疗前应用替奈普酶最佳剂量(Determining the Optimal Dose of Tenecteplase Before Endovascular Therapy for Ischemic Stroke,EXTEND-IA TNK)研究,发病4.5 h内大血管闭塞的AIS患者,桥接治疗前使用替奈普酶静脉溶栓后,在取栓前的良好再灌注率显著高于应用阿替普酶组(22%vs10%,P=0.03),且替奈普酶组90 d mRS分值的中位数更优,两组sICH无差异,研究提示新型静脉溶栓药物提高了大血管闭塞取栓前血管开通比例,促进血流再灌注早期恢复,从而改善患者预后。
2.4 时间窗
MR CLEAN试验中的阳性结果为时间依赖性,OR值从发病3.5 h的3.0(95%CI1.6~5.6)下降到6 h的1.5(95%CI1.1~2.2)[9]。当再灌注发生在6小时19分钟后,治疗效果不再有统计学意义。在IMS Ⅲ研究中,取栓治疗同样显示出时间依赖性,恢复再灌注时间的增加与良好功能预后比例下降相关[58]。基于IMS Ⅲ的结果及近期文献,建议的血管内治疗比单纯静脉溶栓优越的时间窗为347 min内(5小时47分钟)[59]。5项RCT的发病-穿刺时间中位数均在6 h以内,提示早期治疗的必要性,证实发病到治疗时间窗在6 h内的合理性。HERMES研究表明,发病到开始穿刺时间在7小时18分钟内,取栓始终存在明显的获益[48]。DAWN和DEFUSE 3是证实发病在6 h以上取栓获益的RCT研究,将取栓获益的时间窗扩展到24 h[15-16]。选择患者时需要符合这两项研究的入组标准才能进行取栓。AURORA汇总分析的初步结果也为发病6~24 h患者取栓治疗获益提供了临床证据,经过适合的影像筛选,淡化了时间窗,也将卒中治疗理念从“时间就是大脑(Time is Brain)”向“不匹配就是大脑(Mismatch is Brain)”转变,但在急救流程中仍需要减少时间延误,缩短发病-再通时间。
2.5 大脑中动脉远端闭塞
HERMES协作组通过5大研究荟萃分析结果提示MCA M2段取栓治疗效果优于标准内科治疗,但校正后OR值无显著差异(1.28,95%CI0.51~3.21)[36]。Solitaire支架血栓切除术的安全性和疗效随机试验中患者数据的荟萃分析(Safety and Efficacy of Solitaire Stent Thrombectomy–Individual Patient Data Meta-Analysis of Randomized Trials,SEER)协作组对SWIFT PRIME、ESCAPE、EXTEND-IA和REVASCAT这4项应用Solitaire支架取栓的随机研究进行了荟萃分析,以评价Solitaire支架取栓的安全性和疗效,结果显示:MCA M2段闭塞机械取栓与标准内科治疗相比,临床疗效更好,但差异无统计学意义[60]。SolitairevsMerci装置治疗急性缺血性卒中研究(Solitaire With the Intention for Thrombectomy,SWIFT)、Solitaire装置取栓对急性血管闭塞再通研究(Solitaire FR Thrombectomy for Acute Revascularisation,STAR)、DEFUSE 2和IMS Ⅲ的结果提示,对于MCA M2段闭塞的患者,实现再灌注与良好预后密切相关(mRS 0~1分,OR2.2,95%CI1.0~4.7)[61]。因此,对于MCA M2/M3段闭塞行取栓治疗有潜在的获益性,但应权衡血管功能、临床症状、取栓操作难度,尽可能减少并发症风险。

表2 桥接治疗潜在的优点和缺陷
2.6 基底动脉闭塞
基底动脉闭塞有较高的发病率和死亡率,进行血管内治疗与单纯静脉溶栓相比的获益性,目前尚缺少RCT研究证实[62]。一项荟萃分析收集了45项急性基底动脉闭塞再灌注(包括静脉溶栓、动脉溶栓或血管内治疗)的研究(n=2056),结果提示减少死亡或依赖以及单纯减少死亡的NNT分别为3和2.5[63]。多项单中心小样本的回顾性研究显示,基底动脉取栓的良好预后率在27.8%~50%[64-70]。Karolinska医院的经验表明良好预后率为57%(95%CI37%~75%),治疗前没有急性梗死征象时良好预后率为73%(95%CI50%~89%),死亡率大约21%[71]。使用新一代设备的血管再通率超过75%,这与使用老一代设备的MERCI试验和multi-MERCI试验报道的血管再通率一致,但获益率更高[65,71-76]。
BASICS研究结果未显示出血管内治疗较静脉溶栓优越,可能与其使用老一代取栓装置有关[24]。急性缺血性卒中机械开通的国际多中心登记研究(International Multicenter Registry for Mechanical Recanalization Procedures in Acute Stroke,ENDOSTROKE)评估基底动脉行血管内治疗对临床预后的影响,结果显示mRS 0~2分的患者达34%,mRS 0~3分的患者达42%[77]。目前,BASICS中比较静脉溶栓联合6 h内取栓和单纯静脉溶栓治疗基底动脉闭塞效果的随机对照试验正在进行中。中国基底动脉闭塞血管内治疗试验(Basilar Artery Occlusion:Chinese Endovascular Trial,BAOCHE)旨在评价血管内治疗对缺血时间6~24 h的急性基底动脉闭塞患者的安全性及有效性,目前也正在进行中。
2.7 颈动脉狭窄串联病变
HERMES荟萃分析纳入1254例患者,有122例串联病变和1134例非串联病变患者,对串联病变行取栓治疗同样显著优于单纯药物治疗[36]。MR CLEAN研究中取栓组有30例(12.9%)颈动脉狭窄串联病变患者在急性期进行了支架置入,DAWN研究中纳入的患者仅允许使用颈动脉球囊扩张辅助取栓装置通过,而不包括颈动脉支架置入,DEFUSE 3研究中允许颈动脉支架置入[9,15-16]。THRACE研究中196例患者,有24例串联病变闭塞和172例非串联病变闭塞进行了取栓治疗,相比单纯rt-PA治疗均有获益性[14]。目前,对于颈动脉串联病变急性期是否放置支架仍有争议,主要权衡的是支架置入后出血和再闭塞风险[78]。有多个研究报道对串联病变行血管内治疗的技术成功性,但对于串联病变进行血管内治疗的最佳策略仍有待探讨[79-83]。对于狭窄较重需要进行支架置入维持血流的患者,操作顺序也有差异,先支架置入还是先行取栓,具体操作方式以及抗栓策略应结合具体病变、手术材料及操作经验行个体化选择。
2.8 颅内动脉闭塞合并原位狭窄
颅内大血管闭塞所致缺血性卒中患者中,合并基础狭窄的比例为17%~60%,其中最高比例为中国一项研究结果,也印证了颅内动脉粥样硬化性狭窄(intracranial atherosclerotic stenosis,ICAS)在亚裔人群中更为常见[84-86]。合并ICAS患者手术方式选择尚不明确,由于单纯支架取栓困难大、开通率低,常会选择血管成形术或支架置入术作为补救措施。中国血管内治疗的EAST研究结果表明,合并ICAS的比例为34%,有21.4%的取栓患者需要进行补救性球囊扩张或支架成形治疗,当取栓后原位狭窄>70%或狭窄影响远端血流或导致反复再闭塞时,通过补救性球囊扩张或支架成形能够获得较为满意的预后[87]。近期一项登记研究在取栓后高度怀疑ICAS病因及取栓后反复闭塞的患者中探讨补救性支架置入的有效性和安全性,结果显示补救性支架置入可使64.6%取栓开通失败的患者重新获得再通,并显著改善患者预后[88]。
3 急性缺血性卒中血管内治疗的影像评估
进行AIS血管内治疗病例选择时,除时间窗外,通过影像评估选择适合的患者是获得良好预后的关键。合适的影像评估方案可为AIS血管内治疗患者的术前筛选及术后评估提供指导。近期的研究之所以取得阳性结果,除了选用新一代取栓装置外,还应用影像学技术对患者进行了严格筛选,排除出血性病变、识别血管闭塞部位以及通过直接或间接征象评估梗死核心灶、缺血半暗带及侧支循环,以此识别通过取栓治疗可能获得良好预后的患者[7](表3)。
下面从影像学角度对大血管闭塞评估、梗死核心区域和缺血半暗带判定,以及侧支循环评价方面提出相应的建议,进而指导病例筛选。
3.1 大血管闭塞
快速精准地识别大血管病变患者,是顺利开展动脉取栓治疗的关键。对于院前急救而言,在没有影像学检查明确提示大血管闭塞的情况下,有必要通过临床表现初步判定患者是否可能为大血管病变,并决定患者是否应直接转运到就近有取栓能力的综合卒中中心。对于急诊到院的患者,也有必要根据临床表现来识别是否是卒中及大血管闭塞的可能性,在CT排除颅内出血后,进一步行其他血管影像学评估可更好地指导治疗决策[89]。表4为提示大血管闭塞的相关评分。
近期一项系统性综述评价了诊断大血管闭塞预测工具的准确性[90]。在急诊室神经科医师和急诊医师确定为缺血性卒中患者后,预测大血管闭塞的最有效工具为NIHSS评分。荟萃分析显示,NIHSS评分≥10分时达到最佳敏感性(73%)和特异性(74%)平衡;提高敏感性时(特异性会降低),NIHSS评分≥6分时有87%的敏感性和52%的特异性。使用大血管预测评分可能会错过一些大血管闭塞患者,较低的敏感性提示假阳性较为常见。
平扫CT(non-contrast CT,NCCT)能够通过血管改变(大脑中动脉高密度征)、脑组织形态学改变(脑肿胀:脑回增粗、脑沟变浅)或密度改变(局部脑实质低密度区:岛带征阳性、壳核低密度、灰-白质交界区变模糊)提示超急性期脑梗死。如需精准明确大血管闭塞,需要进行血管影像学检查,近期的取栓随机对照研究采用无创血管影像来确定大血管闭塞(表3)。由于血管内治疗的患者可能存在血管迂曲或路径无法到达颅内血管的情况,因此通过无创影像检查了解血管解剖及颅外血管有无夹层、狭窄以及闭塞,对血管内治疗方案的选择和明确患者是否适合治疗有重要意义。对于使用对比剂的急诊无创影像检查,观察性研究提示CTA检查导致的对比剂肾病非常少见,尤其是患者没有肾功能不全时,若等待急诊肾功能检查结果可能导致取栓时间的延误,因此没有必要等待肾功能检查结果[91]。在客观条件无法实施无创血管影像评估时,建议通过NCCT排除颅内出血后,如根据患者症状考虑为大血管闭塞,可快速进行全脑血管数字减影血管造影(digital subtraction angiography,DSA)评估血管闭塞情况及侧支循环代偿,选择适合的患者实施血管内治疗。

表3 8项急性缺血性卒中血管内治疗阳性试验的影像评估方案
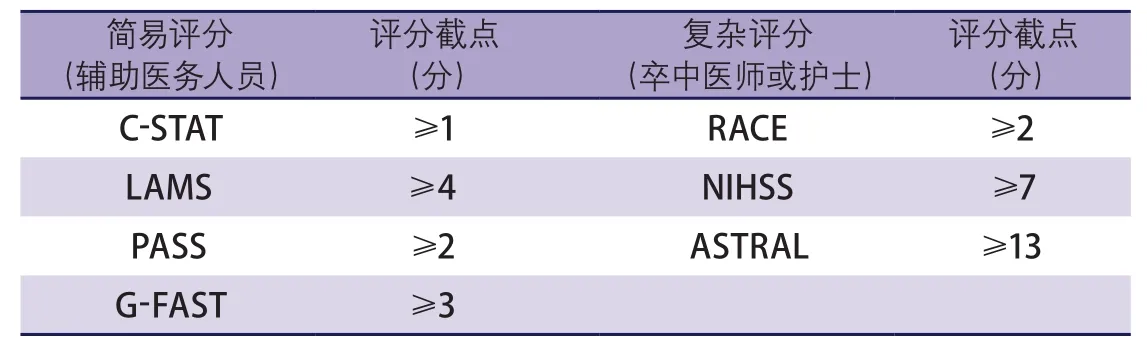
表4 预测急性缺血性卒中大血管闭塞的评分
3.2 梗死核心
梗死核心是发生不可逆性损伤的脑组织,DAWN和DEFUSE 3研究中使用的梗死核心定义为局部脑血流量下降至正常脑组织30%以下(<30%)的区域,在NCCT上显示为低密度区。梗死核心的大小与患者的临床预后密切相关,梗死核心越小,患者预后良好的可能性越大。有文献报道,与AIS患者良好预后相关的预测指标是梗死核心体积,而不是缺血半暗带。同时,评估梗死核心也可预测血管内治疗出现并发症的风险。因此,准确评价梗死核心有助于筛选出适合血管内治疗的卒中患者。
评估梗死核心大小的影像学指标主要为Alberta卒中项目早期CT评分(Alberta Stroke Program Early C T Score,ASPECTS),其次是梗死核心体积。对NCCT评估的ASPECTS评分其可靠性存在一定争议,且存在一定的时间依赖性,其超早期缺血性病灶检出率较低,而基于CTA、CTP及多模式磁共振成像(magnetic resonance imaging,MRI)的ASPECTS评分对缺血组织的敏感性较高。近期发表的这8项阳性结果临床试验,除了MR CLEAN和THRACE研究外,其余6项研究均对梗死核心有明确纳入标准(表3)。SWIFT PRIME试验中部分患者使用MRI排除了梗死核心区≥50 ml的患者,EXTENDIA试验应用CTP以<正常脑血流量的30%为临界值排除梗死核心区>70 ml的患者,通过影像学排除大面积梗死患者是这两项试验取得阳性结果的重要原因之一。计算ASPECTS评分可通过NCCT、CTP及MRI DWI,评估梗死核心体积可通过CTP、MRI DWI及灌注加权成像(perfusion weighted image,PWI)等。有研究显示,ASPECTS评分≥7分对应于梗死体积<70 ml,ASPECTS评分≤3分对应于梗死体积>100 ml。
对于发病超过6 h实施取栓的患者,DAWN和DEFUSE 3研究通过MRI DWI上的梗死区域或CTP上局部脑血流量下降至正常脑组织的30%以下(<30%)来计算梗死体积,DAWN研究允许入组的最大梗死体积为51 ml,DEFUSE 3研究在符合错配比基础上,允许入组的最大梗死体积为70 ml,当无法进行灌注评估时,在明确大血管闭塞后,DWI梗死核心体积<25 ml也作为适合取栓的标准。
有研究指出,经过适当筛选,梗死核心较大但合并较大可挽救组织者进行血管内治疗能显著减少最终梗死体积,有改善患者预后的倾向[92]。也有研究发现,DWI-ASPECTS评分较低(≤5分)的患者经过取栓治疗,较单纯药物治疗预后更佳,但需要进一步前瞻性随机对照研究证实[93-95]。
3.3 缺血半暗带
缺血半暗带为脑梗死核心灶周围由于脑血流灌注不足而导致神经功能受损的脑组织,但其细胞正常电活动仍可维持正常。急性大血管闭塞后脑组织的缺血区从外向内依次包括:①良性缺血区:可自行恢复功能的区域;②缺血半暗带区:除非积极有效的治疗,否则进展为不可逆损伤的区域,是临床治疗及研究的焦点;③梗死核心区。梗死核心和半暗带体积在临床预后上有独立的预测作用,在伴有大的半暗带体积时,血管再通治疗具有特别重要的作用[96-97]。
临床研究中,低灌注体积定义为脑血流达峰时间(Tmax)>6 s的区域体积,梗死核心定义为局部脑血流量下降至正常脑组织的30%以下(<30%)区域,不匹配量为低灌注体积减去梗死核心体积。不匹配率为低灌注体积/梗死核心体积。从表3的筛选方案可以看出,EXTEND-IA、REVASCAT、SWIFT PRIME和DEFUSE 3均采用缺血半暗带的概念筛选入组患者。DEFUSE 3要求缺血区/梗死区体积比≥1.8,缺血区与梗死区错配体积>15 ml,即可挽救的脑组织体积在15 ml以上。
因此,对于经筛选发病6 h以内、ASPECTS评分<6分、拟接受紧急再灌注治疗的患者,或发病超过6 h、拟接受紧急再灌注治疗的患者,建议完成CTP检查以明确梗死核心区和缺血半暗带体积。一站式CTA+CTP检查方案可缩短多模式CT的检查时间;对于无法完成CTP的卒中中心,可根据CTA源图像进行梗死核心和缺血半暗带的判断,也可通过MRI DWI+磁共振血管成像(magnetic resonance angiography,MRA)+PWI进行术前评估(表5)。
3.4 脑侧支循环
脑侧支循环是指当大脑的供血动脉严重狭窄或闭塞时,血流通过其他血管(侧支或新形成的血管吻合)到达缺血区,从而使缺血组织得到不同程度的灌注代偿。既往多项研究提示侧支循环的重要性,MR CLEAN、IMS Ⅲ试验亚组分析显示,侧支循环良好与取栓预后密切相关[98-99]。ESCAPE试验采用多时相CTA的侧支循环评估系统作为入组患者的影像筛选方案,排除侧支循环较差的患者[10]。
拟行血管内治疗的AIS患者,推荐完成代偿相关血管的脑血管造影,评估基线侧支循环状态,可应用美国介入和治疗神经放射学学会/美国介入放射学学会(American Society of Interventional and Therapeutic Neuroradiology/Society of Interventional Radiology,ASITN/SIR)侧支分级系统,协助预测血管内治疗的风险和获益;也可在治疗前对患者进行多时相CTA检查评估侧支循环的代偿程度,以进行危险度分层。对于评估侧支循环的分级量表,目前尚无统一的评估体系,各种评估量表的预测价值、信度和效度仍需进一步验证。在治疗前进行侧支循环评价是否会延迟治疗,以及是否可以通过基线侧支循环状态指导临床决策,仍需前瞻性临床研究证实。

表5 不同时间窗下筛选患者的影像方案推荐
4 急性缺血性卒中血管内治疗的围手术期管理
当前8项阳性R C T(M R C L E A N、ESCAPE、EXTEND-IA、SWIFT PRIME、REVASCATE、THRACE、DAWN、DEFUSE 3)经过严格入排标准筛选患者,但总体的90 d mRS 0~2分的比率仅为47.5%,而且死亡率为14.9%。因此,取栓治疗在符合严格筛选标准的情况下的有效性也不容乐观,但与单纯静脉溶栓相比,其对于大血管闭塞的治疗效果显而易见,在经过严格影像筛选的人群中能提高20%以上的良好预后。综上所述,在取栓治疗前要明确治疗的适应证和禁忌证,在不同时间窗内的治疗要符合相应研究的入排标准,严格筛选适合的患者,减少无效开通,最大限度地使患者获益。
4.1 术前准备与术中操作
结合患者发病时间窗及影像评估结果,在排除血管内治疗禁忌证后,可参考图1操作流程实施取栓治疗。
血管内治疗术前准备、术中操作、药物使用及术后评估可参考下列方案(该方案仅供参考,请根据中心具体条件及经验实施):
(1)患者能够配合时选择局部麻醉节省时间,如需要可使用清醒镇静。如估计患者若使用清醒镇静在术中配合较差或由于患者的疾病情况使用清醒镇静剂高危或气道情况高危,应使用全身麻醉。术前控制血压在180/105 mm Hg以下。术中肝素的使用剂量尚有争论,术中可以使用肝素盐水,但通常不肝素化,除非存在高凝状态或预期手术操作时间较长。
(2)股动脉穿刺后快速行颅脑DSA检查(建议5~10 min完成病变血管及能提供代偿血管的造影),评估病变闭塞情况、侧支循环代偿及操作路径。使用球囊导引导管、6F/8F普通导引导管或90 cm长鞘管通过股动脉上行至患侧动脉。使用0.014微导丝配合支架微导管穿过血栓到达闭塞远端位置。用少量对比剂超选择造影确认微导管的位置。根据闭塞血管管径及中心经验,推荐:管径>3 mm选择6 mm支架;管径<3 mm选择4 mm支架,也可先用4 mm无效时再用6 mm。用盐水冲洗微导管内对比剂后,将支架装置通过微导管送入。
(3)释放支架后造影评估支架位置及张开程度。
(4)支架到位后放置5~10 min,以使支架在血栓内完全张开。将充分张开的支架装置与微导管一起轻轻拉出体外,期间导引导管持续负压抽吸控制血流。支架张开锚定血栓后,也可在拉栓前去掉微导管,使用“裸导丝技术”提高近端抽吸效果。如联合使用抽吸导管或中间导管时建议进行双重抽吸,通过近端导引导管抽吸控制血流,远端抽吸导管或中间导管抽吸提高支架取栓效果。
(5)血管再通定义为所有可治疗血管血流达到mTICI≥2b级,再通时间定义为首次血流通畅时间。
(6)病因考虑为心源性栓塞时,术后可仅用单一抗血小板治疗,不用双联抗血小板治疗;考虑为大动脉粥样硬化形成时,建议术后24 h排除出血转化后给予双联抗血小板治疗。
(7)如果一开始微导丝通过后,支架微导管通过困难,可能在血栓形成部位存在动脉狭窄,可以更换0.014微导管尝试通过后超选择造影,明确系统位于血管真腔内后长导丝交换,撤出0.014微导管,用2 mm球囊进行血管成形术,造影观察成形术效果,如仍有血栓存在,使用0.021微导管通过进一步取栓。除非有反复闭塞或局部夹层,否则应将支架从狭窄处取出。
(8)如果在支架取栓后,发现闭塞部位有高度狭窄(>70%),有引起闭塞的风险,可采取以下治疗计划:重复不同角度血管造影,确认该狭窄不是血管痉挛或动脉夹层造成。使用Dyna-CT排除出血,准备进行颅内粥样硬化病变的颅内血管成形术或支架成形术,以改善远端血流,降低近期再次闭塞风险。40%~50%的残余狭窄是可接受的。

图1 急性缺血性卒中血管内治疗筛选及救治流程
(9)考虑动脉溶栓的患者,单纯动脉溶栓建议选择rt-PA或尿激酶,目前最佳剂量和灌注速率尚不确定,推荐动脉溶栓rt-PA 1 mg/min,总剂量不超过40 mg,或尿激酶1万~3万U/min,总剂量不超过100万U。静脉溶栓后的患者,动脉溶栓时rt-PA不超过30 mg或尿激酶不超过40万单位。造影显示血管再通或者对比剂外渗时,应立即停止溶栓。
(10)明确串联病变或原位狭窄病变,需要进行血管成形术时,可术前给予口服或鼻饲负荷量双联抗血小板治疗(阿司匹林300 mg+氯吡格雷300 mg),术后持续给予阿司匹林100~300 mg/d及氯吡格雷75 mg/d 1~3个月。也可术中使用糖蛋白Ⅱb/Ⅲa受体拮抗剂(替罗非班或依替巴肽),如使用替罗非班时,可首先通过静脉给药或联合导管内给药给予负荷剂量(0.4 μg/kg·min)持续30 min(总剂量不超过1 mg),后静脉泵入(0.1 μg/kg·min)维持24 h。如使用依替巴肽,可首先通过静脉或联合导管内推注135~180 µg/kg,继之持续静脉输注0.5~2.0 µg/kg·min,维持18~24 h。术后根据CT复查结果,在停止糖蛋白Ⅱb/Ⅲa受体拮抗剂治疗前4 h给予重叠双联抗血小板治疗。术后24 h应进行MRA或CTA检查评估靶血管的开通程度。
(11)建议术后即刻使用DSA机器行CT检查,并复查颅脑CT平扫。术后腹股沟血管穿刺位置常规止血包扎或缝合。在手术结束即刻,应评估患者NIHSS评分和血压情况,整个手术操作过程中建议收缩压控制在180 mm Hg以下,血管开通(mTICI 2b/3级)后建议收缩压控制在140 mm Hg以下。
(12)术后患者应收入神经重症病房密切观察,给予标准内科治疗,至少24 h心电、血压监护,24 h内复查头CT和脑血管影像检查[经颅多普勒(transcranial Doppler,TCD)、MRA、CTA或DSA],同时行神经系统全面体格检查(NIHSS)。
4.2 围手术期并发症及处理
4.2.1 出血转化
术后出血转化是AIS溶栓或血管内治疗的主要并发症之一。近期阳性结果试验中取栓组的sICH发生率为1.9%~7.0%。术后出血转化应与对比剂滞留相鉴别,对比剂滞留多无明显占位效应,由于血脑屏障破坏导致,多位于术前梗死区域,双能CT或MRI磁敏感加权成像(susceptibility weighted imaging,SWI)序列可以帮助鉴别,较为可靠的方式为取栓术后19~24 h复查CT影像,观察高密度区域变化,如为对比剂可见显著吸收。术后出血转化的原因可能与血管壁损伤、再灌注损伤、溶栓药物使用以及联合抗血小板、抗凝治疗有关。一般认为超时间窗、术前血压偏高(收缩压>180 mm Hg,舒张压>100 mm Hg)、脑CT已显示低密度改变的卒中患者接受溶栓或血管内治疗易发生出血转化并发症。术后出血转化的处理以外科治疗和对症处理为主,目的是控制颅内压、维持生命体征。可参考急性缺血性卒中脑出血转化处理原则。
4.2.2 血管穿孔
血管穿孔多由于导丝头端穿透动脉壁所致。导丝头端走行太远,头端位置不合适,路径迂曲后撤球囊、支架输送系统时导丝“前窜”穿破远端血管。如果路径不是非常迂曲,只要提供足够支撑力即可,导丝头端不需走行太远,可把导丝头端塑成“J”形,弓背前行减少出血风险。需要血管成形时,导丝头端应避免置于基底动脉尖、大脑中动脉分叉处等易于穿出部位,尽量置于一段较为平直的血管内;交换动作时一定注意观察导丝头端位置保持不动。如造影发现明确出血点,可采取减少血管灌注、中和肝素、急诊用弹簧圈或Onyx胶栓塞等处理措施。
4.2.3 血管破裂、穿支撕裂
闭塞血管管径较小,成角明显,支架取栓时,如牵拉力量过大或反复取栓操作易造成血管损伤或破裂出血。合并狭窄时,球囊、支架选择过大、快速扩张都易导致血管破裂;严重钙化病变、反复球囊扩张也可致血管破裂;路径迂曲,导丝、球囊、支架送入时导致血管移位过大,穿支撕裂出血;成角病变,球囊扩张、支架释放也可致穿支撕裂出血;导丝进入穿支引起穿支痉挛、暴力牵拉也会拉断穿支引起出血。治疗时选择合适的术式,术中需要熟练、精细、规范的操作。预扩球囊及球囊扩张支架应稍小于靶血管直径,压力泵缓慢加压,推荐亚满意扩张。转动扭控子时导丝头端摆动不好,回撤时有阻力,透视下导丝位置远离路图,提示导丝进入穿支,此时不可暴力牵拉导丝,否则可能拉断穿支。一旦血管破裂可立即充盈球囊进行封堵止血,必要时可考虑弹簧圈闭塞,也可选择开颅血管修补术或动脉夹闭术。
4.2.4 新发部位栓塞
取栓过程中栓子移位、碎裂,可能造成闭塞血管的邻近分支或次级分支血管栓塞。对于MCA M1远端栓塞,如同侧大脑前动脉存在,可使用中间导管跨越A1开口进行保护,在回拉血栓时能降低栓子脱落栓塞的风险。如果发生栓塞,对可能导致严重功能缺损的主干血管应积极干预,首选机械取栓方式。而对于MCA M3段以远、大脑后动脉P2段以远等功能意义不大且取栓装置不易到达的次级分支血管栓塞,或支架置入操作后远端血管分支闭塞等有较大操作难度的栓塞事件,可考虑不给予干预,或在评估出血风险后给予局部碎栓或动脉溶栓。
4.2.5 血管再闭塞
血管开通后再闭塞是AIS血管内治疗常见并发症,再闭塞和临床症状恶化相关,早期再闭塞预示远期预后不良,多见于动脉粥样硬化性中-重度血管狭窄伴发原位闭塞的患者。在机械取栓术后由于血管内膜损伤导致血小板聚集增多,脂质核心暴露导致血小板激活聚集、原狭窄并未解除导致血流速度减慢,栓子清除能力下降,这些情况下均易于发生再闭塞。在血管成形或支架置入的患者,由于抗血小板作用不充分,也可导致支架内血栓形成而致闭塞。溶栓联合抗血小板治疗可能会减少再闭塞的发生,但可能增加出血风险。术中应用血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂可减少再闭塞发生和治疗再闭塞,目前研究显示并未增加出血风险,但仍需根据病变情况谨慎使用。
4.2.6 高灌注综合征
高灌注综合征是指闭塞脑动脉再通后,缺血脑组织重新获得血液灌注,同侧脑血流量显著增加,从而导致脑水肿甚至颅内出血发生。高灌注综合征患者需要收住神经重症监护病房进行密切监护,给予适当镇静、有效控制血压、适当脱水治疗及其他相关并发症的预防,对合并有颅内血肿伴有占位征象者,必要时需要神经外科实施去骨瓣减压等处理。建议根据患者情况酌情处理。
4.2.7 血管痉挛
血管痉挛是导管、导丝等材料的机械刺激所致。血管痉挛可引起远端低血流状态,导致缺血事件发生。预防血管痉挛的常规措施是术前尼莫地平泵入,术中需注意导引导管位置不要过高,路径迂曲可配合中间导管,一般颈内动脉颅内段及MCA M1段治疗,导引导管置于颈内动脉C2段即可;后循环治疗,导引导管置于椎动脉V2段即可。如果出现导引导管处血管痉挛,需将导管回撤造影观察,尽量在较低位置完成手术。一般回撤导管、导丝,停止刺激后痉挛可迅速缓解。如出现不可恢复的血管痉挛时需应用球囊成形术或动脉注射钙离子通道阻滞剂。
4.2.8 动脉夹层
取栓过程中,如果血管局部存在重度狭窄,导管导丝通过时可能进入血管内膜下导致夹层发生。术中反复取栓操作,血管成角或支架选择过大,均容易对血管内膜造成损伤,也可能引起血管夹层。术中需注意仔细辨别血管真腔,小心操作减少夹层形成风险。局部狭窄的单纯球囊扩张更容易发生动脉夹层,发生率可达20%。预防措施应注意选择稍小的球囊,缓慢、轻柔地充盈和排空。一旦发生动脉夹层需要继续进行支架置入术,术后规范抗凝治疗。
4.2.9 其他并发症
应激性溃疡、心血管并发症、穿刺部位并发症、对比剂过敏、对比剂肾病等参照一般血管内治疗并发症处理方案。
5 指南推荐意见
5.1 血管内治疗方案推荐
(1)发病6 h内,符合以下标准时,强烈推荐机械取栓治疗:卒中前mRS 0~1分;缺血性卒中由颈内动脉或MCA M1段闭塞引起;年龄≥18岁;NIHSS评分≥6分;ASPECTS评分≥6分(Ⅰ类推荐,A级证据)。
(2)有血管内治疗指征的患者应尽快实施治疗,当符合静脉rt-PA溶栓标准时,应接受静脉溶栓治疗,同时直接桥接机械取栓治疗(Ⅰ类推荐,A级证据)。
(3)静脉溶栓禁忌的患者,建议将机械取栓作为大血管闭塞的治疗方案(Ⅰ类推荐,A级证据)。
(4)距患者最后看起来正常时间在6~16 h的前循环大血管闭塞患者,当符合DAWN或DEFUSE 3研究入组标准时,强烈推荐机械取栓治疗(Ⅰ类推荐,A级证据)。
(5)距患者最后看起来正常时间在16~24 h的前循环大血管闭塞患者,当符合DAWN研究入组标准时,推荐使用机械取栓治疗(Ⅱa类推荐,B级证据)。
(6)进行机械取栓时,建议患者到院至股动脉穿刺的时间在90 min以内,到院至血管再通的时间在120 min以内(Ⅱa类推荐,B级证据)。
(7)推荐首选支架取栓装置进行机械取栓(Ⅰ类推荐,A级证据);也可酌情首选使用当地医疗机构批准的其他取栓或抽吸装置(Ⅱb类推荐,B级证据)。
(8)机械取栓后,再通血管存在显著狭窄时,建议密切观察,如狭窄>70%或狭窄影响远端血流(mTICI<2b级)或导致反复再闭塞时,可以考虑血管成形术[球囊扩张和(或)支架置入](Ⅱb类推荐,B级证据)。
(9)大脑中动脉M2或M3段闭塞的患者,可以考虑在发病6 h内(至股动脉穿刺时间)进行机械取栓治疗(Ⅱb类推荐,B级证据)。
(10)大脑前动脉、椎动脉、基底动脉、大脑后动脉闭塞患者,可以考虑在发病6 h内(至股动脉穿刺时间)进行机械取栓(Ⅱb类推荐,C级证据)。
(11)发病6~24 h的急性基底动脉闭塞患者,可以考虑在影像检查评估后实施机械取栓;或者按照当地伦理委员会批准的血管内治疗随机对照试验进行(Ⅱb类推荐,B级证据)。
(12)发病24 h以上的大血管闭塞患者,机械取栓的获益性尚不明确(Ⅱb类推荐,C级证据)。
(13)卒中前mRS评分>1分,ASPECTS评分<6分或NIHSS评分<6分的颈内动脉或大脑中动脉M1段闭塞的患者,可以考虑在发病6 h内(至股动脉穿刺时间)进行可回收支架机械取栓,需要进一步随机试验证据证实(Ⅱb类推荐,B级证据)。
(14)在机械取栓过程中,建议达到mTICI 2b/3级的血流再灌注,以提高临床良好预后率(Ⅰ类推荐,A级证据)。
(15)缩短发病到血管内治疗后恢复再灌注时间与更好的临床预后密切相关,推荐在治疗时间窗内应尽早开通血管,以早期恢复血流再灌注(mTICI 2b/3级)(Ⅰ类推荐,B级证据)。
(16)在机械取栓过程中,推荐结合患者情况使用球囊导引导管或中间导管等材料以提高血管开通率(Ⅱa类推荐,C级证据)。
(17)在机械取栓过程中,可以考虑对串联病变(颅外和颅内血管同时闭塞)进行血管内治疗(Ⅱb类推荐,B级证据)。
(18)急性缺血性卒中患者血管内治疗时,推荐根据患者危险因素、操作技术特点和其他临床特征个体化选择麻醉方案,尽可能避免取栓延误(Ⅱa类推荐,B级证据)。
(19)急性缺血性卒中患者的血管内治疗应由多学科团队共同决定达成,包括至少一名血管神经病学医师和一名神经介入医师,应在经验丰富的中心实施机械取栓(Ⅱa类推荐,C级证据)。
(20)机械取栓时可以考虑应用血管成形、支架置入等补救措施,以使再灌注血流达到mTICI 2b/3级(Ⅱb类推荐,B级证据)。
(21)机械取栓时,可以在静脉溶栓基础上对部分适宜患者进行动脉溶栓(Ⅱa类推荐,B级证据);发病6 h内的大脑中动脉供血区的急性缺血性卒中,当不适合静脉溶栓或静脉溶栓无效且无法实施机械取栓时,严格筛选患者后实施动脉溶栓是合理的(Ⅰ类推荐,B级证据)。
5.2 患者筛选及评估推荐
(1)实施血管内治疗前,尽量使用无创影像检查明确有无颅内大血管闭塞(Ⅰ类推荐,A级证据)。
(2)发病3 h内NIHSS评分≥9分或发病6 h内NIHSS评分≥7分时,提示存在大血管闭塞(Ⅱa类推荐,B级证据)。
(3)无肾功能不全病史的患者,怀疑大血管闭塞且符合血管内治疗指征时,行CTA检查无需等待肌酐检测结果(Ⅱa类推荐,B级证据)。
(4)发病6 h内,推荐使用CTA或MRA检查明确有无大血管闭塞,可不进行灌注成像检查(Ⅰ类推荐,A级证据)。
(5)适合机械取栓的患者,进行颅内血管影像检查的同时行颅外颈动脉、椎动脉的筛查是合理的,可为制定血管内治疗计划提供信息(Ⅱa类推荐,C级推荐)。
(6)大面积梗死定义为CT或DWI影像的ASPECTS评分<6分或梗死体积≥70 ml或梗死面积>1/3大脑中动脉供血区。确定梗死体积和半暗带大小的影像技术适用于患者筛选,与血管内治疗功能性预后相关(Ⅱa类推荐,B级证据);梗死核心较大,但当与缺血半暗带组织错配较大时,进行取栓治疗可能是获益的(Ⅱb类推荐,C级证据)。
(7)距患者最后看起来正常时间在6~24 h的前循环大血管闭塞患者,推荐进行CTP、MRI DWI或PWI检查,帮助筛选适合机械取栓的患者,但是必须符合RCT证实的能带来获益的影像和其他标准才可以进行机械取栓治疗(Ⅰ类推荐,A级证据)。
(8)决定是否进行血管内治疗时,可以考虑参考脑侧支循环代偿情况(Ⅱb类推荐,C级证据)。
(9)高龄单纯性大血管闭塞患者可以选择血管内治疗(Ⅰ类推荐,A级证据)。
5.3 围手术期管理推荐
(1)机械取栓过程中及治疗结束后24 h内,推荐血压控制在180/105 mm Hg以内(Ⅱa类推荐,B级证据);取栓后血管恢复再灌注后,可以考虑将收缩压控制在140 mm Hg以下(Ⅱb类推荐,B级证据)。
(2)血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂能够治疗和减少血管闭塞机械开通后的再闭塞,提高再灌注率,但最佳剂量和灌注速率尚不确定,安全性和有效性需随机对照试验证实(Ⅱb类推荐,B级证据)。
(3)血糖超过11.1 mmol/L时可以考虑给予胰岛素治疗,血糖低于2.8 mmol/L时可以考虑给予10%~20%葡萄糖口服或注射治疗(Ⅱb类推荐,C级证据)。
(4)抗血小板治疗前应复查头颅CT排除颅内出血,抗血小板药物应在静脉溶栓后24~48 h开始使用(Ⅰ类推荐,A级证据)。
(5)静脉溶栓后及血管内治疗术中的抗凝治疗尚无定论,不推荐无选择的早期抗凝治疗,少数特殊患者,在谨慎评估风险获益比后可慎重选择(Ⅱb类推荐,C级证据)。
(6)对于心房颤动导致的急性缺血性卒中,在发病后4~14 d内开始口服抗凝治疗是合理的(Ⅱa类推荐,B级证据)。
(7)机械取栓开通血管后,不推荐扩容、扩血管治疗(Ⅲ类推荐,B级证据);血管内治疗术后脑灌注不足者,可以考虑在密切监测下行扩容治疗(Ⅱb类推荐,B级证据)。
(8)发病前己服用他汀类药物的患者,可继续使用他汀类药物(Ⅱa类推荐,B级证据);对于非心源性缺血性卒中患者,无论是否伴有其他动脉粥样硬化证据,推荐高强度他汀类药物长期治疗以减少卒中和心血管事件的风险(Ⅰ类推荐,A级证据)。
共同执笔者:
霍晓川 高峰
指南讨论组专家名单(按姓氏拼音排列):
David Wang 美国伊利诺伊州立大学Peoria医学中心
陈康宁 陆军军医大学西南医院
董强 复旦大学附属华山医院
高连波 中国医科大学附属第四医院
韩巨 山东大学附属千佛山医院
何俐 四川大学华西医院
胡波 华中科技大学同济医学院附属同济医院
刘丽萍 首都医科大学附属北京天坛医院
刘新峰 南京军区南京总医院
刘亚杰 南方医科大学深圳医院
陆正齐 中山大学附属第三医院
缪中荣 首都医科大学附属北京天坛医院
秦超 广西医科大学附属第一医院
帅杰 陆军军医大学新桥医院
王文志 北京市神经外科研究所
王伊龙 首都医科大学附属北京天坛医院
王拥军 首都医科大学附属北京天坛医院
吴伟 山东大学齐鲁医院
徐安定 暨南大学附属第一医院
徐运 南京鼓楼医院
许予明 郑州大学附属第一医院
杨弋 吉林大学第一医院
曾进胜 中山大学附属第一医院
赵钢 空军军医大学西京医院
赵性泉 首都医科大学附属北京天坛医院
赵振伟 空军军医大学唐都医院
郑洪波 四川大学华西医院
朱其义 临沂市人民医院
周盛年 山东大学齐鲁医院

