替格瑞洛对急性冠状动脉综合征患者PCI术后血小板功能的影响
唐艺加,黄慧,周咏梅,舒燕
作者单位:1 610072 成都,四川省医学科学院四川省人民医院心内科
急性冠脉综合征(ACS)是以冠状动脉粥样斑块破裂或侵袭,继发完全或不完全闭塞性血栓形成为病理基础的一组临床综合征,包括急性ST段抬高性心肌梗死(STEMI)、急性非ST段抬高性心肌梗死(NSTEMI)和不稳定性心绞痛(UA)。经皮冠脉动脉介入术(PCI)是临床上重建ACS患者血运的最佳方式,PCI术后需要常规应用抗血小板聚集药物,预防支架内血栓形成。临床上应用阿司匹林+P2Y12受体拮抗剂是目前PCI术后预防支架内血栓形成的主要方式,氯吡格雷是临床上较为常用的P2Y12受体拮抗剂,但长期临床应用发现[1,2],其存在起效缓慢、药物抵抗及对P2Y12受体不可逆抑制的缺点,导致停药后血小板功能恢复时间长。替格瑞洛作为一种新型的P2Y12受体拮抗剂,国外研究显示[3],其能够与P2Y12受体可逆性结合,克服了氯吡格雷起效缓慢、个体差异大的缺点,且不受CYP2C19基因型影响。目前替格瑞洛在我国应用尚处于起步阶段,临床研究较少,本研究旨在探讨替格瑞洛对ACS患者PCI术后血小板功能的影响,评估其安全性,为临床治疗提供客观依据,报告如下:
1 资料与方法
1.1 研究对象 选取四川省医学科学院四川省人民医院心内科于2015年3月~2016年8月收治的接受冠状动脉造影确诊为ACS并行PCI的患者98例,其中男性61例,女性37例,年龄51~73岁,平均年龄(62.4±8.7)岁,纳入标准:均符合《2007年ACC/AHA冠心病诊断分型指南》中ACS的诊断标准[4];冠状动脉造影显示至少存在一处狭窄需要接受PCI治疗;首次发病;PCI治疗在发病后12 h内完成;患者及家属知情同意并签署同意书;术后坚持服药并定期复查;排除标准:存在本研究使用药物禁忌症者;近1月内有外科手术史、严重创伤史者;近期应用糖皮质激素或非甾体类抗炎药物者;高血压未控制者(收缩压>180 mmHg或舒张压>110 mmHg,1 mmHg=0.133kPa);纽约心功能分级(NYHA)Ⅳ级及血流动力学不稳定者;存在严重的肝肾功能障碍者;其他不适合参加本研究情况。本研究上报医院伦理委员会并获得批准。采用前瞻性随机对照方式,按照随机数字表法分为观察组和对照组,每组各49例。
1.2 方法 患者入院后均给予抗凝、稳定斑块、调脂、控制血压等基础治疗,术前对照组首次给予阿司匹林肠溶片(德国拜耳公司)负荷量300 mg,硫酸氢氯吡格雷片(商品名:波立维,赛诺菲杭州有限公司,国药准字:J20130083)300 mg,术后给予阿司匹林肠溶片100 mg/qd+氯吡格雷75 mg/qd维持;术前观察组首次给予阿司匹林肠溶片负荷量300 mg,替格瑞洛(商品名:倍林达,阿斯利康制药公司,国药准字:J20130020)180 mg,术后给予阿司匹林肠溶片100 mg/qd+替格瑞洛90 mg/bid维持,两组患者均观察治疗12个月。
1.3 检测指标 分别于术前、术后24 h、7 d、28 d时间点抽取患者空腹静脉血5 ml,置于EDTA管中,在18℃~25℃下保存。①采用PL-11血小板聚集分析仪检测患者血小板最大聚集率(MPAR);采用VerifyNow抗血小板治疗监测系统配套光路质控板,检测P2Y12反应单位(PRU);②血小板VASP磷酸化水平测定:试剂盒购自法国STAGO北京代理公司(货号 8133),严格按照说明书步骤进行,将血样分为T1、T2、T3,分别加入前列腺素E1(PGE1)、二磷酸腺苷(PGE1+ADP)温浴后加入鼠单抗隆抗体、阴性质控抗体和染色剂等,处理后标本2~8℃保存,2 h内通过流式细胞术在流式细胞仪(BeckmanEPICSXL,美国)进行分析每管血小板VASP磷酸化水平;根据计算公式计算出血小板反应指数(RI)=[MFIc(PGE1)-MFIc(PGE1+ADP)]/MFIc(PGE1)×100%。③研究指出[5],有效的血小板抑制率为PRI<50%,PRI≥50% 认为有缺血风险。因此本研究记录两组患者各时间点PRI≥50%例数。
1.4 不良事件 随访12个月,记录两组患者出现不良心血管事件(心源性死亡、再发心梗、支架内血栓形成、靶血管重建)及主要出血事件(脑出血、消化道大出血、血红蛋白下降≥3 g/dl),以及次要出血事件(穿刺部位血肿、皮肤黏膜出血、鼻出血)的发生情况。
1.5 统计学分析 采用SPSS 23.0软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例/百分比表示,组间比较采用χ2检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组基线资料比较 两组患者在性别、年龄、基础疾病、ACS临床分型等基线资料方面比较差异无统计学意义(P>0.05),具有可比性(表1)。
2.2 两组治疗前后血小板聚集功能比较 术后24 h、7 d、28 d观察组MPAR及PRU均显著低于对照组,差异具有统计学意义(P<0.05)(表2)。
2.3 两组不同时间点PRI值比较 术后24 h、7 d、28 d观察组PRI水平明显低于对照组,且PRI≥50%例数明显低于对照组,差异具有统计学意义(tPRI%=12.002,11.934,12.581,χ2PRI≥50%例数=38.017,17.878,13.303,P均<0.05)(表3)。
2.4 两组患者随访结果比较 随访1年,观察组MACE发生率明显低于对照组(10.20%vs.34.69%),差异具有统计学意义(χ2=8.440,P<0.05);观察组主要出血事件低于对照组,次要出血事件高于对照组,差异无统计学意义(P>0.05)(表4)。
3 讨论
ACS患者血液本身处于高凝状态,植入体内的支架作为异物会刺激活化血小板在局部黏附、聚集并激活凝血系统形成血栓,引发不良心血管事件。预防ACS患者PCI术后支架血栓形成及不良心血管事件是近年来研究的热点问题,为了预防PCI术后支架内血栓形成,降低远期再狭窄率,术后常需进行抗血小板治疗。氯吡格雷是常用的二代抗血小板聚集药物,其与血小板膜上的P2Y12受体特异性的结合,发挥拮抗血小板聚集作用。随着氯吡格雷在临床的广泛应用,其使用缺点也逐渐显现:首先其必须在肝脏内经CYP同工酶生物转化为有活性的代谢产物,才能发挥生物学效应,由于CYP2C19的基因多态性,部分患者达不到满意的抗血小板聚集效果[6];其次,约有25%~40%的ACS患者会出现氯吡格雷抵抗或低反应[7];再者,氯吡格雷与P2Y12受体结合为不可逆性质,停药后短时间内血小板功能达不到正常水平,增加了出血的风险[8]。随着抗血小板聚集药物研究的不断深入,替格瑞洛作为一种新型的抗血小板药物已得到了国外越来越多医疗机构的认可,其在体内发挥抗血小板聚集作用更快,稳定性更好,能够弥补氯吡格雷个体差异大,出血风险高的缺点[9,10]。由于其在国内应用尚处于起步阶段,替格瑞洛对PCI术后患者血小板功能的影响及安全性是临床医生研究的热点。
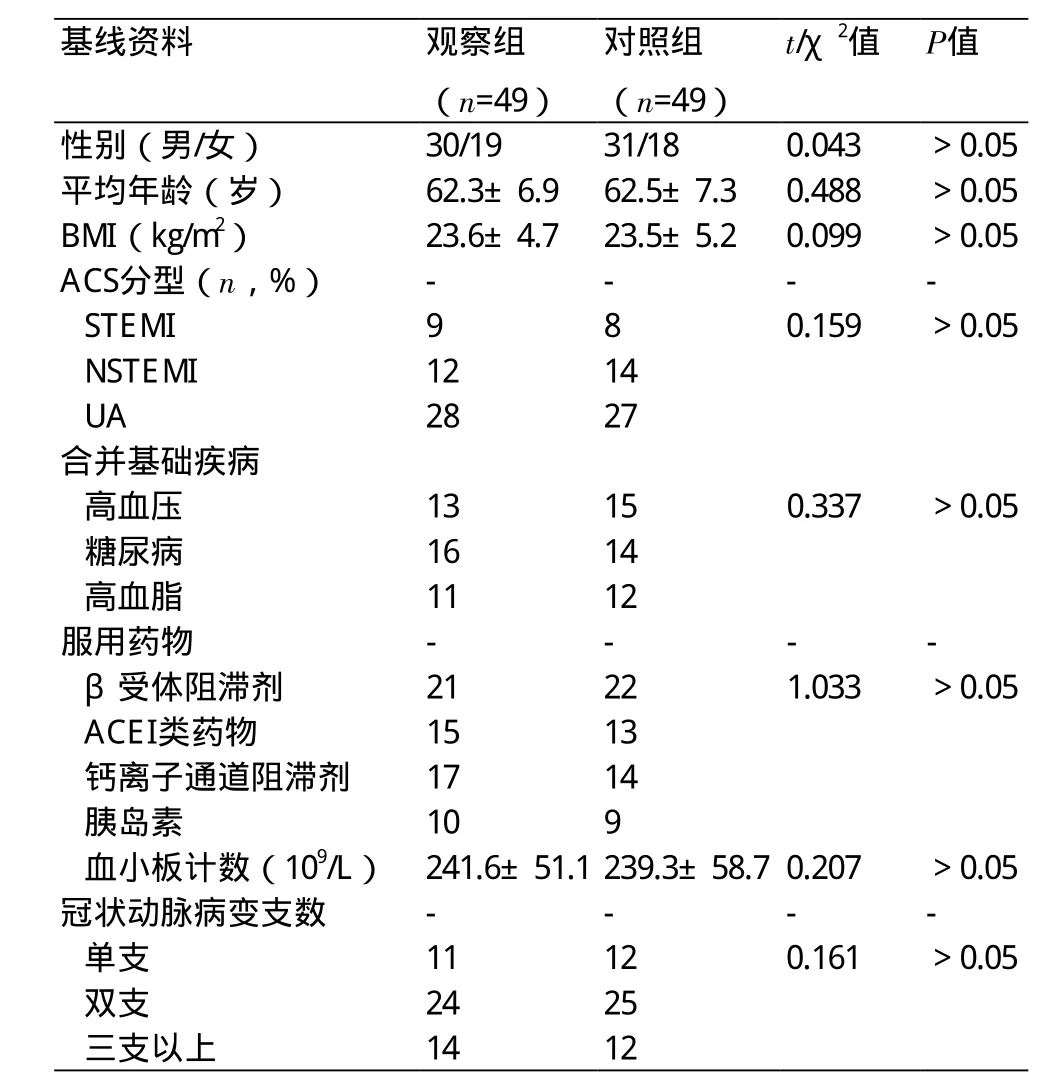
表1 两组患者基线资料比较
表2 两组患者血小板聚集功能比较(±s)
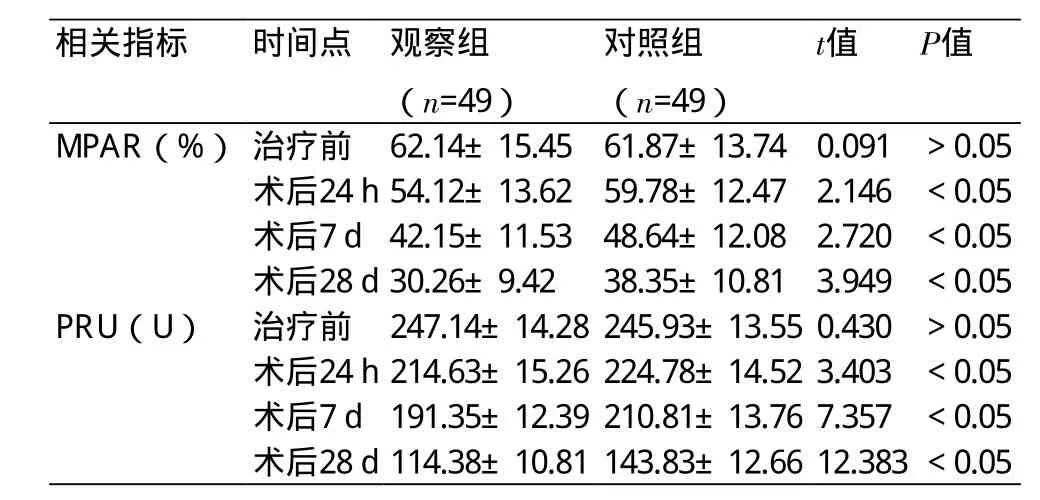
表2 两组患者血小板聚集功能比较(±s)
注:MPAR:血小板最大聚集率;PRU:P2Y12反应单位
相关指标 时间点 观察组(n=49)对照组(n=49)t值 P值MPAR(%) 治疗前 62.14±15.4561.87±13.740.091 >0.05术后24 h54.12±13.6259.78±12.472.146 <0.05术后7 d42.15±11.5348.64±12.082.720 <0.05术后28 d30.26±9.4238.35±10.813.949 <0.05 PRU(U) 治疗前 247.14±14.28245.93±13.550.430 >0.05术后24 h214.63±15.26224.78±14.523.403 <0.05术后7 d191.35±12.39210.81±13.767.357 <0.05术后28 d114.38±10.81143.83±12.6612.383<0.05

表3 两组患者不同时间点PRI值比较
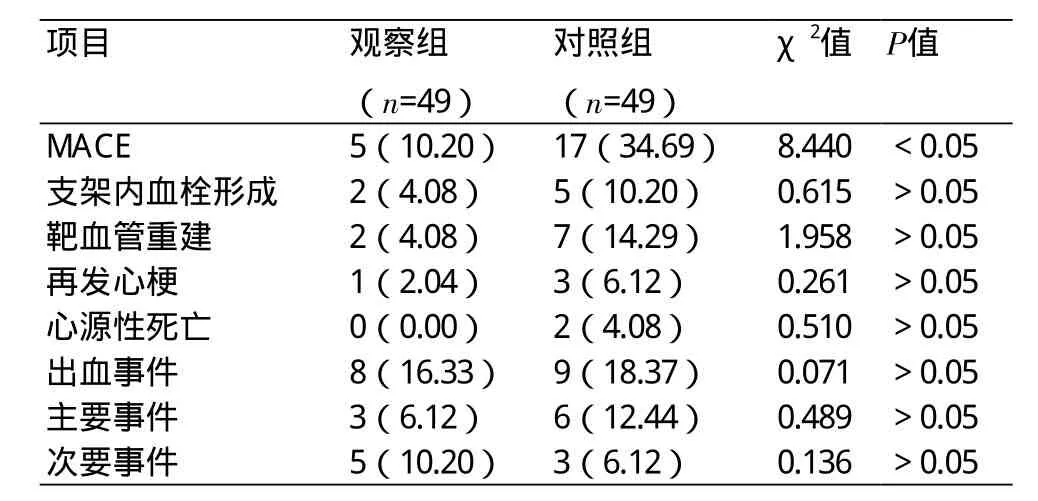
表4 两组患者术后MACE及出血事件发生情况比较(n,%)
P2Y12受体主要分布在血小板膜上,属于视紫红质G蛋白偶联受体,替格瑞洛作为环戊基三唑嘧啶类药物,是一种非噻吩吡啶类抗血小板药物,其能够与P2Y12受体可逆性的结合,且无需经肝脏代谢酶生物转化,其具有活性的代谢产物也同样具有抗血小板聚集作用[11]。本研究表2中看出,术后24 h、7 d、28 d观察组MPAR及PRU均显著低于对照组(P<0.05);MPAR越低证明抗血小板聚集作用越好,而PRU是反映P2Y12受体接受外界刺激的大小,PRU越低,说明血小板受到的聚集因素越少。分析认为替格瑞洛相比于氯吡格雷具有以下优点:①与P2Y12受体可逆性的结合,不会造成受体构象永久性改变,停药后血小板聚集功能可迅速恢复,降低出血风险[12];②其在体内能迅速被吸收、起效更快,作用持久[13]。
血小板内血管扩张剂激磷蛋白(VASP)是位于血小板内的激动蛋白,其磷酸化水平受到cAMP和cGMP的调控,当ADP与P2Y12受体结合后,导致细胞内腺苷酸环化酶增多,导致cAMP合成减少,VASP磷酸化水平降低,促进血小板聚集,而当P2Y12受体拮抗剂与P2Y12结合后,则逆转上述变化。通过流式细胞仪检测VASP磷酸化水平并计算出的PRI能够有效预测缺血和出血事件的风险。本研究结果显示,术后24 h、7 d、28 d观察组PRI水平明显低于对照组,且PRI≥50%例数明显低于对照组,与魏小云等[14]研究一致;研究表明[15],强效的P2Y12受体抑制剂能降低PCI术后缺血事件的发生风险,但过高会增加出血风险,当PRI≥50%时有缺血风险,PRI≤16%时会增加出血风险。
临床经验表明[16,17],传统的氯吡格雷联合阿司匹林双抗血小板治疗受到遗传因素、细胞因素等影响,血小板反应性个体差异较大,部分患者存在血小板高反应(HTPR),而HTPR是增加PCI术后MACE的主要危险因素。国外学者研究表明[18],HTPR可能与ACS患者合并糖尿病、体质指数过高或服用某些药物有关;替格瑞洛相比于氯吡格雷能够抑制红细胞对腺苷的再摄取,增加血浆内腺苷浓度,对抑制血小板聚集起到一定作用,且其停药后消退快,降低了HTPR的发生[19]。但也有研究报道[20],部分服用替格瑞洛的患者也存在血小板抑制率低和个体反应不敏感情况。本研究结果显示,随访1年,观察组MACE发生率明显低于对照组(P<0.05),但两者出血事件并无明显差异,证实了口服替格瑞洛可降低PCI术后MACE发生率。
本研究从PRU和VASP受体层面探讨了替格瑞洛在ACS患者PCI术后抗血小板聚集的效果及评估其安全性,但我们仍需看到本研究存在的局限性:①样本量较小,科学性有限,后期仍需大样本随机对照研究进一步论证此结果;②随访时间短,后续需增加3年、5年随访情况;③替格瑞洛价格昂贵,在临床应用过程中需要根据患者实际情况选取合适的治疗方案。
综上所述,ACS患者术后应用替格瑞洛治疗相比于氯吡格雷对血小板拮抗作用更佳,能够降低MACE发生率,且不增加出血事件发生率。

