贝伐单抗对兔耳损伤模型增生性瘢痕形成的影响
彭慧子,张玉蓉,苗常青
(1西安交通大学第一附属医院整形美容科,西安 710061;2西安交通大学第一附属医院神经内科;3西安交通大学第一附属医院急诊科;*通讯作者,E-mail:mcqfree@163.com)
目前治疗增性性瘢痕主要采用类固醇注射、放疗、激光和外用硅凝胶等方法[1]。由于增生性瘢痕形成过程复杂,一种治疗方法只能干扰增生性瘢痕形成的某一环节,因而需要联合应用,才能取得好的效果。血管生成对于伤口愈合至关重要。许多研究表明,过度血管生成会导致瘢痕形成,而且增生性瘢痕中新生毛细血管明显多于一般瘢痕[2,3]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是血管生成的关键因素,病理性瘢痕中VEGF表达及血管数量均高于正常皮肤[4]。此外,眼部纤维化疾病及风湿性疾病患者中VEGF表达均增高[5]。贝伐单抗是一种抗VEGF单克隆抗体,在眼科研究中已经证实,贝伐单抗具有抗血管生成作用[6]。抗VEGF药物也可有效抑制瘢痕的形成[7],但是对增生性瘢痕形成影响还没有相关报道。因而,本研究旨在评估贝伐单抗对兔耳损伤模型增生性瘢痕形成的影响,为临床上抗VEGF治疗增生性瘢痕奠定实验基础。
1 材料与方法
1.1 实验动物
8周龄雌性新西兰白兔10只,体质量2 400-2 600 g,购于西安交通大学实验动物中心,合格证号:医动字第07-002号。动物在室温下自由饮食和饮水。
1.2 主要试剂
贝伐单抗(瑞士罗氏制药公司),抗CD31抗体(美国Sigma公司),VEGF酶联免疫吸附试剂盒(上海内含子生物科技有限公司),HE染料(美国Sigma公司),马松三色染色试剂盒(上海博谷生物科技有限公司)。
1.3 兔耳损伤模型制备
根据文献[8]的方法制备兔耳增生性瘢痕模型,经兔耳缘静脉注射1%戊巴比妥钠麻醉,避开双耳腹侧大血管,用手术刀在兔耳腹侧面远离耳根部少毛区制备直径约6 mm的圆形孔,每只兔耳制备4个孔,孔间隔约1.5 cm。圆孔去除皮肤和皮下软组织,并剥离软骨膜,暴露创面,待其自然愈合。于打孔后第2天开始在左侧兔耳瘢痕内注射贝伐单抗(0.2 ml/5 mg),为贝伐单抗组;右侧瘢痕内注射等量生理盐水做为对照,1次/2 d,共7次,直到第14天。
1.4 VEGF水平检测
在兔耳损伤模型后第10天,选择2只兔,收集每只兔子两耳增生瘢痕组织,用PBS冲洗,采用RIRP裂解缓冲液提取蛋白,然后混合液经10 000 r/min离心10 min,按照酶联免疫吸附试剂盒的说明,检测上清液中VEGF含量。
1.5 组织学分析
兔耳损伤模型后第40天,选择6只兔,收集每只兔子两耳增生瘢痕组织,10%福尔马林固定,石蜡包埋切片,3只兔子分别进行HE染色和马松三色染色。
1.6 瘢痕增生指数(SEI)分析
HE染色兔耳增生瘢痕组织,低倍镜下采用计算机图像分析系统,分别检测创面后真皮厚度和相临正常组织真皮厚度,计算SEI[9]。SEI=(兔耳腹面瘢痕处皮肤厚度-邻近正常组织皮肤厚度)/邻近正常组织皮肤厚度。
1.7 毛细血管数评估
在兔耳损伤模型后第40天,提取剩余2只兔子两耳增生瘢痕组织,采用CD31抗体对瘢痕组织切片进行免疫组化标记,高倍镜下随机选取5个视野,用计算机图像分析系统计数每个视野下CD31染色血管数,直径≤50 μm血管被视为毛细血管,求其平均数作为该标本毛细血管数。再按Weidner方法,计算出组织切片中每平方毫米毛细血管数[10]。
1.8 统计学分析
实验数据用SPSS 20.0统计软件分析,数据以均数±标准差表示。贝伐单抗和对照组比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 兔耳损伤创面组织学变化
兔耳损伤模型后2周,兔耳所有缺损愈合,上皮形成。两组间创面愈合时间无统计学差异。HE染色表明,与对照组比较,贝伐单抗组瘢痕高度较低,瘢痕表面较规则(见图1);马松三色染色表明,贝伐单抗组胶原纤维呈规则和疏松分布,而对照组胶原纤维呈杂乱和致密分布(见图2)。
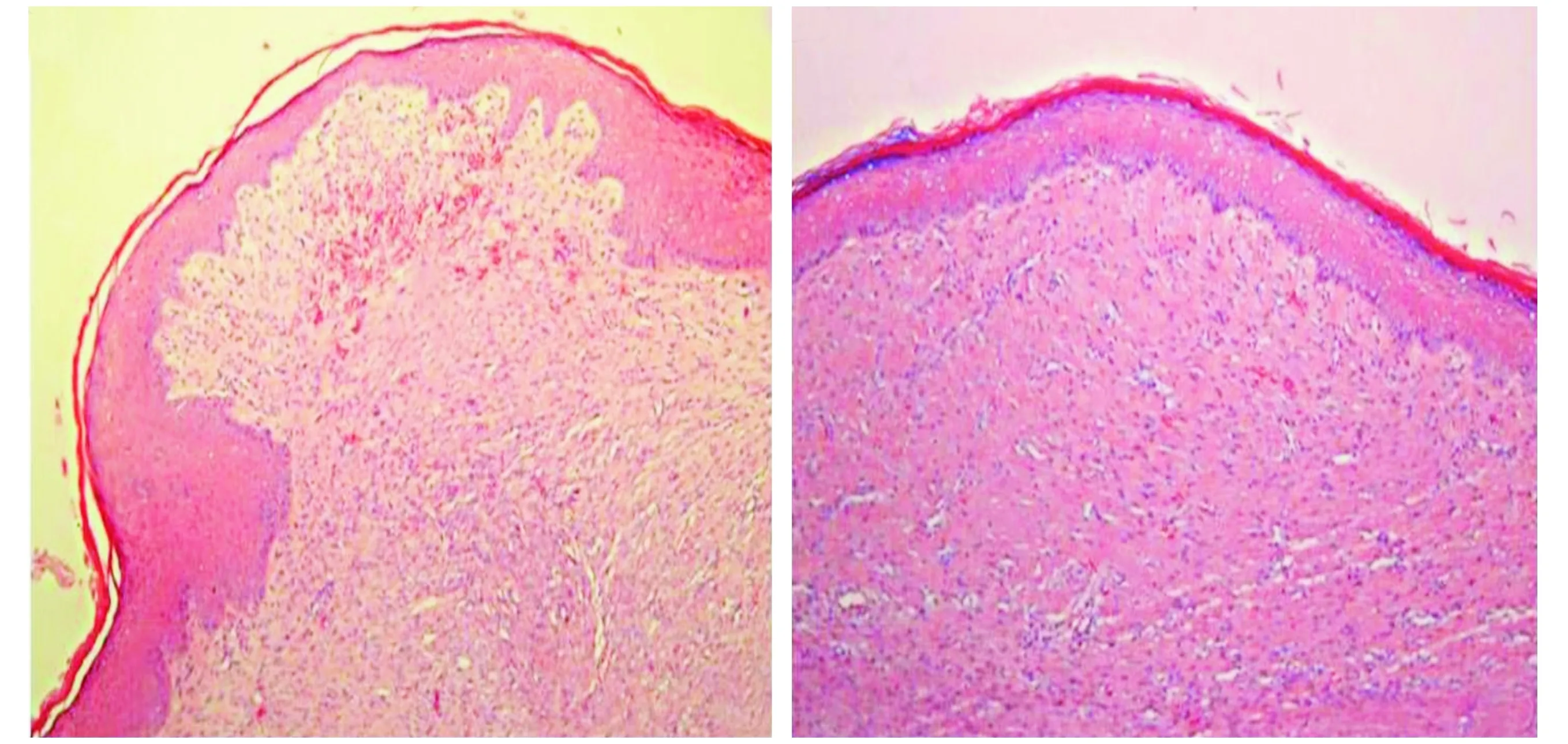
A. 对照组 B. 贝伐单抗组图1 两组兔耳瘢痕表面组织学分析 (HE染色,×100)Figure 1 Histological analysis of rabbit ear scar surface in two groups (HE staining,×100)
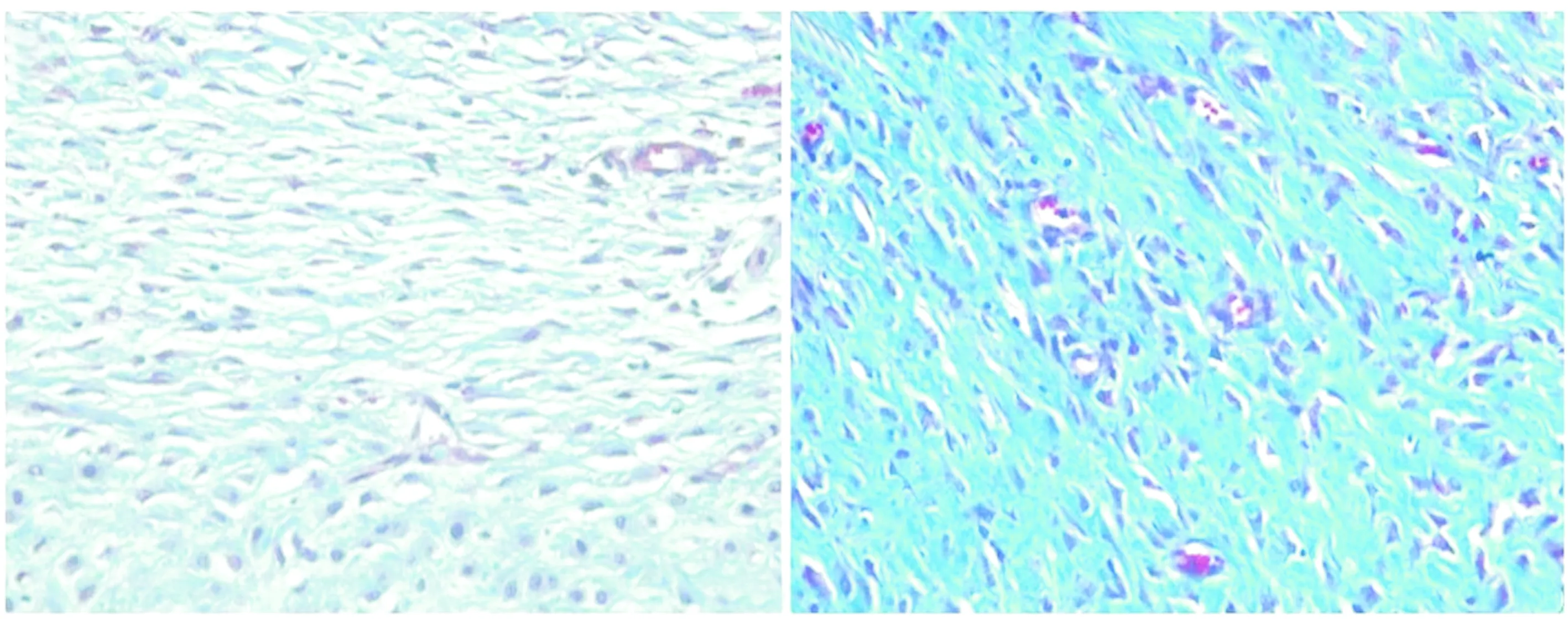
A. 对照组 B. 贝伐单抗组图2 两组兔耳胶原分布组织学分析 (马松三色染色,×400)Figure 2 Histological analysis of the distribution of collagen in rabbit ears in two groups (Masson,×400)
2.2 兔耳增生瘢痕组织SEI变化
兔耳损伤模型第40天,贝伐单抗组SEI是1.85±0.14,对照组是1.98±0.15,贝伐单抗组SEI显著低于对照组(P=0.004)。
2.3 兔耳增生瘢痕组织VEGF表达水平
兔耳损伤模型第10天,贝伐单抗组VEGF表达水平是(38.75±11.02)pg;对照组是(82.54±21.62)pg,贝伐单抗组显著低于对照组(P=0.001)。
2.4 兔耳增生瘢痕组织毛细血管数量
兔耳损伤模型第40天,贝伐单抗组毛细血管数量是7.25±1.23;对照组是8.52±0.79,贝伐单抗组毛细血管数量明显低于对照组(P=0.006,见图3)。

A. 对照组 B. 贝伐单抗组图3 兔耳增生瘢痕毛细血管分布 (免疫组化染色,×40)Figure 3 Capillary distribution of rabbit ear hypertrophic scars in two groups (HE,×40)
3 讨论
增生性瘢痕形成与多种因素相关,采用多种治疗方法才能达到理想的效果。目前,常用治疗方法存在全身不良反应、治疗周期长及复发等缺点,迫切需要新的治疗方法。
糖尿病视网膜病变是由新生血管形成过多引起的视网膜纤维化,贝伐单抗可抑制血管生成,因而可用于治疗糖尿病视网膜病。由于瘢痕形成实质上是纤维化过程,所以贝伐单抗也可用于抑制瘢痕的形成。瘢痕形成是伤口愈合阶段的正常过程,但增生性瘢痕和瘢痕疙瘩是创伤愈合后形成的病理状态。
有研究表明,抗VEGF类药物可减少瘢痕形成[11]。本研究主要观察抗VEGF类药物贝伐单抗对增生性瘢痕,而不是正常瘢痕形成的影响。在以往白兔模型中,贝伐单抗的使用剂量在1.25-3.75 mg之间。兔模型结膜下注射3.75 mg贝伐单抗可有效抑制血管生成,且不影响角膜上皮化或创面愈合[12]。尽管目前尚无皮肤和眼内组织耐受性差异的研究,但由于皮肤作为正常的屏障,其对贝伐单抗的耐受应高于眼内组织。因此,本研究中贝伐单抗剂量高于以往常规用量。以往研究已经证实,正常瘢痕和增生性瘢痕血管数量存在差异[3]。增生性瘢痕中VEGF水平明显增高,导致血管生成过度[4]。
血管生成对于伤口愈合至关重要。在本研究中,兔耳模型第10天提取增生瘢痕组织,结果表明,贝伐单抗局部注射能有效降低瘢痕组织中VEGF水平;兔耳模型第40天提取增生瘢痕组织,结果表明,贝伐单抗注射能减少瘢痕组织中毛细血管数量。贝伐单抗可能通过降低瘢痕组织中VEGF水平,导致血管生成减少,从而阻止增生性瘢痕形成。
增生性瘢痕主要是影响美观,特别是血流增强引起的红斑。在一项研究中,抗VEGF治疗可使增生性瘢痕微循环灌注减少,与其他瘢痕治疗方法相比,抗VEGF治疗效果可能更明显[13]。正常瘢痕与增生性瘢痕最明显的区别在于表皮厚度。在本研究中,贝伐单抗治疗的瘢痕组织SEI较低,表明贝伐单抗治疗可减少瘢痕厚度。在多种纤维化疾病中,VEGF水平增高[14,15]。本研究结果表明,贝伐单抗组胶原纤维呈规则和疏松分布,而对照组胶原纤维呈杂乱和致密分布,此结果提示,贝伐单抗治疗也可影响纤维化形成。
总之,本研究结果表明,在兔耳损伤模型局部注射贝伐单抗可有效抑制血管过度生成,从而阻止增生性瘢痕形成。应对贝伐单抗的作用机制及不良反应进行研究。

