儿童特发性高嗜酸粒细胞增多综合征一例及文献复习
王晶瑶,赵煜
特发性高嗜酸粒细胞增多综合征(idiopathic hypereosinophilic syndrome,IHES)是一组病因不明,以骨髓、外周血和组织中嗜酸性粒细胞增多为特点,并累及多器官的疾病,尤其以心脏、肺、皮肤和中枢神经系统受累最常见[1]。IHES好发于中年男性[2],预后较差;儿童罕见,儿童IHES的真实发病率尚不清楚[3],并且女童患该病更加罕见。现报告1例以消化道症状就诊,且合并多器官受损的IHES女性患儿,并回顾相关文献及国内的个案报道。
1 病例报告
患者 女,8岁。急性起病,主因腹胀伴腹泻5 d,于2017年2月28日入院。现病史:患儿于入院前5 d出现腹胀,进食后为著,排气、排便后无改善,偶伴腹痛,为全腹轻度胀痛,持续数分钟后缓解。伴有腹泻,为黄色稀便,3次/d,不伴有黏液脓血便。无发热、寒战、皮疹、抽搐、黄疸,尿量增多。患儿入院前1周曾因尿频、尿急、尿痛于本院门诊就诊,诊断为“泌尿系统感染”,口服头孢类抗生素3 d后好转。否认食物及药物过敏史。否认家族遗传病史。
入院查体:体温37.7℃,脉搏100次/min,呼吸22次/min,血压105/60 mmHg(1 mmHg=0.133 kPa),体质量38.5 kg,双肺呼吸音低,未闻及干湿性啰音,心律齐,腹膨隆,腹围70 cm,全腹未及压痛,肝脾未触及,移动性浊音(+)。入院当日门诊查血常规示白细胞计数33.18×109/L,中性粒细胞0.26,淋巴细胞0.20,单核细胞0.04,嗜酸细胞0.50,嗜酸性粒细胞计数20.64×109/L,血红蛋白134 g/L,血小板计数619×109/L。胸腹X线平片:心肺膈肌未见异常,腹部未见异常。腹部B超示:腹水(大量),腹腔局限性肠壁增厚,膀胱壁增厚。肝胆胰脾未见异常,未见肠套叠。
初步诊断:(1)腹胀原因待查。(2)嗜酸细胞增多症。(3)上呼吸道感染。
入院后完善胸腹部CT及胸腔、腹腔、骨髓穿刺及化验等各项检查。腹CT:小肠肠壁增厚、肿胀,肠系膜脂肪密度增高伴多发肿大淋巴结影,腹、盆腔及胸腔大量积液,膀胱壁增厚。胸CT:左肺上叶及双肺下叶炎性实变,双侧胸腔积液。尿常规示:尿蛋白2+,酮体4+,镜检红细胞1~3个/高倍视野,白细胞3~4个/高倍视野,上皮细胞1~3个/高倍视野。多次尿培养无菌落生长。腹水常规:黄浊,蛋白3+,比重1.010,细胞总数49 714/mm3,红细胞数28 264/mm3,白细胞数21 450/mm3,多个核细胞96.1%,单个核细胞3.9%;腹水生化:葡萄糖3.9 mmol/L,乳酸脱氢酶433 U/L,蛋白37 756 mg/L,乳酸7.04 mmol/L;腹水病理:镜下见大量嗜酸性粒细胞及红细胞,散在少数间皮细胞及淋巴细胞(图1)。胸水常规:黄浊,蛋白3+,比重1.010,细胞总数29 488/mm3,红细胞数17 892/mm3,白细胞数11 596/mm3,多个核细胞80%,单核细胞20%;胸水生化:葡萄糖3.4 mmol/L,乳酸脱氢酶425 U/L,蛋白33 667 mg/L,乳酸4.58 mmol/L;胸水病理:镜下见大量嗜酸性粒细胞及红细胞,散在间皮细胞及少量组织细胞和淋巴细胞(图2)。呼吸道病原体抗体、抗核抗体、抗可溶性抗原抗体、抗中性粒细胞胞浆抗体、抗肾小球基底膜抗体、抗髓过氧化物酶抗体、抗蛋白酶3抗体、结核感染T细胞检测均阴性,寄生虫抗体检查均阴性。食物过敏原IgG检测示:咖啡轻度敏感(+),其余各项如牛肉、玉米、菠萝、扇贝等均阴性。食物+吸入过敏原IgE检测:总IgE>200 IU/mL(正常参考值:<100 IU/mL),其余各项目如户尘螨、蟑螂、鸡蛋清、牛奶、菠萝等均阴性。肝肾功能大致正常。肺功能大致正常。13C呼气试验阴性。

Fig.1 Ascites pathology(HE staining,×100)图1 腹水病理(HE染色,×100)

Fig.2 Pleural fluid pathology(HE staining,×200)图2 胸水病理(HE染色,×200)
患者入院后出现间断低热,体温最高37.8℃,予以对症治疗。于2017年3月3日开始予静脉输注氢化可的松150 mg[5 mg/(kg·次)]每8 h 1次,辅以对症治疗,次日回报骨穿结果:骨髓涂片示各阶段嗜酸性粒细胞比例明显增高,嗜酸中幼2%,嗜酸晚幼11%,嗜酸杆状核20.5%,嗜酸分叶核11.5%,符合嗜酸性粒细胞增多骨髓象。第4天复查血常规示嗜酸性粒细胞计数正常,多学科会诊后考虑诊断高嗜酸粒细胞增多综合征(hypereosinophilic syndrome,HES)可能大,建议家属查融合基因以进一步明确诊断及分型,但家属拒绝,予以继续应用激素治疗,并于第5天行胃镜检查及活检,镜下提示浅表性胃炎(反流性),第10天胃镜病理回报:食管少许鳞状上皮,局部小血管淤血;胃窦慢性浅表性胃炎(中度),黏膜内可见散在嗜中性粒细胞浸润;十二指肠球部慢性炎症伴急性炎症反应,特殊染色HP(-)。将氢化可的松减至150 mg每12 h1次,继续应用8 d,后改为口服泼尼松20 mg×3次/d。患儿应用激素治疗后未再发热,腹胀、腹泻逐渐减轻。2017年3月18日复查超声提示胸腹腔积液减少,5 d后复查超声提示未见胸、腹腔积液,次日出院。
出院后规律减药,2017年6月6日停用泼尼松。院外服药过程中每2周门诊复诊,复查血常规共5次,外周血镜检均未见嗜酸性粒细胞增多。停药后2周,患儿因呼吸道感染复查外周血常规,提示白细胞计数24.09×109/L,嗜酸性粒细胞0.58,嗜酸性粒细胞计数1.39×109/L。于2017年6月20日再次入院,查骨髓及外周血涂片提示嗜酸性粒细胞增多(图3),腹部B超提示腹水(少量),进一步查基因重排IGH、IGK、TCRγ阴性,融合基因AML1/ETO、BCR/ABL p190、FIP1L1/PDGFRA、BCR/ABL p210、CBFβ/mmYH11阴性。中性粒细胞碱性磷酸酶阳性率20%,阳性指数36。检测PDFGRA基因、PDFGRB基因、8号染色体相关FGFR1基因未见异常。骨髓染色体核型分析未见克隆性异常,有核红细胞糖原染色、铁染色未见异常。由于明确了相关基因学检查,故该患儿可诊断为IHES。第2次入院相关影像学检查无明显多脏器受累情况,仅对症治疗,住院6 d,患儿自动出院,出院时予以口服泼尼松10 mg×3次/d。出院后未再出现不适,规律门诊随诊及减药,1个月后停用泼尼松。因复查血常规白细胞17.99×109/L,嗜酸性粒细胞32%,嗜酸性粒细胞计数7.43×109/L于2017年8月9日再次入院。入院后次日应用静脉输注氢化可的松150 mg每8 h 1次,请血液科会诊后,于2017年8月11日更换为静脉输注地塞米松10 mg×1次/d,应用地塞米松4 d后复查血常规示白细胞计数10.54×109/L,嗜酸性粒细胞0.018,随即患儿出院,出院后改为口服泼尼松10 mg×3次/d,规律门诊随访及减药,1个月后停用。截至2018年5月1日,随访患儿未再发作。

Fig.3 Bone marrow(left)and peripheral blood(right)smear(Wright staining,×1 000)图3 骨髓(左)及外周血(右)涂片(瑞氏染色,×1 000)
2 讨论
Chusid等[4]于1975年首次提出了HES的诊断标准:符合高嗜酸性粒细胞增多症(hypereosinophilia,HE),即外周血嗜酸性粒细胞>1.5×109/L,且HE持续6个月以上;排除其他原因导致的HE;有证据表明存在HE引起的器官损害。有关HES发病分子机制的研究显示,较早些年的HES诊断中50%以上存在FIP1L1/PDGFRA融合基因阳性[5];该基因可表达一种高酪氨酸激酶活性的蛋白质,可以促进嗜酸性粒细胞克隆性增殖,是此类HES发病的根本原因[6]。后来进一步研究发现,PDGFRB和FGFR1等其他致癌基因亦有促嗜酸性粒细胞增殖作用[7-9]。因此,世界卫生组织(WHO)2008年修订的关于髓系肿瘤和急性白血病的分类中,将含有该类基因的HES从HES中剔除并归类为慢性嗜酸粒细胞白血病,将HES归于骨髓增殖性肿瘤(myeloproliferative neo⁃plasms,MPNs)范畴,并且强调了 MPNs的肿瘤性质[10]。然而,目前该分类并没有获得多学科的广泛采纳。2011年嗜酸性粒细胞疾病和综合征工作会议组织了来自免疫学、变态反应、血液学和病理学等领域的专家,提出了新的共识及分类标准[11]:该共识与WHO定义最大的区别在于HES的诊断不再强调HE持续6个月,而是间隔1个月以上的两次外周血检查满足HE即可;满足外周血HE诊断标准,并且组织型HE导致的器官损伤功能障碍,除外导致器官损伤的其他疾病,可诊断HES。该共识中HES按病因可分为原发性(克隆性/肿瘤性)HES、继发性(反应性)HES及特发性HES(IHES)。满足了HES,并除外了过敏、感染、寄生虫、变应性肺病及其他血液肿瘤、肥大细胞增生等导致HE的各种继发因素后,可诊断为IHES。WHO新修订的2016版髓系肿瘤和急性白血病的分类中,关于IHES的定义基本维持了WHO此前的分类:嗜酸性粒细胞绝对计数>1.5×109/L持续≥6个月,且必须有组织受损,并除外以下情况:反应性嗜酸粒细胞增多症、淋巴细胞变异型嗜酸粒细胞增多症、慢性嗜酸粒细胞白血病-非特指型、髓系肿瘤伴嗜酸粒细胞增多;伴有PDGFRA、PDG⁃FRB、FGFR1重排或伴PCM1-JAK2融合基因嗜酸性粒细胞增多相关的MPNs或急性粒细胞/淋巴细胞白血病[12]。2017年中国专家共识关于HES和IHES的定义则引用了WHO 2016版的内容[13]。国内共识的出现使得HES及IHES在国内可以得到更规范化的诊治。
本例患儿因消化道症状就诊,伴外周血嗜酸性粒细胞明显增多,需与嗜酸性粒细胞性胃肠炎和嗜酸性粒细胞白血病相鉴别,胸、腹水病理见大量嗜酸性粒细胞,胃黏膜层活检病理未见嗜酸细胞,影像学检查见肺与膀胱受累,提示患儿胸膜、腹膜、肺及膀胱多器官受累及,经多种检查,除外白血病、过敏、药物反应、自身免疫性疾病等其他引起嗜酸粒细胞增多的疾病,并且对激素治疗有效,嗜酸性粒细胞下降与病情缓解有关,再入院后完善了融合基因等相关检查,最终明确诊断为IHES。
儿童IHES发病极为罕见。截止投稿前,通过数据库搜索,符合诊断标准的国内关于儿童HES个案报道仅12例[14-24],而进行了PDGFRA等基因检测可以明确诊断为 IHES 的病例仅 4 例[14,22-24],见表 1。IHES回顾分析中提及患者的年龄包括儿童的文献有2篇[25-26]。国内儿童HES的个案报道中,男9例,女3例,年龄2~13岁,累及肺9例,淋巴结3例,心脏4例,皮肤4例,血液系统4例,以腹部症状为首发表现、累及消化道者4例。与国外的回顾分析对比类似[3],女童患者数量明显少于男童。
HES治疗目的主要是通过降低嗜酸性粒细胞数量,进而减少其组织浸润和细胞因子释放、减轻脏器损伤,其中,克隆性HES的治疗应根据具体的基因型或血液系统肿瘤分型进行相应的药物治疗[13],而IHES的治疗药物为首选糖皮质激素:一线治疗首选泼尼松每日1 mg/kg口服,1~2周后逐渐缓慢减量,2~3 个月减量至最低维持剂量[13,27-30]。若减量过程中病情反复,至少应恢复至减量前用药量。治疗1个月后如果嗜酸粒细胞绝对计数>1.5×109/L或最低维持剂量>10 mg/d,则应改用二线治疗[13]。Ogbogu等[30]报道经过1个月的糖皮质激素治疗后,85%的HES患者会完全缓解或者部分缓解。Parrillo等[31-32]发现糖皮质激素治疗HES的缓解率为70%。然而对于儿童病例,国内外文献多为个案报道,糖皮质激素的整体治疗效果报道较少[3,33]。单纯泼尼松治疗效果欠佳或伴有心脏、周围神经、皮肤等靶器官损害的患者,应用羟基脲、干扰素α、长春新碱、抗白细胞介素-5单克隆抗体(美泊利单抗)、抗CD52单克隆抗体(阿仑单抗)和造血干细胞移植可以改善症状[34-36]。酪氨酸激酶抑制剂伊马替尼不仅对FIP1L1/PDGFRA融合基因阳性的HES有较好的效果,也可以作为IHES的二线用药。伊马替尼推荐剂量400 mg/d,4~6周后无效需停用[13]。目前,报道PDGFRA阴性患者应用伊马替尼的总应答率约20%~40%[1,30]。IHES的二线用药还包括环孢素A和硫唑嘌呤、羟基脲[13]。
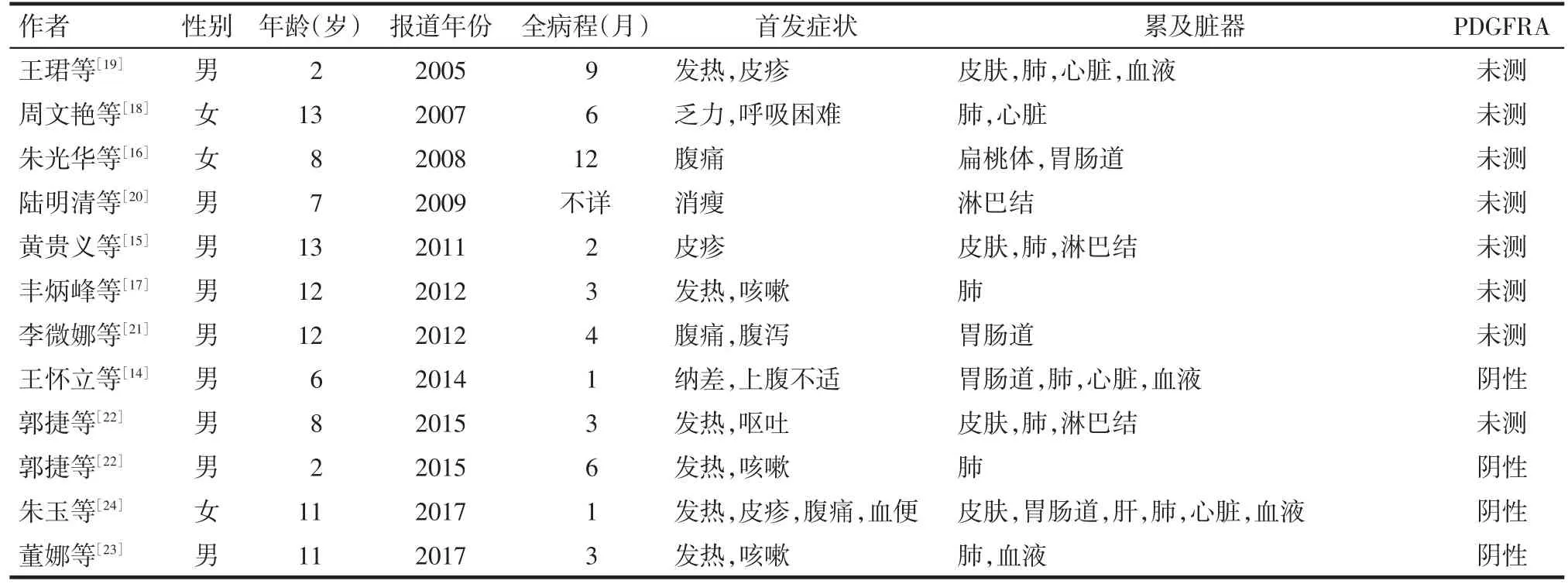
Tab.1 The summary of case report about children with HES in China表1 国内儿童高嗜酸粒细胞增多综合征病例汇总
本例患儿加用激素治疗4 d后,复查血常规嗜酸性粒细胞计数正常,说明该患儿对激素治疗敏感。减量停药后出现复发,再次给予激素治疗后可缓解,此种情况亦可见文献报道[37]。患儿再次发病较首次减轻,对药物反应好,可能预后较好,但仍需长期随访。据文献报道,伴有高白细胞计数(90×109/L),骨髓增生异常特征,进展性心脏受累的HES患者常常预后较差,皮质激素治疗反应良好或伴IgE增高可提示较好预后[38]。具体到儿童HES,国外回顾性分析提示多数HES患儿预后较好,呈良性进展[3]。但目前国内尚缺乏关于儿童HES长期预后的报道。现在国内已经有指南可以参考,对于此类HES病例,应尽早行相关基因检测以进一步明确HES分型,进行更好的针对性治疗、监测和治疗并发症,并长期随访。

