3.0 T MRI在直肠癌术前分期和评估中的应用价值
吉盛超,耿承军,杨晓亮,杨莉月,臧柯
直肠癌是我国最常见的恶性肿瘤之一,发病率和死亡率均位居第4位,且有逐年上升和年轻化的趋势[1-2]。术前直肠癌的分期和评估对诊断、个体化治疗及预后判断具有重要意义。MRI具有良好的组织分辨率和多参数成像优势,是目前无创评估直肠癌最有效的影像学检查方法[3-4]。然而,当前影像医师对直肠癌MRI诊断价值的认识尚不足,诊断报告往往过于简单,许多有价值的诊断信息未能准确提供,因而可能造成不必要的医疗资源浪费。本研究通过对比直肠癌术前MRI表现与术后病理,进一步探讨MRI检查在直肠癌术前分期和评估中的应用价值。
1 资料与方法
1.1 一般资料 回顾性收集我院2014年1月—2017年9月经结肠镜及活检诊断为直肠癌的103例患者资料,其中男62例,女41例,年龄29~88岁,平均(62±12)岁。纳入标准:(1)接受手术切除治疗,且术后病理证实直肠癌诊断。(2)术前1周内行盆腔MRI平扫+增强检查。(3)MRI检查前未接受针对肿瘤的任何治疗。(4)年龄≥18岁。患者症状主要包括血便、腹泻、里急后重及排便习惯改变等。
1.2 MRI检查
1.2.1 检查准备 患者检查前1 d少渣饮食,检查前10 h禁食、水,检查前2 h经肛门清洁灌肠1~2次。患者左侧卧于扫描床,采用常规灌肠器进行静水压灌肠,注水量根据患者耐受程度,一般低位肿瘤注水300~500 mL,高位肿瘤注水大于500 mL。
1.2.2 检查设备与扫描参数 采用美国GE公司3.0 T MRI扫描设备,8通道相控阵列体线圈。Sag T2序列扫描参数:TR 3 240 ms,TE 105 ms,视野(field of view,FOV)26 cm×26 cm,矩阵256×320,层厚6 mm,层间距1 mm,所得图像作为高分辨率MRI扫描的定位图像。Ax FS T2序列扫描参数:TR 3 680 ms,TE 105 ms,FOV 26 cm×26 cm,矩阵256×320,层厚6 mm,层间距1 mm。Ax T1FSE序列扫描参数:TR 600 ms,TE Min Full ms,FOV 38 cm×38 cm,矩阵224×384,层厚6 mm,层间距2 mm。Ax DWI B=1 000序列扫描参数:TR 6 000 ms,TE Minimum ms,FOV 38 cm×38 cm,矩阵96×130,层厚6 mm,层间距2 mm。Cor FS T2序列扫描参数:TR 3 380 ms,TE 90 ms,FOV 38 cm×38 cm,矩阵256×320,层厚5 mm,层间距2 mm。Ax T2Small序列扫描参数:TR 3 500 ms,TE 20 ms,FOV 18 cm×18 cm,矩阵256×288,层厚3 mm,层间距1 mm。Ax T1Small序列扫描参数:TR 1 180 ms,TE Min Full ms,FOV 18 cm×18 cm,矩阵256×288,层厚3 mm,层间距1 mm。增强对比剂选用钆布醇,注射速率3 mL/s,剂量0.1 mmol/kg。对比剂注射20、120、300 s时进行早、中、晚期扫描,总扫描时间300 s。
1.3 图像分析和标准 MRI图像由2名影像科副主任医师分别阅片,当意见相左时经协商取得一致。直肠癌分期采用国际通用的TNM分期标准,MRI分期标准如下:(1)T1~2期,肿瘤侵及未超过黏膜下层或仅侵及肌层。(2)T3期,肿瘤穿透肌层,侵犯肠周脂肪。(3)T4期,肿瘤侵犯邻近结构或脏器。(4)区域淋巴结转移(N),直肠周围淋巴结直径≥5 mm或沿髂血管分布的淋巴结≥10 mm,边界不规则或内部信号混杂。以系膜筋膜与肿瘤或阳性淋巴结之间距离<1 mm视为系膜筋膜受累[5]。
1.4 统计学方法 采用SPSS 19.0软件进行统计学分析。MRI和病理测量的肿瘤下缘-肛缘距离采用均数±标准差(±s)表示,两者比较采用配对样本t检验;MRI和病理对T分期、肠旁淋巴结转移、筋膜受累诊断的一致性检验采用Kappa检验,Kappa>0.6视为一致性较强;以P<0.05为差异有统计学意义。
2 结果
2.1 MRI和病理一般情况 MRI表现为腔内局限性软组织肿块49例,肠壁不规则增厚、肠腔环形狭窄54例。平扫时T1WI呈等或稍低信号,T2WI呈高低混杂信号;增强时病灶明显强化,病变段肠壁外缘光滑、欠光滑或呈结节状向外突出。本组直肠癌患者合并直肠息肉11例,卵巢囊肿2例,骶前转移9例,骨转移1例。病理诊断腺癌90例,黏液细胞癌或黏液腺癌10例,神经内分泌癌3例;高分化13例,中分化62例,低分化28例。
2.2 肿瘤分期 MRI诊断T1~2期5例,T3期72例,T4期26例,见图1~3。T4期患者中侵及膀胱12例,侵及骶骨前5例,侵及阴道后壁5例,侵及前列腺3例,侵及精囊腺1例。术后病理诊断T1期5例,T2期16例,T3期60例,T4期22例。MRI和病理T分期诊断的一致性较好(Kappa=0.748,P<0.01),见表1。MRI诊断伴有肠旁淋巴结转移74例(图4),术后病理诊断伴有肠旁淋巴结转移66例,其中真阳性61例,真阴性24例,假阳性13例,假阴性5例,影像诊断敏感度为92.4%(61/66),特异度为64.9%(24/37),阳性预测值为82.4%(61/74),阴性预测值为82.8%(24/29);两者具有较好的一致性(Kappa=0.601,P<0.01)。
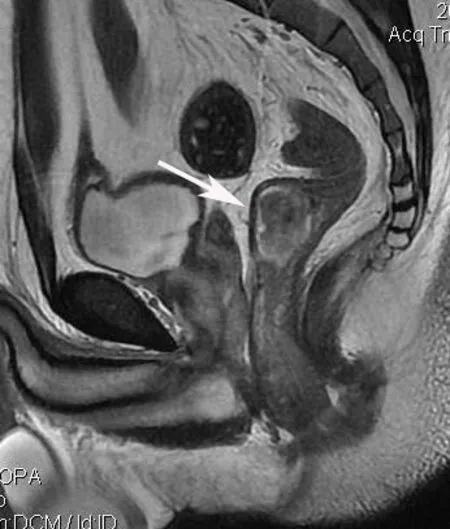
Fig.1 The stage T2 rectal carcinoma.MRI showed that parenchyma inside the intestine without muscular layer destruction,and with mesangial fat clear(arrow)图1 T2期直肠癌,肠管内软组织肿块,未突破肌层,系膜脂肪清晰(箭头所示)
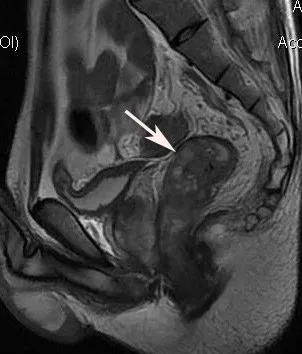
Fig.2 The stage T3 rectal carcinoma MRI showed that muscular layer and peri-bowels fat tissue were violated(arrow)图2 T3期直肠癌,突破肌层,侵犯肠周脂肪(箭头所示)
2.3 术前评估 MRI矢状位上均能清晰显示肿瘤边缘、肠壁及肛缘(图5)。行肛门切除术的18例患者中,MRI与术后大体标本测量的肿瘤下缘-肛缘距离,差异无统计学意义[(4.02±0.27)cmvs.(4.06±0.47)cm,t=0.410,P>0.05],两者差值均≤6 mm。65例MRI判断筋膜受累阴性者均与术后病理诊断一致,38例MRI判断筋膜受累阳性者(图6),其中12例为假阳性。敏感度为100.0%(26/26),特异度为84.4%(65/77),阳性预测值为68.4%(26/38),阴性预测值为100.0%(65/65),MRI和病理诊断的一致性较好(Kappa=0.732,P<0.01)。
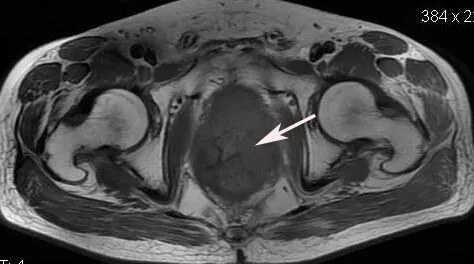
Fig.3 The stage T4 rectal carcinoma.MRI showed that the seminal vesicle was violated(arrow)图3 T4期直肠癌,侵犯精囊(箭头所示)
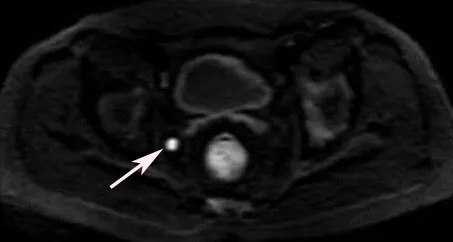
Fig.4 The diffuse weighted imaging showed a small nodular of hyperintensity,point out the lymphadenectasis(arrow)图4 弥散序列见1枚小结节状高信号,提示淋巴结肿大(箭头所示)

Fig.5 Measure the distance of tumor edge to anal verge under the sagittal view(curve)图5 矢状位下测量肿瘤下缘-肛缘距离(曲线所示)

Tab.1 The predictive value of MRI for T stage diagnosis in rectal cancer表1 MRI对直肠癌T分期诊断的预测价值

Fig.6 MRI showed that lesion of anterior rectal wall was heterogeneous reinforcement,with unclear boundary in the left rear prostate,which suggests that the mesangial fascia was violated(arrow)图6 直肠前壁病灶不均匀强化,于前列腺左后方境界不清,提示系膜筋膜受累(箭头所示)
3 讨论
目前,外科切除是直肠癌的主要治疗方法,最新美国国家癌症指南提出,进展期(T3期以上)直肠癌要提倡术前新辅助治疗[6],即术前放疗或化疗,以期达到降低复发率、转移率和延长患者生存期的目的。准确的术前影像分期和评估对患者治疗方案制定和预后判断至关重要。随着高场强MRI和相控阵线圈技术的逐步完善,加之直肠位置相对固定、受呼吸影响小、与周围组织对比度好等原因,MRI已然成为直肠癌术前诊断、分期、评估的最重要手段[7]。Poulsen等[8]对比了术前直肠癌1.5 T MRI T分期与术后病理分期结果,研究纳入低位结肠癌56例、中位结肠癌131例和高位结肠癌190例,结果显示MRI T分期准确率分别为81%、86%和83%,表明MRI与病理分期的一致性较高,且不受肿瘤位置高低的影响。Hassan等[9]探讨高分辨率MRI在术前直肠癌的应用价值,MRI T分期诊断的敏感度、特异度、阳性预测值、阴性预测值分别高达95.8%、87.5%、92.0%、93.3%(Kappa=0.84,P=0.000),环周切缘评估的敏感度、特异度、阳性预测值、阴性预测值达90.0%、96.7%、90.0%、96.7%(Kappa=0.86,P=0.000)。以往有研究采用直肠灌气法行MRI检查前准备,但此法不仅增强肠道蠕动,而且还具有气液平面磁敏感伪影的缺点,影响了图像质量及观察[10]。本研究在清洁灌肠后采用静水压灌肠,克服了直肠灌气的不足,且因为直肠内有水的衬托,病变显影更加清晰。
肠腔充溢液体导致肠管扩张、肠壁变薄,影像上难以观察肠壁分层情况,T1、T2期无法有效辨别,故本研究MRI分期将T1、T2期合并进行分析。直肠周围脂肪是否遭到侵犯是T2、T3期的鉴别要点。T3期T1WI表现为不规则的肠壁肿瘤等信号影突入高信号的肠周脂肪,T1WI增强并脂肪抑制表现为肠壁外侧强化的结节状组织影。但是,有时直肠癌周围由于炎症反应而明显强化,肠周局部纤维化也能出现肠周针刺状的异常信号影,造成与肿瘤侵犯周围组织类似的征象,以致部分T2期被高估为T3期。T3、T4期的区别在于肿瘤是否侵犯邻近器官及盆壁。T4期T1WI表现为直肠壁与周围器官(如肌肉、前列腺、子宫等)间的高信号脂肪影受到破坏,T2WI表现为肌肉组织有与肿瘤原发灶相连的高信号影。本研究MRI T1~2、T3、T4分期诊断的敏感度和特异度分别为 23.8%和 100%、96.7%和67.4%、90.9%和92.6%,与病理诊断的一致性较强(Kappa=0.748,P=0.000)。而其中MRI T1~2期敏感度仅为23.8%,这主要与肠周脂肪“显微镜浸润”和部分容积效应有关,共有16例T3或T4期患者被低估为T1~2期。淋巴结转移是直肠癌患者预后不良的主要危险因素,也是放射和外科治疗方案制定的影响因素。以往研究主要依据淋巴结的大小来判断其良恶性,但该标准具有一定的局限性,炎症淋巴结可能增大,而转移淋巴结的直径可能正常。高分辨率MRI能够清晰显示淋巴结的边缘及内部信号情况,有助于淋巴结性质的判断。本研究综合淋巴结直径、边界及内部信号情况来判定淋巴结性质,诊断敏感度和特异度达92.4%和64.9%。近年来,国外有报道通过超微顺磁性氧化铁淋巴结造影的方法,进一步提高了MRI判断淋巴结性质的准确性[11]。
相较于传统直肠癌切除术要求切除肿瘤外侧5 cm,全直肠系膜切除术仅需切除肿瘤外侧2 cm,这很大程度上提高了患者的保肛率,但同时对术前准确测量肿瘤下缘-肛缘距离提出更高要求。直肠在骶凹内呈弯曲状态,故测量肿瘤下缘-肛缘距离比较困难。直肠指检、肠镜和CT均无法准确测量,而MRI矢状位却能清晰显示癌肿和肛缘,利用曲面测量技术可准确测量肿瘤下缘-肛缘距离,有助于术前治疗方案的制定和减少手术的盲目性。本研究18例行肛门切除术的患者术前MRI测量的肿瘤下缘-肛缘距离与术后大体标本的测量结果差值均≤6 mm,差异无统计学意义。与本研究结果相似,陈建初等[12]在MRI和大体标本上测量肿瘤下缘-肛缘距离,结果分别为(4.20±0.51)cm和(4.21±045)cm,差异亦无统计学意义。全直肠系膜切除术要求完整切除癌变直肠段及其系膜组织,这需要术前影像对系膜筋膜是否受侵犯做出准确评价。3.0 T MRI能清晰显示系膜和系膜筋膜,系膜表现为直肠周围宽窄不等的脂肪影,系膜筋膜表现为系膜组织周围的弧形线状影。直肠系膜内富含血管及淋巴管,是肿瘤最易侵犯的部位,而系膜筋膜对肿瘤扩散具有一定的阻挡作用,系膜筋膜受累是影响直肠癌转移、复发、预后的主要危险因素[13]。本研究MRI判断为筋膜受累阴性患者均与术后病理诊断一致,38例MRI判断为筋膜受累阳性患者中有12例为假阳性,敏感度和特异度分别为100.0%和84.4%,MRI和病理诊断的一致性较好(Kappa=0.732,P<0.01),与刘朵朵等[14]报道相似。
3.0TMRI可较准确地对在直肠癌患者进行术前分期和评估,有助于临床治疗方案的制定,值得推广应用。相信随着MRI显像技术、影像后处理技术的持续改进,其对直肠癌的诊断价值将进一步体现。

