稻麦轮作磷肥减施下水稻土磷素生物有效性特征
袁佳慧, 汪 玉, 王慎强, 赵品恒, 王宏燕, 陈 浩, 朱文彬
(1. 东北农业大学资源与环境学院, 黑龙江 哈尔滨 150030; 2.土壤与农业可持续发展国家重点实验室/ 中国科学院南京土壤研究所, 江苏 南京 210008; 3.常熟市农业科学研究所, 江苏 常熟 215500)
磷是植物生长发育的必需营养元素之一[1-2],但过量施用磷肥会增加磷随径流或向下淋洗流失的风险[3]。因此,农田施磷方案的科学设计对节约资源和保护环境尤为重要。以往研究表明在太湖稻麦轮作区实施稻季不施磷仅麦季施磷的磷肥减施措施在水稻季仍可为作物提供充足的磷源,并从化学分级等层面解释了原因[4-5]。然而,磷素化学分级方法缺少对植物根系和微生物磷素获取机制的研究[6-7],并且提取过程相对复杂,耗时长,设备要求高[8-9]。土壤磷化合物的复杂成分使得各种形态磷素对应着不同的生物有效性[10-11]。
DELUCA等[12]基于生物学利用难易程度开发了基于磷素生物有效性的分级方法(简称BBP法),该方法模拟微生物和作物根系的磷矿化作用,对土壤不同形态磷素生物有效性进行评价。GAO等[13]采用该方法对生物炭施入情况下的美国圣胡安群岛土壤养分的保持和供应进行研究,生物炭的施入可显著增加吸附土壤黏粒或弱结合于无机沉淀物中的柠檬酸提取态磷(Citrate-P)组分含量,促进作物吸收利用,从而增加土壤养分可利用性。ZHONG等[14]采用该方法针对某沿海平原土壤展开研究,发现根际-蚯蚓-海鸟粪交互作用对土壤磷素供给、组分以及植物可利用性具有一定的调节作用。水稻土是一种特殊的周期性淹水土壤,主要通过氧化还原反应对元素的生物地球化学循环、土壤pH以及酶活性产生深远影响[15]。
利用BBP法研究4种磷肥处理水稻土麦季收获期磷素生物有效性,以及土壤pH和磷酸酶活性对磷组分及有效性的影响,分析各形态磷对植物磷吸收的贡献,从而合理评估土壤磷素生物有效性,加强对减磷处理下土壤磷状态变化的表征和理解。
1 材料与方法
1.1 样品采集
试验地点为太湖西北岸中国科学院常熟农业生态实验站宜兴(31°16′ N, 119°54′ E)和常熟农业科学研究所(31°41′ N,120°40′ E)试验田,两地种植方式均以稻麦轮作为主,年平均温度分别为16.1和16.9 ℃,年平均降水量分别为1 845.8和1 615.3 mm。土壤基本理化性质见表1。试验于2010年6月开始(稻季),共设稻麦季均不施磷(Pzero)、稻季施磷麦季不施磷(PR)、麦季施磷稻季不施磷(PW)和稻麦季均施磷(PR+W,常规施肥)4个处理,每组设3个重复,12个小区随机分布,每个小区面积为50 m2。试验用N、P、K肥分别为尿素〔w(N)=46%〕、过磷酸钙〔w(P2O5)=12%〕和氯化钾〔w(K2O)=60%〕。氮肥(以N计)每季用量为240 kg·hm-2,钾肥(以K2O计)每季用量为60 kg·hm-2,磷肥(以P2O5计)每季用量为40 kg·hm-2。每季氮肥施用分基肥(30%)、第1次追分蘖肥(40%)和第2次追拔节肥(30%);磷肥施用情况视不同磷肥处理而定。于2017年(第7年稻麦轮作)麦季收获期用镊子小心采取小麦根际新鲜土壤并将其收集于离心管中,直接用于BBP生物分级试验或于-20 ℃条件下保存,剩余土壤风干过2 mm孔径筛于室温保存用于其他指标测定。
表1供试土壤初始基本性状
Table1Initialbasicpropertiesofsoilused

试验田w(全氮)/(g·kg-1)w(全磷)/(g·kg-1)w(全钾)/(g·kg-1)w(有机质)/(g·kg-1)w(有效磷)/(mg·kg-1)阳离子交换量/(cmol·kg-1)pH值 宜兴0.960.3712.316.716.38.575.95 常熟1.930.5616.035.910.217.505.56
1.2 样品处理
供试样品分析均采用常规分析方法[16-17]。土壤pH采用pH计(Thermo ORION STAR A211)测定〔m(土)∶V(水)为1∶2.5〕;土壤有机质含量采用Loco CN-2000分析仪测定;土壤全氮含量采用凯氏定氮法测定;土壤有效磷含量采用NaHCO3(pH 8.5)浸提-钼蓝比色法测定;阳离子交换量(CEC)采用乙酸铵交换法测定;土壤全钾含量采用火焰原子吸收法测定。土壤磷酸酶活性采用土壤酸性、碱性磷酸酶(S-ACP、S-ALP)活性测定试剂盒完成。
1.3 BBP土壤磷分级
采用DELUCA等[12]的基于生物有效性的磷素分级方法分析土壤磷素有效性,其简要步骤如下:称取0.5 g新鲜土于15 mL离心管中,加入10 mL提取液,分别为0.01 mol·L-1CaCl2、0.01 mol·L-1柠檬酸、0.02 EU·mL-1酶(含酸性磷酸酶、碱性磷酸酶和植酸酶)和1 mol·L-1HCl。酶提取液中,在原始方法的基础上添加微生物来源的碱性磷酸酶(Sigma P5931;Enzyme Commission Number 3.1.3.1),使得所活化提取的有机磷组分更加全面和具有代表性,并且提取过程中以纯水代替醋酸钠缓冲溶液[18]。鉴于植酸酶自身含磷,在使用前于室温条件下用透析袋对植酸酶透析5 d以去除植酸酶中的磷。采用钼蓝法测定磷含量[19],对于高磷含量样品(Citrate-P、HCl-P),对其进行适当稀释后测定[20]。
1.4 数据处理
采用SPSS 17.0 软件进行Pearson相关分析和Duncan单因素方差分析(α=0.05)。采用冗余分析(redundancy analysis,RDA)评价土壤pH,酸性、碱性磷酸酶对磷组分的影响。在进行冗余分析前,对磷组分矩阵进行除趋势对应排序分析(detrended correspondence analysis,DCA),确定数据适合线性模型。采用Canoco 4.5软件进行冗余分析。
2 结果与分析
2.1 磷肥减施条件下麦季土壤磷素生物有效性特征
基于生物有效性的土壤磷素分级方法所得4种磷组分含量存在显著差异,由高到低依次为HCl-P、Citrate-P、酸性磷酸酶、碱性磷酸酶和植酸酶提取态磷(Enzyme-P)和CaCl2-P,并且常熟试验田磷含量高于宜兴试验田,宜兴和常熟试验田HCl-P含量差异最显著(表2)。对比4种施磷方式下麦季收获期土壤各磷组分含量发现,宜兴磷含量变异幅度较大,与磷肥减施处理(Pzero、PR和PW)相比,稻麦季均施磷处理(PR+W)Citrate-P、Enzyme-P和HCl-P含量显著增加(P<0.05),对于CaCl2-P含量则不存在显著差异;在常熟试验田,不同施肥方式对麦季收获期土壤各生物分级磷组分含量总体不存在显著影响(P>0.05),仅两季均不施磷肥处理(Pzero)HCl-P含量与常规施磷处理相比显著降低(P<0.05)。
表2磷肥减施条件下麦季土壤基于生物有效性的土壤磷组分含量特征
Table2CharacteristicsofcompositionofsoilphosphorusbasedonthebiologicalavailabilityinreducedP-inputpaddysoils
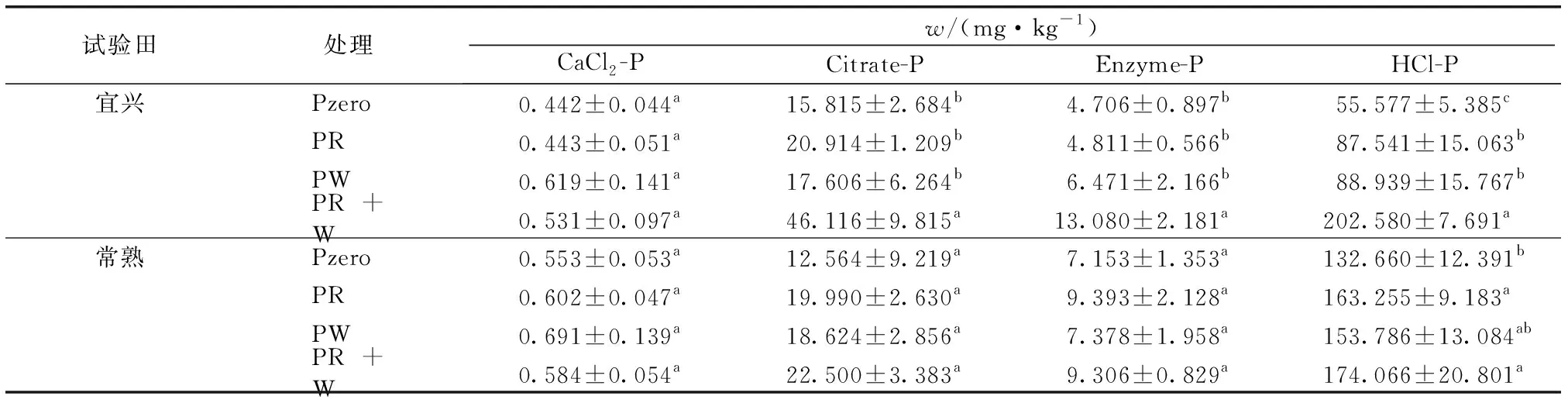
试验田处理w/(mg·kg-1)CaCl2-PCitrate-PEnzyme-PHCl-P 宜兴Pzero0.442±0.044a15.815±2.684b4.706±0.897b55.577±5.385cPR0.443±0.051a20.914±1.209b4.811±0.566b87.541±15.063bPW0.619±0.141a17.606±6.264b6.471±2.166b88.939±15.767bPR+W0.531±0.097a46.116±9.815a13.080±2.181a202.580±7.691a 常熟Pzero0.553±0.053a12.564±9.219a7.153±1.353a132.660±12.391bPR0.602±0.047a19.990±2.630a9.393±2.128a163.255±9.183aPW0.691±0.139a18.624±2.856a7.378±1.958a153.786±13.084abPR+W0.584±0.054a22.500±3.383a9.306±0.829a174.066±20.801a
Pzero为稻麦季均不施磷; PR为稻季施磷麦季不施磷; PW为麦季施磷稻季不施磷; PR+W为稻麦季均施磷(常规施肥)。就某一试验田而言,同一列数据后英文小写字母不同表示不同处理间某指标差异显著(P<0.05)。
2.2 磷肥减施下麦季基于生物有效性的土壤磷素组分与有效磷的关系
宜兴、常熟试验田土壤有效磷含量见表3。宜兴试验田Citrate-P、Enzyme-P和HCl-P含量均与有效磷含量呈极显著正相关关系(P<0.01),决定系数(R2)分别为0.587、0.531和0.587,而CaCl2-P含量与有效磷含量之间不存在显著相关关系(图1)。常熟试验田Citrate-P和HCl-P含量与有效磷含量呈显著正相关关系(P<0.05),R2分别为0.280和0.386,而CaCl2-P、Enzyme-P含量与有效磷含量之间不存在显著相关关系。
表3磷肥减施条件下麦季土壤有效磷含量
Table3Concentrationofsoilolsen-PinreducedP-inputpaddysoils
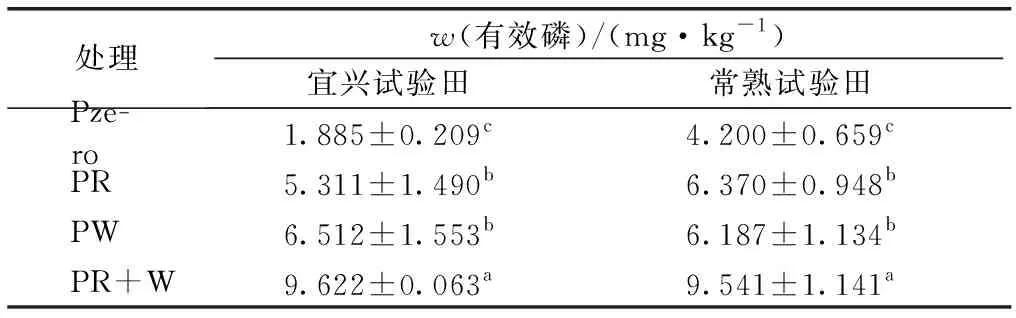
处理w(有效磷)/(mg·kg-1)宜兴试验田常熟试验田 Pze-ro1.885±0.209c4.200±0.659c PR5.311±1.490b6.370±0.948b PW6.512±1.553b6.187±1.134b PR+W9.622±0.063a9.541±1.141a
Pzero为稻麦季均不施磷; PR为稻季施磷麦季不施磷; PW为麦季施磷稻季不施磷; PR+W为稻麦季均施磷(常规施肥)。同一列数据后英文小写字母不同表示不同处理间有效磷含量差异显著(P<0.05)。
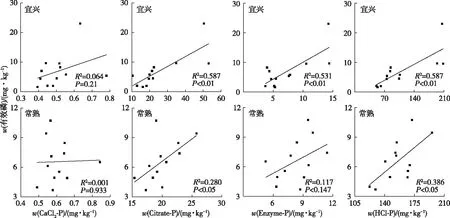
图1 磷肥减施下麦季土壤4种生物有效性磷与有效磷相关性Fig.1 Relationships between Olsen-P concentration and four fractions of the proposed biologically-based P in reduced P-input paddy soils
2.3 磷肥减施下麦季土壤磷酸酶活性
由表4可知,宜兴、常熟试验田土壤酸性磷酸酶(S-ACP)活性均高于碱性磷酸酶(S-ALP)活性。两地S-ACP活性均值分别为19.60和21.70 μmol·d-1·g-1,S-ALP活性均值则分别为0.719、1.543 μmol·d-1·g-1,并且不同施肥方式对宜兴麦季收获期S-ACP、S-ALP活性总体不存在显著影响(P>0.05),而常熟试验田仅稻季施磷肥处理(PR)S-ACP 活性显著低于常规施肥处理(PR+W)(P<0.05),对于S-ALP活性则不存在显著差异。
表4磷肥减施下麦季土壤磷酸酶活性
Table4SoilphosphataseactivityinreducedP-inputpaddysoils
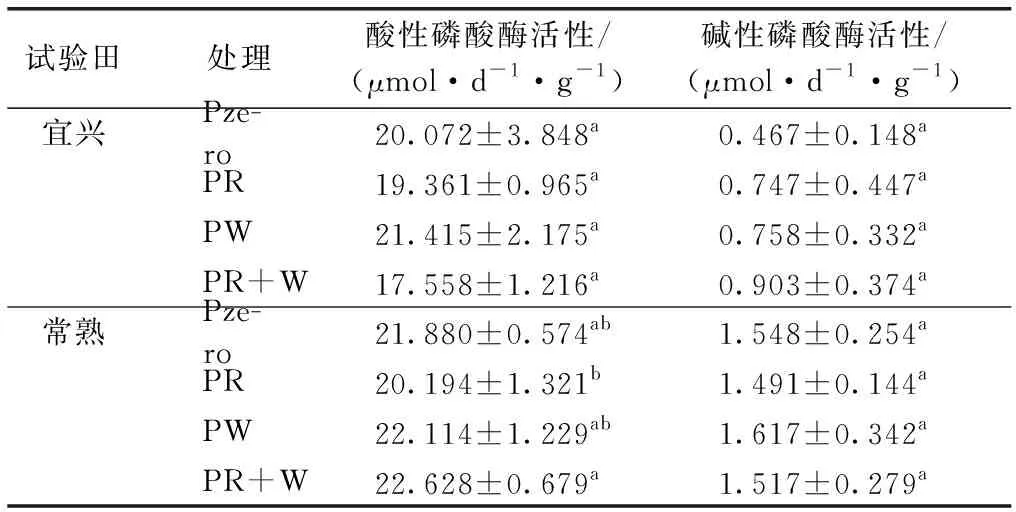
试验田处理酸性磷酸酶活性/(μmol·d-1·g-1)碱性磷酸酶活性/(μmol·d-1·g-1) 宜兴Pze-ro20.072±3.848a0.467±0.148aPR19.361±0.965a0.747±0.447aPW21.415±2.175a0.758±0.332aPR+W17.558±1.216a0.903±0.374a 常熟Pze-ro21.880±0.574ab1.548±0.254aPR20.194±1.321b1.491±0.144aPW22.114±1.229ab1.617±0.342aPR+W22.628±0.679a1.517±0.279a
Pzero为稻麦季均不施磷; PR为稻季施磷麦季不施磷; PW为麦季施磷稻季不施磷; PR+W为稻麦季均施磷(常规施肥)。就某一试验田而言,同一列数据后英文小写字母不同表示不同处理间某指标差异显著(P<0.05)。
2.4 磷肥减施下麦季土壤特性与土壤磷组分关系
图2显示,土壤pH、S-ACP和S-ALP共解释磷组分39.2%的变异,其中,第1排序轴解释变异38.2%,为显著性轴。结果表明,pH和S-ALP含量与土壤磷组分含量间存在一定正相关关系。
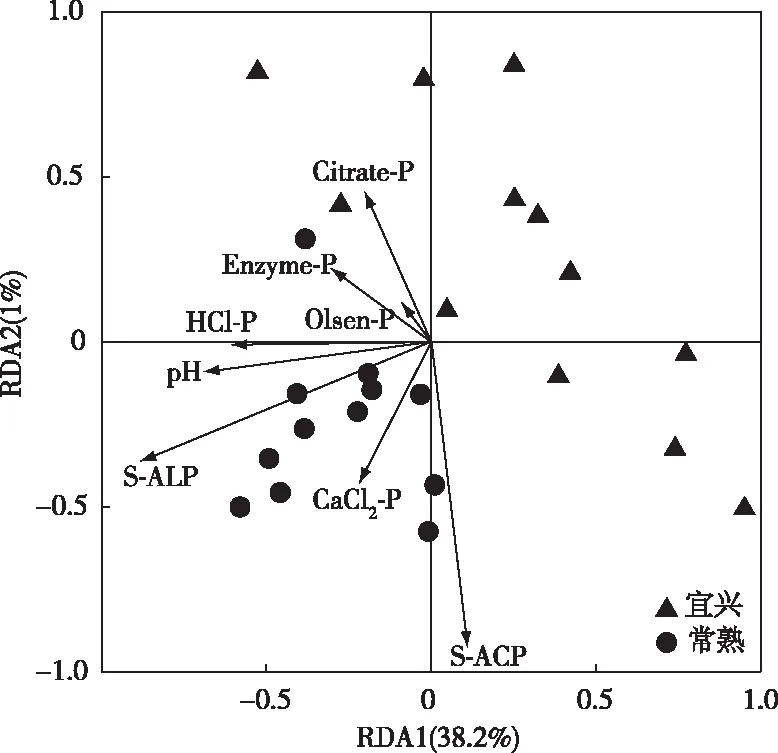
S-ACP和S-ALP分别为土壤酸性磷酸酶和碱性磷酸酶。图2 磷肥减施条件下麦季土壤pH、S-ACP和S-ALP与4种生物有效性磷和有效磷(Olsen-P)的RDA分析Fig.2 Redundancy analysis (RDA) revealing the effects of soil pH, S-ACP and S-ALP on biologically-based P (BBP) and the conventional Olsen-P in reduced P-input paddy soils
3 讨论
3.1 磷肥减施条件下麦季土壤磷素生物有效性
BBP磷素分级方法是可应用于复杂景观尺度上的基于土壤根际过程的一套简洁的土壤磷素平行提取评估过程[12]。笔者研究中,与稻麦季均施磷处理(PR+W)相比,宜兴减施磷肥处理(Pzero、PR和PW)Citrate-P、Enzyme-P 和HCl-P含量显著降低(P<0.05),但作物直接可溶性磷(CaCl2-P)含量没有显著差异,表明磷肥减量实施7 a后,宜兴PW处理在稻季不施磷肥条件下土壤仍可提供充足的磷源来维持水稻生长并保证产量稳定(PW:3.815 t·hm-2;PR+W:3.996 t·hm-2。P>0.05);与稻麦季均施磷处理(PR+W)相比,常熟减施磷肥处理(Pzero、PR和PW)4种有效性磷组分总体无显著差异,表明常熟PW处理土壤磷素供应能力与PR+W处理相似。以上麦季的研究结果与以往针对两块试验田2013年水稻季收获期Tiessen化学分级结果相一致[4],进一步从土壤磷素生物有效性角度阐述了太湖流域稻麦轮作区土壤稻季减施磷肥可以实施的原因。对2013年稻季土壤的研究[4]表明,常熟试验田磷含量高于宜兴,因此到目前为止,与PR+W处理相比,常熟试验田PR或PW处理土壤磷含量无显著差异,仅Pzero处理需要更多的HCl-P对土壤活性磷进行补给。这与BOSCHETTI等[21]的研究结果相一致,同样也表明不同磷肥的添加主要增加了土壤无机磷(Pi)含量,而有机磷(Po)含量变化不显著。
土壤有效磷是评价土壤磷素可利用性应用最广泛的测试指标之一,尤其是可用于大规模范围内土壤磷素状态的分析[22]。BBP方法利用CaCl2、柠檬酸、酶和HCl对土壤磷素进行平行提取,分别模拟4种土壤磷素组分;CaCl2-P为可溶性无机磷,模拟可被根系截留的磷酸根;Citrate-P为活性无机磷,模拟能够被有机酸活化释放的磷组分;Enzyme-P为活性有机磷,模拟微生物和植物根系分泌的酶(酸性、碱性磷酸酶和植酸酶)矿化的磷组分;HCl-P是相对稳定的无机磷,模拟经氢质子活化的最大潜力磷库;4种磷组分对土壤有效磷的贡献主要为CaCl2-P和Citrate-P。DELUCA等[12]的研究表明,BBP体系4种提取形态磷含量间差异较大,但与有效磷含量呈显著正相关关系。笔者研究中,基于4种磷肥减施稻麦轮作体系下麦季收获期土壤,宜兴试验田土壤Citrate-P、HCl-P和Enzyme-P含量均与有效磷含量呈极显著正相关(P<0.01),常熟试验田土壤Citrate-P、HCl-P含量与有效磷含量呈显著正相关(P<0.05)。相关系数差异表明两地土壤磷素有效性及有效磷来源不同[23],就宜兴试验田而言,除有机酸活化和氢质子活化的无机磷库外,酶矿化的有机磷同样也有重要贡献。JALALI等[24]分析各种土壤磷素提取方法与5种不同质地的57个钙质土壤吸附参数之间的关系,同样发现BBP体系中Pi(CaCl2-P、Citrate-P和HCl-P)含量与有效磷含量呈显著正相关。4种土壤磷组分含量差异取决于不同提取机制与能力的差异,土壤Pi(CaCl2-P、Citrate-P和HCl-P)含量由于铁离子的化学过程[25]而显著高于Po(Enzyme-P)含量。另外,提取体系中采用的柠檬酸和盐酸浓度若较高,则更倾向于表征微生物和植物活化磷素的最大潜能,因此提取浓度较高[12]。
3.2 磷肥减施条件下麦季土壤pH、磷酸酶对磷组分的影响
冗余分析结果表明,pH和S-ALP活性是影响土壤磷素形态和含量的主要因素,而S-ACP作用较弱。笔者研究中,不同磷肥处理对S-ALP活性没有显著影响,这与以往研究结果相似。TIAN等[26]关于外源营养物质添加对磷酸酶活性影响的研究表明,在不同土壤中S-ALP活性对外源磷肥的响应不同,施肥促进草原土壤S-ALP分泌,而抑制荒废农田土壤中S-ALP分泌,此现象主要归因于土壤根系作用的差异。
S-ALP在沉积物的生物释磷过程中具有关键作用,其作为一种可以催化磷酸酯的水解反应和磷酸基团转移反应的专一性磷酸酯水解酶,可促进磷酸酯类有机磷水解成无机磷酸盐化合物;也可作为Ca、Al和Fe等离子的螯合剂[27],使部分难溶性磷酸盐溶解,从而提升土壤中可直接被作物吸收利用的活性无机磷含量[28]。笔者试验中关于S-ALP对土壤磷素影响的研究结果与以往稻季结果一致,即在2013年(第4种植年)水稻季收获期同样得到土壤活性无机磷含量与S-ALP活性呈正相关关系[4]。此外,WALDRIP等[29]建立结构方程模型来研究施加有机肥条件下草原土壤S-ALP活性与土壤磷组分间的关系,结果表明S-ALP活性与Pi呈正相关而与Po呈负相关。S-ALP活性与Po间关系较复杂,土壤Po被S-ALP分解后的不同去向(作物吸收或扩散到上覆水等)、土壤磷组分含量差异以及作物的根系作用均对其有直接影响,因此S-ALP与土壤磷素(Pi、Po)间的相关关系有待进一步深入研究。
另外,pH是影响土壤磷素的关键因素,这与DELUCA等[12]的研究结果相一致。相关研究表明,酸性土壤中pH的增加,一方面使土壤中氢氧化铁/铝含量降低,从而降低土壤对磷素的吸附和沉淀作用[30],另一方面铁/铝化合物随pH增加而水解,从而增加土壤中作物可直接利用磷含量[31],进而呈现土壤磷组分含量随pH增加而升高的现象。
4 结论
采用土壤磷素生物分级法评价宜兴、常熟两个稻麦轮作区不同磷肥处理下麦季收获期土壤磷素生物有效性。磷肥减施7 a后,BBP分级法中4种磷组分含量由大到小均依次为HCl-P、Citrate-P、Enzyme-P和CaCl2-P,无机磷(Citrate-P、HCl-P)含量与有效磷含量呈显著正相关,pH与S-ALP是影响土壤磷组分的关键因素。就宜兴试验田而言,与常规对照(PR+W)相比,稻季不施磷的磷肥减施处理(PW)土壤有效磷含量虽降低,但产量未受影响,而对于常熟试验田PW处理土壤磷素供应能力与PR+W处理之间则不存在显著差异,因此从土壤磷素生物有效性层面解释了太湖稻麦轮作区稻季减施磷肥方案迄今仍可行的原因。

