不同类型短期逆境胁迫对蕉园土壤团聚体组成及酶活性的影响①
邓照亮,陈莎莎,孙 敏,杨 华,李 真,王世梅,沈其荣
不同类型短期逆境胁迫对蕉园土壤团聚体组成及酶活性的影响①
邓照亮,陈莎莎,孙 敏,杨 华,李 真,王世梅*,沈其荣
(南京农业大学资源与环境科学学院/江苏省固体有机废弃物资源化高技术研究重点实验室,南京 210095)
采集海南蕉园土壤,通过室内模拟试验研究不同类型环境胁迫对土壤团聚体组成及酶活性的影响。土样经干旱、渍水、酸化和病原菌入侵处理后,采用湿筛法筛分不同粒径团聚体,并进行土壤酶活性和微生物检测。结果发现,除酸化处理土壤>2 mm团聚体比例高于对照外,其余各处理土样>0.25 mm团聚体所占比例与对照相比均显著下降,而<0.25 mm小团聚体比例均显著增加。土壤蔗糖酶、脲酶、磷酸酶和过氧化氢酶等的酶活性与对照相比下降20% ~ 90%。土样经不同处理后细菌数量均显著降低,酸化和病原菌入侵后尖孢镰刀菌数量由原来102CFU/g分别提高到103CFU/g及104CFU/g。Miseq测序结果显示,土壤微生物群落结构也发生了显著变化。结果表明,短期逆境胁迫会影响蕉园土壤结构及功能,降低土壤质量。
蕉园土壤;团聚体;酶活性;微生物群落结构
香蕉,是一种芭蕉科芭蕉属植物。香蕉喜湿热气候,在土层深、土质疏松、排水良好的土壤中生长旺盛,是我国南方热带亚热带地区重要的经济作物[1-2]。海南依靠自身的区位、气候、资源,大力发展香蕉生产,是我国重要的香蕉产区,但近年来受到香蕉土传枯萎病的侵害,当地蕉园损失严重。香蕉枯萎病是由尖孢镰刀菌古巴专化型4 号生理小种(f. sp.race 4)侵染而引起的一种土传病害[3-4]。目前,防控香蕉枯萎病采取的措施主要包括:选育抗性品种、轮作、化学熏蒸和生物防治等,均取得一定的效果[5-6]。近年来极端气候经常出现,如旱、涝、酸雨时有发生,以及种植区病原微生物的入侵等,这些因素对香蕉枯萎病的发生起着不可忽视的作用。研究表明,土壤病原微生物数量增加易导致枯萎病发生[7-8],而气候变化及自然灾害的发生严重影响土壤的理化性质、微生物功能[9-10 ],故自然灾害等逆境条件影响蕉园土壤性质,并与土传病害的发生存在密切关联。鉴此,本研究通过室内模拟试验探讨蕉园土壤受到旱、涝、酸雨及病原菌入侵等不利因素对土壤团粒结构、酶活性及微生物群落结构的影响,以阐明不同类型短期逆境胁迫对蕉园土壤结构及功能的影响,进而为防控香蕉枯萎病、促进香蕉产业的可持续发展提供理论参考。
1 材料与方法
1.1 供试土壤
香蕉园土壤(玄武岩砖红壤),于2015年9月采自海南临高县临城镇蕉园(109°49′ E,19°47′ N)。采集5 ~ 20 cm土层土壤,土壤pH 5.9,含水量254.8 g/kg。土样经风干,过5 mm筛,备用。
1.2 试验设计
取500 g土样装于1 000 ml的培养瓶中。设置4个处理:①干旱,土样含水量控制<100 g/kg,置于25℃室温培养30 d;②渍水,土样含水量保持在300 ~ 400 g/kg,置于25℃温室培养30 d;③酸化,土样滴加0.005 mol/L H2SO430 ml,培养30 d(测定土壤pH 5.39);④病原菌入侵,土样添加香蕉尖孢镰刀菌孢子(,105个/ml)悬液120 ml,培养30 d;⑤对照,保持土壤正常含水量在250 g/kg左右。每个处理设3个重复。培养结束后,测定团聚体的组成比例;土壤酶活性及土壤中微生物群落组成的变化,并分析不同处理间差异。
1.3 土壤团聚体筛分
采集处理后的土样,在室温下自然风干。当土壤含水量达到塑限时,用手沿着土壤的自然断裂缝隙掰成粒径约2 cm的土样。准确称取100 g土样置于套筛孔径至上而下依次为2、0.25、0.053 mm筛板的最上层,再将整个套筛置于装有去离子水的容器中,浸没,静置10 min,然后将其置于湿筛机上(FT-3型电动团粒分析器)进行筛分,时间为5 min。湿筛机振幅上下3 cm,频率为30次/min。整个湿筛过程套筛组中的土样须浸没水中。湿筛完毕后,将每个筛子上的团聚体用去离子水洗至白色托盘,并收集到铝盒中,留在桶内<0.053 mm的粒级的团聚体静置48 h后再收集。将收集到的样品冷冻干燥,用于酶活性测定。再随机选取3次湿筛分级后的团聚体样品,于105℃烘干,称重,计算各粒级团聚体组成[11]。
1.4 土壤酶活性测定
土壤蔗糖酶、脲酶、中性磷酸酶、过氧化氢酶活性测定按酶活试剂盒(科铭生物,苏州科铭生物技术有限公司)说明书提供的方法进行。
1.5 土壤微生物的测定
土培试验结束后,取样测定不同处理土壤中细菌、真菌及尖孢镰刀菌()的数量。土壤微生物计数采用稀释平板法。细菌采用牛肉膏蛋白胨培养基,真菌采用马丁氏培养基,尖孢镰刀菌采用Komada 选择性培养基[12],于28 ℃分别培养1 ~ 2、3 ~ 5 及5 ~ 7 d,计数平板上的菌落数(colony forming unit,CFU)。
1.6 土壤DNA提取及Miseq测序
土壤DNA提取:取约0.5 g混合土壤样品,按照土壤DNA 提取试剂盒(PowerSoil DNA Isolation Kit)操作步骤说明提取土壤DNA,–20 ℃保存,备用。土壤DNA 样品MiSeq 高通量测序送至上海凌恩生物技术有限公司完成。测定项目包括细菌和真菌,测序步骤参照Caporaso 等[13]和Kozich 等[14]的方法。细菌16S rRNA 采用引物563F:5′-AYT GGG YDT AAA GVG -3′;802R:5′-TAC NVG GGT ATC TAA TCC -3′ 测定V4区序列;真菌ITS 采用引物ITS1F:5′-CTT GGT CAT TTA GAG GAA GTA A-3′;ITS2R:5′-GCT GCG TTC TTC ATC GAT GC-3′ 测定ITS区序列。
1.7 数据分析
数据统计分析使用Excel和SPSS 19.0软件,通过Duncan新复极差法检验处理间差异的显著性水平,用Origin 8.6 软件作图。
2 结果与分析
2.1 不同处理对土壤团聚体组成的影响
干旱、渍水、酸化和病原菌入侵处理对土壤稳定性团聚体的影响见表1。在各短期逆境胁迫处理土壤中,>2、2 ~ 0.25、0.25 ~ 0.053和<0.053 mm这4个粒级的团聚组成与对照相比均发生了改变。除酸化处理土壤>2 mm团聚体所占比例较对照提高42% 外,其余各处理均较对照降低,尤其渍水处理>2 mm团聚体所占比例较对照降低约160%。而<0.25 mm小团聚体,各短期逆境胁迫处理后团聚体比例均高于对照,0.25 ~ 0.053 mm团聚体所占比例均较对照提高80% 以上,<0.053 mm的黏粒所占比例是对照的4倍有余。

表 1 不同处理土壤团聚体的组成变化
注:表中同列不同小写字母代表不同处理间差异显著(<0.05)。
2.2 不同处理对土壤酶活性的影响
由图1可知,土壤经干旱、渍水、酸化和病原菌入侵短期逆境胁迫处理,蔗糖酶活性与对照相比分别降低了48.82%、53.79%、54.38%、54.71%;脲酶活性较对照分别降低了26.09%、21.74%、33.04%、29.57%;磷酸酶活性较对照分别降低了55.05%、44.84%、65.37%、61.70%;过氧化氢酶活性较对照分别降低了19.28%、54.06%、89.29%、82.05%。说明干旱、渍水、酸化等处理影响了土壤酶的活性。
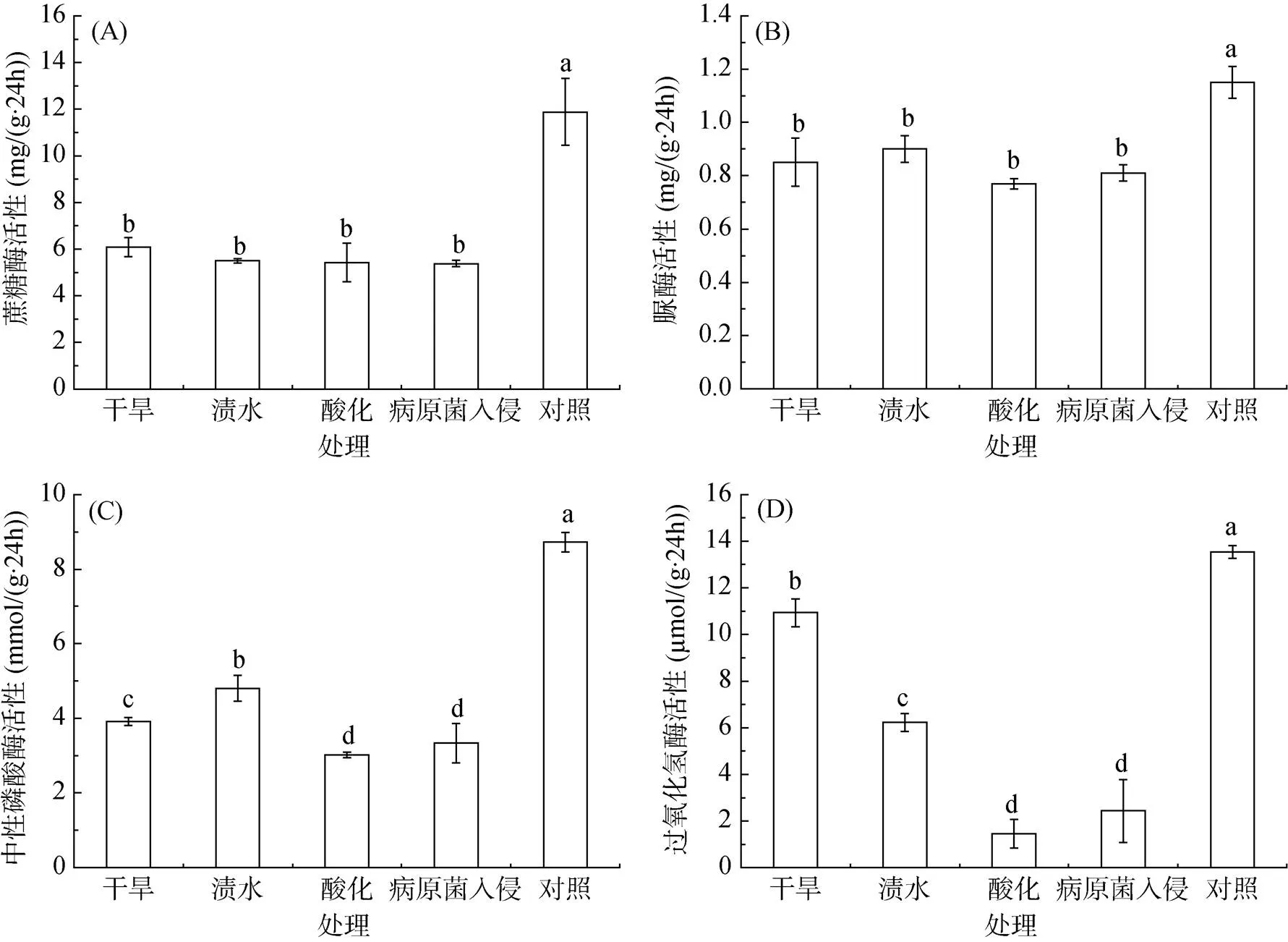
(图中柱图上方不同小写字母代表不同处理间土壤酶活差异显著(P<0.05))
2.3 不同处理对土壤微生物种群数量的影响
由图2可知,土壤经干旱、渍水、酸化和病原菌入侵短期逆境胁迫处理后,细菌数量较对照均显著下降;真菌数量除病原菌入侵处理较对照有所提高外,其余各处理真菌的数量均低于对照,而酸化处理后的土壤中真菌数量与干旱、渍水处理相比略有提高,但差异不显著。酸化及病原菌入侵处理后,尖孢镰刀菌的数量与对照相比均显著提高,分别由原来的102CFU/g提高到了103CFU/g及104CFU/g。
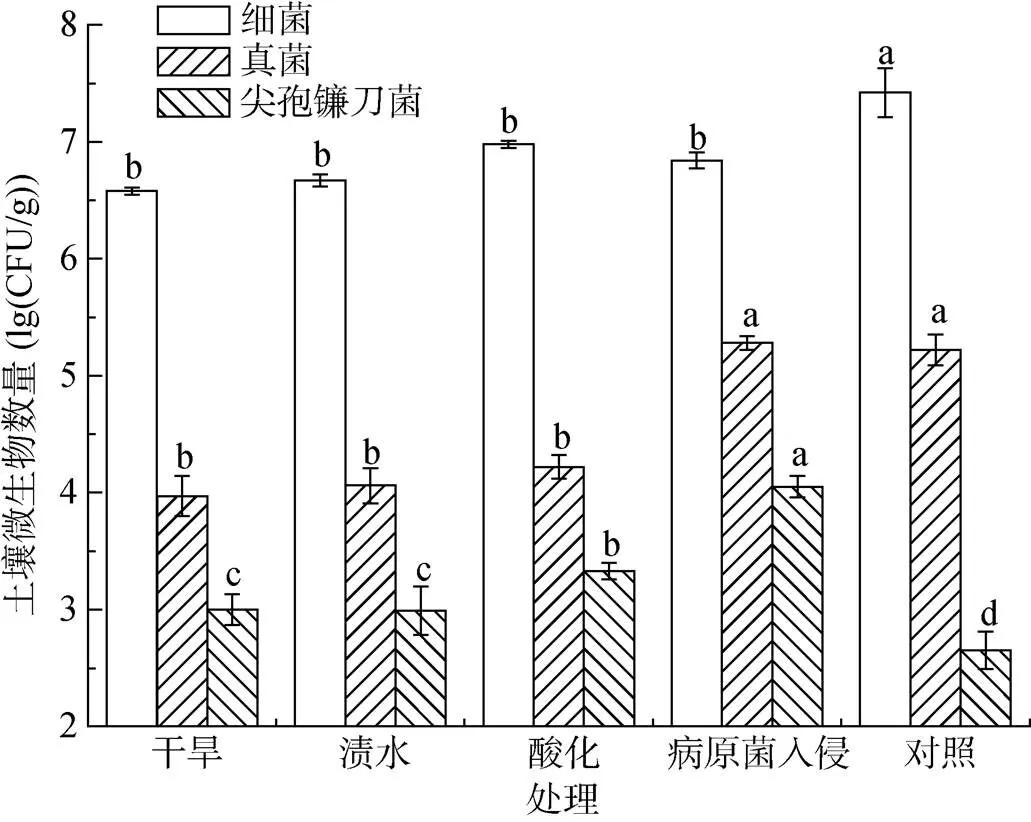
(图中不同小写字母表示同一类微生物在不同处理间差异显著(P<0.05))
2.4 不同处理对土壤微生物群落结构的影响
由图3A可知,土壤经干旱、渍水、酸化和病原菌入侵短期逆境胁迫处理后,在细菌门水平上相对丰度最高的7个门分别是酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、浮霉菌门(Planctomycetes)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia),占各处理细菌总序列的90% 以上。与对照相比,各短期逆境胁迫处理疣微菌门丰度变化较小,酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)的丰度显著降低,放线菌门(Actinobacteria)的丰度除渍水处理较对照下降外,其他3个处理其丰度显著增加,厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)的丰度显著增加,且厚壁菌门(Firmicutes)丰度在渍水处理后增幅最大,增加55.27%,在干旱处理后丰度显著降低。
由图3B可知,土壤短期逆境胁迫处理后,子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)相对丰度较高,占各处理真菌总序列的70% 以上。与对照相比,干旱、酸化和病原菌入侵处理土壤子囊菌门(具有有性生殖阶段的镰刀菌属于该门)的丰度显著增加,分别提高了40.07%、32.13%、31.70%,但渍水处理其丰度较对照略有下降;担子菌门的丰度经干旱、渍水、酸化和病原菌入侵处理后显著下降,分别降低了37.98%、22.44%、35.97%、36.35%;经渍水处理后壶菌门丰度显著提高,与对照比提高了3.89%。

图3 不同处理土壤中细菌门(A)、真菌门(B)的相对丰度变化
3 讨论
土壤理化性质对土壤功能的发挥起着重要作用[15-16],经过干旱、渍水和病原菌入侵处理后,土壤蔗糖酶、脲酶、磷酸酶和过氧化氢酶活性与对照相比显著降低(图1),而土壤微生物数量(细菌和真菌)与对照相比,亦显著下降(图2),表明土壤酶活性与土壤微生物数量呈正相关[17]。原因可能是,干旱使土壤水分大量丧失,部分微生物因干燥而死亡;渍水处理,土壤含氧量下降,好氧微生物受到抑制,土壤酶活性降低;酸化则抑制了不耐酸微生物的生长活性,王富国等[18]在研究不同种植年限酸化果园土壤微生物学性状时发现,土壤蔗糖酶、脲酶及过氧化氢酶活性均随种植年限增加,随酸化程度加剧而下降。
土壤团聚体是矿物质、有机质、生物质相互作用在特定条件下的组合,是土壤最基本结构单元[19]。研究表明,大团聚体可提高土壤质量,塑造良好的土壤结构,调节土壤通气与持水、养分释放与保持的矛盾,促进作物生长,防控土传病害发生[20]。土壤团聚体形成过程中细菌分泌的多糖、真菌菌丝及植物根系对团聚体的形成与稳定起着重要作用[21-22]。本研究发现,土壤经逆境胁迫后,土壤中细菌数量均下降,土壤真菌除病原菌入侵处理数量略有上升外,干旱、渍水和酸化处理亦显著下降。土壤微生物数量减少,不利于小团聚体向大团聚体转变。文献报道土壤大团聚体的形成与土壤微生物量和微生物多样性呈正相关性[23],尤其丝状真菌对大团聚体的形成和稳定性起着重要作用[24]。<0.25 mm的小团聚体所占比例均高于对照,这与土壤微生物数量变化相符。各种不利因素处理后,与对照相比,土壤微生物群落结构发生了较大变化,细菌门水平上酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)丰度与对照相比显著下降;真菌门水平上,干旱、酸化和病原菌入侵处理子囊菌门(Ascomycota)丰度显著增加,而渍水处理子囊菌门丰度有所下降,图3B表明子囊菌门(Ascomycota)是真菌最主要的类群,占真菌丰度的50% ~ 90%,具有有性生殖阶段的镰刀菌及多种常见的动植物病原菌属于该门[25]。沈宗专[26]研究认为土壤中子囊菌门真菌丰度升高与香蕉枯萎病的爆发有一定的关系。
4 结论
蕉园土壤经短期干旱、渍水、酸化和病原菌入侵逆境胁迫处理后,土壤大粒级团聚体(> 0.25 mm)比例下降17% ~ 21%,土壤蔗糖酶、脲酶、磷酸酶及过氧化氢酶的酶活性降低20% ~ 90%,土壤微生物数量及群落结构也发生了较大变化,其中渍水处理显著降低了子囊菌门(Ascomycota)真菌丰度,酸化与病原菌入侵处理大幅提高了土壤中尖孢镰刀菌的数量。
[1] Wei Y R, Yang H, Huang B Z, et al. Advances in biotechnological research in banana breeding[J]. Fruit Science, 2003, 20(5): 393–398
[2] 黄秉智, 周灿芳, 吴雪珍, 等. 2011年广东香蕉产业发展现状分析[J]. 广东农业科学, 2012(5): 12–15
[3] 沈宗专, 钟书堂, 赵建树, 等. 氨水熏蒸对高发枯萎病蕉园土壤微生物区系及发病率的影响[J]. 生态学报, 2015, 35(9): 2946–2953
[4] Pegg K G, Moore N Y, Bently S.wilt of banana in Australia: a review[J]. Agricultural research, 1996, 47(5): 637–649
[5] Saravanan T, Muthusamy M, Marimuthu T. Development of integrated approach to manage the fusarial wilt of banana[J]. Crop Protection, 2003, 22(9): 1117–1123
[6] 钟书堂, 沈宗专, 孙逸飞, 等. 生物有机肥对连作蕉园生产和土壤可培养微生物区系的影响[J]. 应用生态学报, 2015, 26(2): 481–489
[7] 张瑞福, 沈其荣. 抑病型土壤的微生物区系特征及调控[J]. 南京农业大学学报, 2012, 35(5): 125–132
[8] 丁文娟, 曹群, 赵兰凤, 等. 生物有机肥施用期对香蕉枯萎病及土壤微生物的影响[J]. 农业环境科学学报, 2014, 33(8): 1575–1582
[9] 孙萌, 张雪梅, 牛宝清, 等. 河北太行山干旱片麻岩山地土壤理化性质[J]. 林业科技开发, 2013, 27(6): 39–43
[10] 赵静, 韩甜甜, 谢兴斌, 等. 酸化梨园土壤酶活性与土壤理化性质之间的关系[J]. 水土保持学报, 2011, 25(4): 115–120
[11] Yoder R E. A direct method of aggregate analysis of soils and a study of the physical nature of erosion[J]. American Society of Agronomy, 1936, 28: 337–351
[12] Komada H. Development of a selective medium for quantitative isolation offrom natural soil[J]. Review of Plant Protection Research, 1975, 8: 114–125
[13] Caporaso J G, Lauber C L, Walters W A, et al. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108: 4516–4522
[14] Kozich J J, Westcott S L, Baxter N T, et al. Development of a dual-index sequencing strategy and curation pipeline for analyzing amplicon sequence data on the MiSeq Illumina sequencing platform[J]. Applied and Environmental Microbiology, 2013, 79 (17): 5112–5120
[15] 王仁山, 王义华, 隋好林, 等. 改良土壤是测土配肥过程中的重要环节——土壤酸碱度的改良[J]. 磷肥与复肥, 2006, 21(6): 68–70
[16] 王理德, 王方琳, 郭春秀, 等. 土壤酶学研究进展[J]. 土壤, 2016, 48(1): 12–21
[17] 马瑞萍, 安韶山, 党廷辉, 等. 黄土高原不同植物群落土壤团聚体中有机碳和酶活性研究[J]. 土壤学报, 2014, 51(1): 104–113
[18] 王富国, 宋琳, 冯艳, 等. 不同种植年限酸化果园土壤微生物学性状的研究[J]. 土壤通报, 2011, 42(1): 46–50
[19] 卢金伟, 李占斌. 土壤团聚体研究进展[J]. 水土保持研究, 2002(9): 81–85
[20] 牛文静. 长期施肥下太湖地区水稻土不同团聚体颗粒组的酶活性及微生物生物量研究[D]. 南京: 南京农业大学, 2009
[21] Li L Q, Zhang X H, Zhang P J. Variation of organic carbon and nitrogen in aggregate size fractions of a paddy soil under fertilization practices from Tai Lake Region, China [J]. Journal of the Science of Food and Agriculture, 2007, 87: 1052–1058
[22] Oades J M. Soil organic matter and structural stability: Mechanisms and implications for management[J]. Plant Soil, 1984, 76: 319–337
[23] 李景, 吴会军, 武雪萍, 等. 长期不同耕作措施对土壤团聚体特征及微生物多样性的影响[J]. 应用生态学报, 2014, 25(8): 2341–2348
[24] 李娜, 韩晓增, 尤孟阳, 等. 土壤团聚体与微生物相互作用研究[J]. 生态环境学报, 2013, 22(9): 1625–1632
[25] Berbee M L. The phylogeny of plant and animal pathogens in the Ascomycota[J]. Physiological and Molecular Plant Pathology, 2001, 59(4): 165–187
[26] 沈宗专. 抑制香蕉土传枯萎病土壤的微生物区系特征及调控[D]. 南京: 南京农业大学, 2015
Effects of Different Short-Term Stresses on Aggregate Compositions and Enzyme Activities ofBanana Orchard Soil
DENG Zhaoliang, CHEN Shasha, SUN Min, YANG Hua, LI Zhen, WANG Shimei*, SHEN Qirong
(College of Resources and Environmental Sciences, Nanjing Agricultural University / Jiangsu Provincial Key Lab for Organic Solid Waste Utilization, Nanjing 210095, China)
Soil samples were collected from a banana orchard in Hainan, the distribution of soil aggregates and enzyme activities were analyzed after the soils were cultured under various conditions such as drought, wet, acidification and pathogen invasion (). Soil aggregates (>2, 2-0.25, 0.25-0.053 and <0.053 mm) were separated by wet sieve method. Compared with the control, the proportion of water-stable macroaggregates (>0.25 mm) significantly decreased except for the >2 mm macroaggregates under acidification, while microaggregates (< 0.25 mm) increased significantly in all the treatments. The activities of soil invertase, urease, phosphatase and catalase were reduced by 20%-90%, and bacteria populations were also significantly reduced. Acidification and pathogen invasion significantly increased the numbers offrom 102CFU/g to 103CFU/g and 104CFU/g respectively. DNA analyses indicated that soil microbial community structure was also significantly changed. Thus, adverse environmental factors can seriously affect soil quality, e.g., aggregate formation and soil enzyme activities.
Banana Orchid soils; Aggregates; Enzyme activities; Microbial community structure
国家重点基础研究发展计划(973计划)项目(2015CB150504)和国家自然科学基金项目(41671256)资助。
(smwang@njau.edu.cn)
邓照亮(1990—),男,安徽安庆人,硕士研究生,主要从事土壤微生物方面的研究。E-mail:2014103043@njau.edu.cn
10.13758/j.cnki.tr.2018.03.007
S182
A

