膜电解氢自养MBBR反应器深度转化水中高氯酸盐
万东锦,牛振华,刘永德,肖书虎 (.河南工业大学化学化工与环境学院,河南 郑州 45000;.环境基准与风险评估国家重点实验室,中国环境科学研究院,北京 000)
高氯酸盐是一种常见的水体污染物[1].其主要作为强氧化剂及添加剂广泛应用于烟花爆竹、润滑油提炼等生产领域,进入自然环境后可长期稳定存在,当前各地饮用水中频繁检出高氯酸盐.生物法还原去除水中高氯酸盐是指在缺氧或厌氧的条件下,微生物利用电子供体将其还原为氯离子的方法.与其他物理化学法相比,生物法具有高效率、低成本,同时实现了高氯酸根形态的无害转化等优点[2-4].
自养还原高氯酸盐通常以氢气、硫、零价铁等无机物为电子供体[5-6].其中,氢是理想的电子供体,反应过程清洁,微生物增殖缓慢,无有害副产物产生,不存在二次污染.但氢气存在着易燃易爆,不易运输,溶解度低等问题.
膜电解反应器实现了氢气的灵活供给及高效利用,逐渐受到研究者的重视,使用阳离子交换膜将直流电解槽分割成阴极及阳极区域,在阴极区域接种培养的高氯酸盐还原菌利用阴极产生的氢气将高氯酸盐还原[7-10].研究表明,该反应器在序批式实验模式下,施加电流为 20~60mA 时,反应器的去除率达到95.03%~98.99%[11].在连续运行条件下,施加电流分别为10mg/L和300mA,水力停留时间(HRT)从12h降低至 4h,出水 ClO4-浓度呈增大趋势,但去除率仍保持在99%以上[10].
需要指出的是,传统膜电解过程中,阴极室溶液pH值呈上升趋势,随着施加电流的增大,pH值增幅显著,常规方法往往通过向阳极室施加酸性溶液的方法稳定阴极室 pH 值[12].然而前期研究发现[13],在较高 pH值(pH=9.0)条件下,氢自养还原细菌依然可以维持较高的活性,此时反应速率可达 2.450mg ClO4-/(g VSS⋅h).这也就意味着,膜电解体系中阴极区域 pH值的升高对高氯酸盐去除的抑制作用较为有限,阳极室施加酸性溶液并非必须,即阳极反应也可以加以利用.
基于以上研究背景,本研究在传统膜电解基础上通过改变进出水流向,将电化学阳极反应纳入处理流程,建立膜电解氢自养 MBBR反应器.与传统膜电解反应器相比,本研究一方面实现了水中高氯酸盐的深度转化,另一方面将阳极反应纳入处理流程,避免了酸溶液施加,同时氯离子在阳极被氧化成活性氯,活性氯的存在进一步提升了出水水质.
本研究考察了不同施加电流条件下,高氯酸盐去除率、有效电流、电流效率、pH值及阳极室活性氯的变化规律.并结合反应器运行状况,利用扫描电镜(SEM)和高通量测序技术对反应器内微生物群落形态、群落结构演替展开分析.
1 实验部分
1.1 反应装置原理及其建立
本研究所建立的反应装置如图1所示,主反应器为长方体型,材质为有机玻璃.阴极室及阳极室尺寸均为长8cm×宽7cm×高10cm=560cm3,反应器阴极室内装填Kaldnes K1填料,Kaldnes K1填料材质为高密度的聚乙烯(密度为 0.95g/cm3), 9.1mm(直径)×7.2mm(宽度),呈外棘轮状,内壁由十字筋连接,比表面积为 500m2/m3.Kaldnes K1填料填充率为 75%,装填Kaldnes K1填料后阴极室有效容积为370mL,阴阳两极室由质子交换膜(GEFC-107,北京金能)隔开,进水由阴极室自流至阳极室直至最终溢流出水.其中阳极材料:RuIrO2电极;阴极材料:镍板.电极有效面积6cm×9cm,极间距5cm,阴阳两室均用泵循环溶液避免浓差极化.阴阳极室内发生如下反应:阴极室:
阴极析氢反应
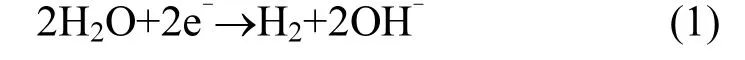
微生物氢自养反应

阳极室:
氯离子氧化反应

阳极析氧反应

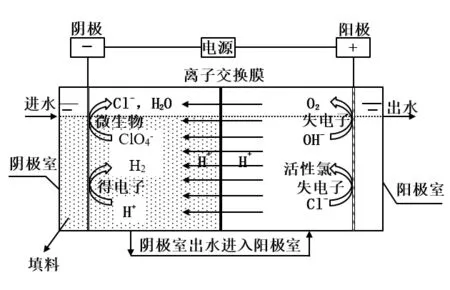
图1 反应装置及原理示意Fig.1 Experimental set-up
其中,阳极室内由于 EΘ)=1.36V>EΘ)=1.23V,因而氯离子氧化反应会优先于析氧反应发生.在阴极室内微生物利用电解产生的氢气将高氯酸盐降解为氯离子,而后氯离子在阳极室被阳极氧化生成活性氯,活性氯具有杀菌作用,可进一步提升出水水质.
本研究进水采用去离子水配水.初始高氯酸根浓度为(4.98±0.091)mg/L,同时添加基础培养基和微量元素溶液(1mL/L),各组分及其含量分别见表 1和表 2.进水用 N2(99.9%)吹脱出其中的溶解氧使水桶内处于低溶解氧状态(DO<2.0mg/L),再经蠕动泵抽入阴极室.

表1 基础培养基组成Table 1 Composition of basal medium

表2 微量元素溶液组成Table 2 Composition of trace elements
1.2 反应器接种驯化与运行
取五龙口污水处理厂生物池厌氧区活性污泥,将填料浸泡 24h进行接种,初始接种生物量为3.88gVSS/L,进水高氯酸根浓度为(4.98±0.091) mg/L,在(25±2)℃条件下运行反应器,施加电流分别为 6,8,10,15,20mA.根据施加电流的不同分为5个周期,每个周期运行9d,其中,前3d视为微生物适应期,不取样记录数据,适应期结束后反应器开始正式运行,每周期正式运行 6d,共 30d.每周期正式运行阶段,定时监测进出水高氯酸根浓度、pH值等指标,出水高氯酸盐浓度波动<5%视为已达到稳态运行,进而可调整施加电流,开展下一阶段的实验.
1.3 分析与测定
水样经过 0.22µm 水系滤膜过滤后测定各参数.本实验中ClO4-离子采用美国热电ICS-600离子色谱仪测定,测定条件:色谱柱型号 AS16,KOH 淋洗液(25mmol/L),淋洗液流速 1.0m L/min,柱温 30℃,进样量 10µL,此条件下 ClO4-的保留时间为15min,其检出限为0.05mg/L. pH值采用pH计(上海雷磁PHS-3C)测定.TOC、NPOC采用 TOC测定仪(日本岛津TOC-LCPN)测定.浊度值采用浊度仪(上海昕瑞WGZ-200)测定,ORP采用多参数水质分析仪(美国哈希HQ30d)测定.活性氯采用N,N-二乙基-1,4-苯二胺光度法测定[14].
分别取反应器接种及正式运行第 24d的生物样品,样品DNA的提取及扩增采用已有方法[13].扩增后的DNA样本送至生工生物工程(上海)股份有限公司进行测序,测序平台为 Illumina Miseq 2×300.高质量序列去除前后引物以及标签后,利用 Mothur软件对得到的全部序列进行比对,去除引物、嵌合体和长度小于200bp的序列,并在97%的相似性水平上计算序列遗传距离,该矩阵用于确定 OTUs(operational taxonomic units).同时基于物种丰富度的分析,使用Mothur软件计算 Alpha多样性指数中的丰富度(Chao1指数、Ace指数)、多样性指数(Simpson指数和Shannon-Wiener多样性指数)和覆盖度(Coverage).
2 结果与讨论
2.1 反应器对ClO4-的去除效果
根据施加电流的不同将整个研究过程分为第I、II、III、IV、V阶段,5个正式运行阶段反应器运行效果如图 2(a)所示,对应有效电流及电流效率变化情况如图2(b)所示.
进水高氯酸根浓度为(4.98±0.091)mg/L,当施加电流为 6mA,反应器稳态运行时,出水浓度为(3.00±0.10)mg/L,电流效率达到(6.43±0.24)%,有效电流为(0.39±0.03)mA.当电流强度增加至 8mA,出水浓度较第 I阶段降低,为(2.50±0.03)mg/L,电流效率保持在(6.20±0.11)%,有效电流较之前略微增加为(0.47±0.04)mA.增加电流强度至 10mA,出水浓度进一步降低,为(2.10±0.04)mg/L,电流效率为(5.94±0.15)%,有效电流增加至(0.59±0.01)mA.继续增加电流至15mA时,出水高氯酸根浓度较之前有大幅降低,低于检出限(0.05mg/L),去除率大于(98.99±0.05)%,电流效率达到(6.59±0.17)%,有效电流达到(0.99±0.03)mA.

图2 反应器正式运行期间高氯酸根浓度及电流效率和有效电流随运行时间的变化Fig.2 The variations of (a) perchlorate concentration and (b)the efficiency of applied current during operation time
由图 2(b)可知,随着施加电流的增加(6~15mA),出水高氯酸根浓度呈降低趋势,有效电流呈现增加态势,电流效率稳定在 5.94%~6.43%.表明随着电流强度的增加,阴极室生物反应区的供氢量逐渐趋于饱和,反应器内供氢较为充分,形成较为适宜的环境,使出水高氯酸根浓度不断降低.
此外,施加电流的增加有利于增加反应器氢气的供给,但施加电流过大会导致阴极室pH值过高以至偏离微生物的适应范围,进而导致对高氯酸根去除率的下降.继续增加电流至 20mA,阴极室溶液 pH值超过 9.5,导致出水高氯酸根浓度升高至(3.46±0.02)mg/L,对应去除率降至(30.75±1.19)%.传统膜电解反应器通过阳极室加酸的方法,施加不同的电流实现了高氯酸盐 94.19%~98.38%以上的去除率,对应电流效率在 2.4%~19.39%范围内波动,电流效率呈先升高后降低的趋势[11].本研究所建立的反应器避免了酸性溶液的添加,电流效率与传统膜电解反应器相差不大.
2.2 进出水pH值的变化情况
微生物还原高氯酸根的过程需要在适宜的 pH值下进行,电化学反应器运行过程中需要准确控制HRT及施加电流,使得反应器供氢充分的同时还能兼顾阴极室溶液 pH值处于合适的范围,最大限度地发挥微生物对高氯酸根的降解作用.
反应器正式运行时各室溶液pH值的变化如图3所示,进水及阳极室总出水pH值波动不大,进水pH值维持在 7.62~7.87.阴极室出水自流进入阳极室直至最终出水,电解水反应中阴极产生的 OH-可以被阳极产生的 H+中和(式(1)和(4)),使得总出水 pH 值一直处于较为稳定的状态,为 7.96~8.11.阴极室溶液 pH 值随着施加电流的增大而增大,ClO4-去除率呈先升高后降低的趋势.电流强度依次为6、8、10和15mA时,阴极室生物反应区溶液pH值依次为8.29±0.04、8.45± 0.03、8.58±0.08 和 8.74±0.04,对应 ClO4-去除率依次提高分别为(39.75±2.09)%、(49.71±1.00)%、(57.31±1.62)%和(98.99±0.05)%.这与之前研究发现氢自养高氯酸盐还原菌在弱碱性的(pH<9.5)环境下依然可以对高氯酸盐的去除有较高活性的研究果相符[12].

图3 进出水pH值及去除率随运行时间的变化Fig.3 Variations of pH and removal efficiency at different operation stages
当施加电流增至20mA,阴极室溶液pH值急剧增至(9.60±0.06),对应高氯酸根去除率降至(30.75±1.19)%,表明20mA的施加电流导致阴极室生物反应区域pH值过高(>9.5),超过高氯酸盐还原菌的耐受范围,从而抑制高氯酸盐还原菌的活性,影响高氯酸盐的去除效果.相关报道表明,在序批式直接氢自养过程中高氯酸盐还原菌的最适pH值为7.0,pH值过高或过低均会抑制高氯酸盐还原菌活性[15].
总体而言,在本反应体系中,阴极室溶液pH值随施加电流的增大呈现增加态势[9,11],阴极室pH值过高(>9.5)不利于微生物对高氯酸盐的还原降解作用.2.3 反应器阴极室溶液 ORP值、阳极室溶液活性氯浓度及其他理化指标的变化
氢自养还原高氯酸盐反应需要在相对厌氧的环境当中才能实现[16].采用质子交换膜将两极隔开,能够避免阳极产生的O2对阴极室高氯酸盐厌氧还原过程造成影响.电解产生的氢气一方面可被微生物利用降解高氯酸盐,另一方面用于维持反应器内的厌氧环境.ORP(氧化还原电位)能够大致反映反应器内的氧化还原环境,较低的ORP有利于维持高氯酸盐还原菌的活性,运行过程中阴极室溶液 ORP值的变化如图4(a)所示.

图4 阴极室溶液ORP及阳极室溶液活性氯浓度随施加电流的变化Fig.4 (a) ORP variation in cathode chamber and (b) active chlorine concentration variation in anode chamber under different applied current
从图4(a)可知,随着施加电流的增加,阴极室溶液ORP值呈现逐渐降低的趋势.施加电流分别为 6mA和 8mA 时,ORP值分别为(-179.3±5.63)mV 和(-245.9±5.92)mV.此时反应器的去除率为(39.75±2.09)%和(49.71±1.02)%,表明电化学反应器运行过程中较低的施加电流(<10mA)就能够建立氢自养所需的厌氧环境,但产氢量不足,使得去除率不高.
不同施加电流条件下,溶液活性氯浓度如图 4(b)所示,施加电流分别为6、8、10mA条件下,活性氯的浓度依次为(0.057±0.003)mg/L(0.056±0.002)mg/L、(0.057±0.002)mg/L.
理论上,活性氯浓度应随施加电流的增大呈现增大的趋势,但由于6~10mA的施加电流过小,活性氯浓度在检出限(0.05mg/L)附近,其规律性并不明显,但当施加电流分别增至15和20mA时,活性氯浓度逐渐提高至(0.070±0.002)mg/L 和(0.076±0.002)mg/L.
整个运行过程中出水其他水质指标如下:NPOC (不可吹脱性有机碳)(1.49±0.4) mg/L,浊度(0.89± 0.27)NTU.上述指标表明:本研究所建立的反应器出水有机物浓度较低,与异养还原过程相比,无有机物二次污染的问题;自养微生物增殖缓慢,附着于填料且不易随水流出,使得出水浊度始终处于较低水平.
2.4 反应器运行过程中微生物监测
2.4.1 微生物形态变化 实验接种污泥为污水处理厂氧化沟厌氧区污泥,外观呈黑色.随着运行时间的延长,接种污泥逐渐由黑色转为深灰色,沉降性能逐渐提升.采用扫描电镜观察填料、接种污泥、正式运行第12d和第24d反应器内生物样品的形貌特征.
如图 5所示.由如图 5(a)可知,在扫描电镜下,Kaldnes K1填料表面粗糙不平,随着反应器运行时间的延长,反应器内微生物种群结构、形态有了较大的变化.接种污泥内细菌丰富主要为杆菌和球菌,微生物种群结构、形态有了较大的变化.接种污泥内细菌丰富,运行12d后球菌逐渐减少杆菌数量逐渐增多,到第24d反应器运行已经稳定,短杆状细菌逐渐占优势.

表3 样品α多样性相关的各项指标Table 3 α biodiversity of the samples

图5 运行过程中填料及生物样品扫描电镜Fig.5 SEM image of Kaldnes K1and microorganism at different operation stages
2.4.2 微生物群落结构分析 反应器接种及正式运行24d的污泥样品α多样性各项指标如表3所示.从表中可以看出各样品的文库覆盖率均达到99%,表明样品中绝大多数菌属被检出,测试结果可以代表样本实际情况.此外,与接种样品相比,正式运行 24d后反应器内微生物OTU聚类数、Shannon指数、ACE指数和Chao1等α多样性指标整体呈显著下降趋势.由于接种污泥来源于氧化沟,发生反应类型多样,导致其α多样性较高,而反应器开始运行后,反应器内发生的反应类型较为单一,随着运行时间的增加,反应器内微生物菌群逐渐发生演替,氢自养还原菌逐渐凸显,导致菌群α多样性下降[13].
门水平上两样品群落组成结构如图 6(a)所示,结果表明:对比接种微生物菌群,运 24d后,反应器体系内的优势菌门为 Proteobacteria(变形菌门)、Firmicutes(厚壁菌门)、Bacteroidetes(拟杆菌门)和Chlorofexi(绿弯菌门),含量分别为 39.63%, 33.93%,11.41%和6.19%.
为更深入地了解微生物群落结构,对微生物进行属水平上优势菌属分析,结果如图6(b)所示:丰度较高的优势菌属有 Thauera (8.25%)、Hydrogenophaga(7.17%)、Tissierella(7.16%)、Azonexus (5.13%)等.其中Thauera菌属为主要优势菌属,属于 β-Proteobacteria.2013年Mao等[17]研究表明,Thauera菌属为氢自养反硝化优势菌群.2016年本课题组[13]利用氢气驯化高氯酸盐还原菌,培养出以Thauera菌属为代表的高氯酸盐氢自养还原菌.结合本研究反应器工况,可以推测,属Thauera为反应器中主要的高氯酸盐氢自养还原菌.其余优势菌属,如Hydrogenophaga菌属和Tissierella等菌属的功能有待进一步研究.

图6 接种及正式运行24d反应器内微生物群落结构分析Fig.6 Taxonomic classification of the bacterial communities of inoculate sludge and the sample from reactor after 24d of operation
3 结论
3.1 本研究所建立的膜电解氢自养 MBBR反应器对水中(4.98±0.091)mg/L高氯酸盐的去除率可达(98.99±0.05)%以上,出水水质良好.
3.2 直流电的施加能够在阴极室建立氢自养还原高氯酸盐所需的厌氧环境,ORP值始终处于较低的水平(-179.33±5.63)~(-299.21±6.57)mV.
3.3 反应器对高氯酸盐的去除率随施加电流的增大(6~15mA)而增加,但当施加电流过大(20mA)导致阴极室溶液pH值超过9.5时,阴极室内微生物活性受到抑制,导致反应器对高氯酸根的去除率下降.此外,阳极室活性氯的检出表明本研究实现了高氯酸盐→氯离子→活性氯的深度转化.
3.4 反应器运行过程中,微生物形态及菌群结构均发生较大变化.短杆菌数量逐渐增多,菌群α多样性下降,Thauera菌属为主要的氢自养还原优势菌属,其丰度达到8.25%.

