肌萎缩侧索硬化症治疗药物研发进展
李栩琳,杨婉琪,王贵彬,张建军
(中国医学科学院北京协和医学院药物研究所,新药作用机制研究和药效评价北京市重点实验室,北京 100050)
肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)是一种进行性的不可逆性的神经肌肉疾病,因上下运动神经元变性导致延脑、四肢、躯干、胸部及腹部肌肉逐渐无力和萎缩,患者一般死于呼吸衰竭。据流行病学统计,在全球范围内,ALS每年发病率为每10万人中1~2.6人,发病年龄平均58~60岁,平均存活3~4年[1];我国ALS患者更为年轻,平均发病年龄为50岁且生存期普遍较长。全球ALS患者中,90%~95%为散发性ALS(sporatic ALS,sALS),5%~10%为家族性 ALS(fam ilial ALS,fALS),且为显性遗传,至少25个基因经过重复试验验证与之相关[2]。60%~80%fALS患者能检测出确切的突变基因,其中最为常见的是C9ORF72,SOD1,FUS和TARDBP基因突变[3],我国患者中SOD1突变最为常见[4]。ALS的发生发展可能是环境因素和年龄因素等在基因突变的基础上累积而诱发的结果[5]。截至2018年3月,美国FDA批准用于ALS治疗并在我国上市的药物只有利鲁唑(riluzole)和依达拉奉(edaravone),临床上急需更多针对不同靶点的药物以供选择。本综述将结合当前ALS病理机制研究,阐述靶向谷氨酸介导的兴奋性毒性、氧化应激损伤、线粒体损伤、基因突变、异常蛋白聚集和神经营养因子缺乏等机制的药物研发现状,以及酪氨酸激酶、骨骼肌肌钙蛋白复合物、Sigma1受体、TDP-43和C9ORF72等药物新靶点研究现状,以期为今后治疗ALS及其他神经退行性疾病药物研发提供思路。
1 针对不同靶点的药物研发
1.1 抗谷氨酸介导的兴奋性毒性
临床上在fALS和sALS中均观察到由谷氨酸介导的兴奋性毒性所引起的肌肉束颤电位和肌肉痉挛;尸检和临床前实验也证明,神经元过度兴奋会引起轴索甚至神经元本身的退化。谷氨酸是体内重要的兴奋性神经递质,生理状态下,表达在星形胶质细胞上的兴奋性氨基酸转运体2(excitatory am ino acid transporter 2,EAAT2)能重摄取突触间隙中94%的谷氨酸,而ALS患者和动物模型的运动皮质和脊髓EAAT2的表达和活性均严重受损[6-7]。过多的谷氨酸通过突触后膜N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体和α-氨基-3-羟基-5-甲基异噁唑-4-丙酸(α-am ino-3-hydroxy-5-methylisoxazole-4-propionic acid,AMPA)受体引起神经元钙内流和胞内钙释放增加,过多的Ca2+会引起内质网应激和线粒体超载等,导致细胞死亡,是运动神经元变性的常见诱因。
利鲁唑是目前治疗ALS的一线用药,能抑制NMDA受体和AMPA受体的兴奋性突触后效应,阻滞电压门控钙通道从而减少谷氨酸释放,抑制持续钠电流,抑制神经元重复放电,降低神经元的兴奋性[8]。1994年,155名患者的临床试验结果显示,服用利鲁唑12个月,患者的存活率比安慰剂组延长约3个月,且肌肉功能的退化也相对延缓[9]。1998年,在959名患者的大规模临床试验中进一步证实,利鲁唑能在疾病早期有效延缓疾病进程[10]。2002年,基于以上2个试验的研究亦证明利鲁唑安全性良好[11]。因此,利鲁唑作为谷氨酸拮抗剂仍为临床上最重要的治疗药物。
β-内酰胺类抗生素如青霉素及其衍生物、头孢菌素类能刺激EAAT2启动序列,使EAAT2水平升高,增加谷氨酸的重摄取[12]。其中头孢曲松(ceftriaxone)能延缓模型动物神经元死亡和运动功能丧失,具有潜在的神经保护作用,但Ⅲ期试验中未能显著改善患者运动能力,且未延长寿命[13]。但是由于EAAT2是体内重要的谷氨酸再摄取转运体,其仍为重要的药物靶点之一。
右美沙芬(dextromethorphan)是非竞争性NMDA受体拮抗剂,对谷氨酸和单胺类神经递质以及离子通道有调节作用[14]。以右美沙芬和小剂量奎尼丁(CYP2D6代谢酶抑制剂)组成的复方Nuedexta在Ⅱ期临床试验中可改善语言、吞咽和唾液分泌等延脑功能[15]。他仑帕奈(talam panel)是AMPA受体非竞争性拮抗剂,抑制其对Ca2+的通透性,减少钙超载引起的神经元死亡,虽然在临床Ⅱ期试验中未能达到主要终点,但动物实验显示,在症状出现前给予他仑帕奈能有效抑制易感神经元的钙超载[16-17],提示如果ALS能实现及早诊断,他仑帕奈也有望进入临床。抗惊厥药瑞替加滨(retigabine)通过激活整流K+电流使神经元超极化,具有降低神经元兴奋性的作用。Ⅱ期临床试验显示,其能延缓疾病进程[18-19]。
1.2 抗氧化应激损伤
氧化应激损伤是由活性氧簇(reactive oxygen species,ROS)产生速度和机体对其清除能力之间的不平衡引起。细胞内ROS是有氧代谢的副产物,绝大多数是由于线粒体呼吸链中电子泄露、氧化磷酸化不完全形成的,通常包括超氧阴离子和过氧化氢;ROS还可以与其他自由基作用生成活跃的过氧硝酸基(ONOO-)和羟自由基(·OH)。ALS患者中主要的内源性抗氧化酶超氧化物歧化酶(superoxide dismutase,SOD)和8-羟基脱氧鸟苷降低,氧化型谷胱甘肽与还原型谷胱甘肽比值升高[20],脑脊液和血清中脂质过氧化产物4-羟基壬烯醛含量随病程发展逐渐升高[21],脂质过氧化产物3-硝基酪氨酸增加[22]。有研究者甚至认为,与ALS风险相关的因素如农药、重金属、职业运动、体力劳动过度、慢性头部创伤和吸烟等都促进了氧化应激产生[23]。
依达拉奉临床用于治疗急性脑卒中,2017年获美国FDA批准用于ALS治疗,对动物模型和临床患者都表现出强大的自由基清除能力。在SOD1小鼠[24]、wobbler小鼠和转基因大鼠[25-26]中都能有效延缓运动神经元退化。给予依达拉奉后,患者血浆中尿酸(体内过氧硝酸盐的主要清除剂)升高[27];几乎所有患者脑脊液中3-硝基酪氨酸的含量都降至检测限以下[28]。2008年日本1项多中心大规模Ⅱ期试验[29]和我国学者的研究[30]中,与安慰剂组相比,依达拉奉疗效并不明显;但在对受试者入组标准进行限定的Ⅲ期试验中发现,其在疾病早期、症状较轻时具有较好的改善肌力和延缓疾病进展的作用[31]。
1.3 抗线粒体损伤
线粒体是活性氧和活性氮的主要来源,两者的产生随年龄、环境、遗传等风险因素增加而增加;同时线粒体也是氧化应激损伤的主要靶点之一。线粒体形态学和动力学的改变会导致能量产生缺陷、钙稳态维持失败和凋亡通路激活,这也是ALS常见的标志性病理表现。SOD1小鼠症状出现前就已经发生线粒体形态异常[32],导致线粒体损伤的原因复杂,基因突变所致相应蛋白错误折叠而聚积是其中之一,如突变的SOD1会与线粒体电压依赖性阴离子通道蛋白1作用从而影响线粒体内外物质交换[33]。ALS患者的脊髓[34]和肌肉中[35]都存在线粒体DNA含量减少和呼吸链功能减弱等受损现象。
GNX-4728能抑制渗透性转运孔开放,可保护神经元、减轻脊髓炎症以及维持神经肌肉接头完整性[36]。三环类抗抑郁药去甲替林(nortriptyline)能有效抑制线粒体通透性的改变,并且显著延迟SOD1小鼠发病,并延长生存期、保护脊髓前角细胞、抑制细胞色素c的释放以及胱天蛋白酶3等凋亡通路的激活[37]。单胺氧化酶抑制剂雷沙吉兰(rasagiline),现用于治疗帕金森病,能通过调节渗透性转运孔和维持线粒体存活而发挥神经保护作用[38],目前正在进行Ⅱ期临床试验。值得提出的是,我国自主研发的Ⅰ类化学药物消旋丁苯酞(dl-butyphthalide)于2018年3月获得美国FDA的孤儿药资格认定。临床前实验显示,消旋丁苯酞能稳定线粒体膜电位[39],减少细胞色素c的释放,抑制自由基的生成,减少胶质细胞活化[40],减少运动神经元死亡,延长SOD1-G93A小鼠的生存期[41]。目前正在国内进行Ⅱ期和Ⅲ期多中心的随机双盲对照试验(ChiCTR-IPR-15007365)。
1.4 清除突变SOD1
约20%fALS患者和3%sALS患者为SOD1突变体携带者,至今已发现SOD1突变体超过166种[42]。关于SOD1毒性作用有2种观点。一种认为,突变的SOD1会发生错误折叠而寡聚化,最终形成不溶性高分子沉淀,影响细胞生理功能;另一种认为,突变的SOD1会催化胞内生存相关蛋白与过氧化氢或过氧化硝酸盐反应,从而导致细胞死亡[43]。针对SOD1突变体药物研发的思路通常为抑制突变体合成和清除已生成的突变蛋白。
腺相关病毒 9(adeno-associated virus 9,AAV9)是新型基因治疗载体,系统给药时可以透过血脑屏障并有效靶向神经元和星形胶质细胞[44],利用此技术的AAV9-SOD1短发夹RNA(shRNA)在ALS动物模型上能延迟发病时间并减缓病程发展[45],且结果得到了重复[46]。除了沉默SOD1基因,研究者还尝试通过反义寡核苷酸从m RNA水平降低突变体的表达,SOD1反义寡核苷酸ISIS-333611应用该技术能延长SOD1小鼠寿命,Ⅰ期临床试验证实鞘内注射具有良好的安全性[47]。
热休克蛋白(heat shock protein,HSP)是一种内源性细胞保护蛋白,当运动神经元中HSP水平足够高时,它能使异常折叠的蛋白如突变SOD1维持可溶性状态,从而减少多聚体沉积而改善轴突运输。但是运动神经元本身并不能在应激状态下有效激活HSP,而是通过摄取周围胶质细胞合成和释放的HSP来进行自我修复[48]。阿莫氯醇(arimoclocol)能直接诱导神经元、肌肉细胞和胶质细胞中HSP70/90的表达[49],加速突变SOD1毒性的清除,维持神经对肌肉的支配。动物实验表明,阿莫氯醇能延迟发病,改善神经肌肉功能,提高运动神经元存活率,并且疗效与开始治疗的时间无关[50]。阿莫氯醇安全性高[51],是具有潜力的治疗神经退行性疾病的新型药物。在清除突变蛋白上,抗人突变SOD1单抗AP-101也在开发之中。
1.5 神经营养
神经系统中多种营养因子能促进神经再生而发挥神经保护作用。实验发现,给予特定的神经营养因子能延缓ALS动物模型发病和进展。
胰岛素样生长因子1(insulin-like grow th factor-1,IGF-1)对细胞生长、存活、凋亡和分化均具有重要作用,它通过作用于IGF-1受体减少运动神经元的死亡,并且促进轴突出芽、解除损伤后神经纤维的再生抑制[52]。给ALS模型动物肌注表达IGF-1的AAV能明显延缓病程并延长寿命[53],但临床Ⅲ期试验未能达到评价终点[54],可能是因为药物不能到达靶细胞,达不到有效浓度。
胶质细胞源神经营养因子(glial-derived neurotrophic factors,GDNF)是由星形胶质细胞分泌的具有神经保护作用的内源性物质,不仅对中枢发育和正常生理活动具有重要影响,也能维持轴突切断术后的运动神经元长期存活[55]。肌注的AAVGDNF能从肌肉逆行转运到神经元轴索,这样能同时保护运动神经元及其支配的肌肉,延长SOD1小鼠的生存期[56]。ALS患者脑脊液中血管内皮生长因子水平降低[57],这可能是运动神经元退化的重要原因之一,AAV-血管内皮细胞生长因子能显著改善模型动物运动能力并延长其生存期[58]。
活性依赖性神经营养因子(activity-dependent neurotrophic factors,ADNF)是大脑发育的重要营养因子,存在于胞核、胞浆和微管中。在体实验发现,重组ADNP能抵抗氧化应激[59]。NAP(NAPVSIPQ)是其活性片段,可以通过与微管作用来调节胞内钙含量、激活丝裂原活化蛋白激酶/细胞外信号调节激酶(MAPK/ERK)和磷脂酰肌醇-3-激酶/丝苏氨酸蛋白激酶(PI3K/Akt)通路来促进神经元的生长和分化[60]。尽管多个应用神经营养因子治疗ALS的临床试验都宣告失败[54,61-62],但新的治疗技术,如干细胞技术的出现将为这个问题提供解决方案。
1.6 其他新靶点
ALS药物研发靶点除涉及上述机制以外,近年来还出现了许多新靶点,针对这些靶点开发出了许多有潜力的先导化合物。
马赛替尼(masitinib)是一个具有高度选择性的酪氨酸激酶抑制剂,在动物模型上证实,其具有抗中枢炎症的作用,并能抑制小胶质细胞活化和异常胶质细胞增殖,抑制中枢肥大细胞的迁移、脱颗粒以及产生细胞因子[63]。马赛替尼相比于其他酪氨酸激酶毒性更低,临床前研究证实其无心脏毒性和生殖毒性[64],现作为利鲁唑辅助用药进行Ⅲ期试验。
ALS中大量运动神经元选择性死亡,对肌肉的神经输入减少,胞内钙释放下降,肌纤维收缩力降低,导致肌肉无力。替拉司替(tirasem tiv)能选择性增强快反应骨骼肌的肌钙蛋白对Ca2+的敏感性,并减缓Ca2+从快速骨骼肌的调节肌钙蛋白复合物中的释放速率[65],改善神经输入减少的肌肉组织的收缩力,从而具有潜在的缓解肌疲劳的作用。替拉司替能显著增强模型动物四肢握力、运动和平衡能力,提高膈膜力和潮气量[66]。同时,替拉司替能剂量依赖性地改善患者肺功能和肌力[67-69],与利鲁唑联用能一定程度提高利鲁唑的血药浓度[70]。
Sigma 1受体是位于内质网和线粒体界面上的内质网驻留蛋白,可能通过调节K+通道和肌醇三磷酸(inositol triphosphate,IP3)介导的 Ca2+信号通路,从而调节浆膜兴奋性、G蛋白偶联受体和内质网应激[71]。在中枢神经系统中,脑干和脊髓运动神经元的Sigma 1受体表达水平最高,这些细胞一旦被应激,其中的Sigma 1受体功能也会出现异常[72]。在青少年发病的ALS患者中发现存在Sigma 1受体的突变[73],提示这可能是ALS的一个新的药物靶点。库他美新(cutamesine)是选择性Sigma 1受体激动剂,体内外实验证实其对运动神经元有保护作用,并且延长模型动物的存活时间[74]。在用于急性缺血性脑卒中治疗的一项Ⅱ期试验表明,该药促进了运动能力的恢复[75],在ALS治疗研究中目前处于临床Ⅰ期。
TAR DNA结合蛋白(TAR DNA binding protein 43,TDP-43)是由TARDBP基因编码的多功能DNA和RNA结合蛋白,参与RNA转录、RNA剪切和m RNA稳定性调节等多个胞内过程[76]。正常情况下,TDP-43表达在核内;病理状态下,TDP-43被剪切产生C端片段,形成高度磷酸化、泛素化的包涵体沉积在运动神经元核周[77],导致轴索运输异常和RNA转录修饰异常等。近年研究还发现,TDP-43突变会使M1运动皮质Ⅴ层颗粒细胞产生兴奋性毒性[78]。NeuralGene公司开发了PRCN-829基因疗法[79],通过AAV靶向大脑和脊髓导入补体活性调节因子H、神经生长因子和正常TDP-43基因以发挥ALS治疗作用。TDP-43突变和泛素化聚集是SALS和大多数fALS患者的主要病理特征,其作为药物开发的新靶点具有良好的开发前景。
C9ORF72是另一个研究较热的ALS致病基因,该基因中非编码GGGGCC六核苷酸的大量扩增与ALS密切相关[80-81]。目前C9ORF72的生理功能尚不清楚,关于其突变的致病机制存在以下观点:①大量的六核苷酸重复序列阻碍该基因的转录和表达;②突变基因无法被清除而聚集在核内;③该重复序列可能以重复相关非ATG依赖的方式翻译成有毒蛋白[82]。美国基因治疗公司Ionis针对C9ORF72的重复序列开发出新型反义寡核苷酸IONIS-C9Rx,它能通过RNA干扰高效沉默目标序列的表达[83],目前尚处于临床前研究阶段。Kramer等[84]则从重复序列靶向转录因子SUPT4H1出发,寻找其抑制剂,从而阻止重复序列的转录。C9ORF72是迄今在ALS患者中所占比例最高的致病基因,对其生理和病理功能的研究仍在继续,以此为靶点的药物开发也在快速增加。
2 ALS治疗药物研发问题分析
图1总结了本文涉及的具有治疗潜力的药物和靶点。随着ALS病理机制研究的深入,针对不同靶点的药物也日益丰富,回顾ALS治疗的研究历程,虽然许多治疗方法在临床前实验中都有显著疗效,但在临床试验中均未能起效,分析原因大致有以下3点。
2.1 ALS动物模型和ALS患者病理机制不尽相同
目前,用于ALS治疗药物临床前研究的动物模型有SOD1-G93A/A4V/G37R等SOD1突变小鼠、TDP-43敲除小鼠、TDP-43-M 334V/Q331突变小鼠、FUS/TLS-R521C突变小鼠以及Kwobbler小鼠等。其中常用的是过表达人源SOD1-G93A的小鼠,因其表型与患者临床症状相似而被广泛运用。但也有许多研究发现,其在组织水平、细胞水平或分子水平的多种病理变化并不一致。而且ALS是异质性较大的疾病,其发病部位和疾病进展不尽相同,不同的临床表型与生存期密切相关,至少在致病基因上患者间携带几率不同,SOD1突变约占已知fALS的20%,而fALS患者约占全部患者的10%。而且不同地区患者的主要突变基因不同,如欧洲人群常见C9ORF72重复扩增,而亚洲人群中最常见SOD1突变[85],此模型从基因水平的代表性上就有所欠缺。
2.2 临床试验选择的观察终点和临床前研究不同
动物实验中对药物或其他治疗手段的疗效评价通常选用体质量、生存期、四肢的运动能力和脊髓前角细胞数量等,有的还加入了肌电生理指标(如运动单位计数)和受试药物所对应的生化指标。而临床试验除了以生存期为主要终点,还采用ALS功能评分修正量表(ALS functional rating scale revised,ALSFRS-R)评分和肺活量,有的还引入握力、捏力、通气量以及其他生化指标。而用于检测患者病情发展的ALSFRS-R评分中一些指标如语言能力、书写能力和吞咽等在动物上无法观察。这些因素导致动物实验结果和临床试验结果不一致。
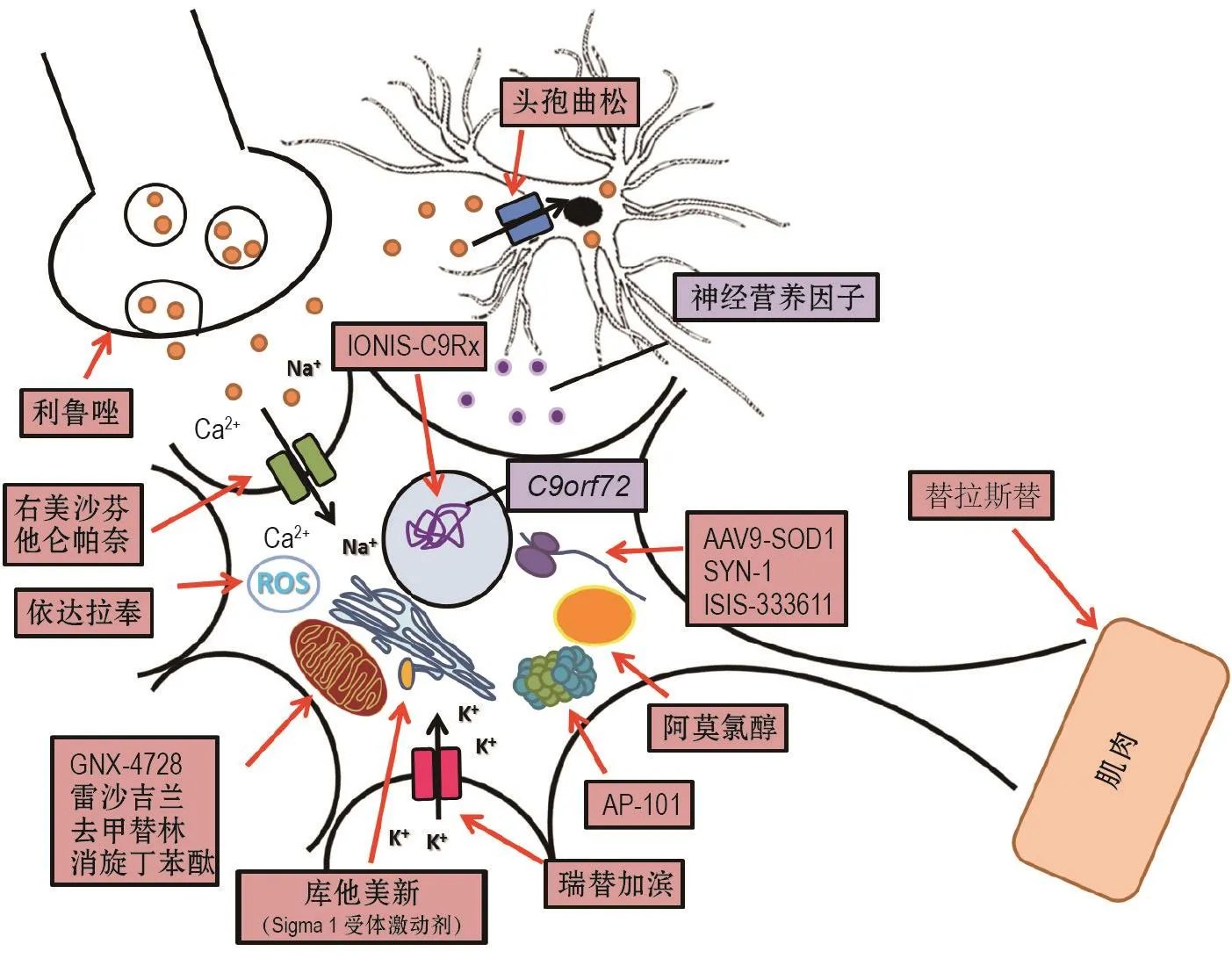
图1 肌萎缩侧索硬化症治疗靶点及药物.ROS:活性氧簇;HSP:热休克蛋白;AAV9-SOD1:携带SOD1基因的腺相关病毒9.IONISC9Rx:C9ORF72反义寡核苷酸;ISIS-333611:SOD1反义寡核苷酸;AP-101:突变SOD1单抗.
2.3 缺乏ALS早期诊断的生物标志物
不管临床治疗还是新药临床试验的启动,接受治疗的患者都已表现出明显的症状,此时已有一半以上运动神经元死亡。因此,寻找敏感而特异性的生物标志物并同时增加临床医师的辨识经验对ALS的早期诊断具有重要意义。
3 总结与展望
ALS患病率和发病率低,异质性大,病理机制不明,且发病隐匿,进展迅速,开发ALS治疗药物成为神经系统药物研发中一大难点。近年基因技术和干细胞技术的迅速发展推动了ALS病因病理的研究进展,为药物研发提供了更多新的潜在靶点。另外,国家加大对孤儿药的支持力度,加速对孤儿药的审批,从基础研究、技术手段和方针政策等方面来看,ALS药物开发处于空前活跃的状态。今后ALS药物研发应该更注重从病理机制出发,建立更有临床代表性的动物模型,结合特异性生物标志物,科学合理设计临床试验,从而开发出预防、缓解甚至逆转病情的药物,为ALS患者带来福音。

