miR-194对人脑胶质瘤U87细胞恶性生物学行为的影响
滕浩,薛一雪,王萍,刘云会
(中国医科大学1.附属盛京医院神经外科,沈阳 110004,2.基础医学院神经生物学教研室,沈阳 110122)
胶质瘤是颅内最常见的肿瘤,按病理分级可分为Ⅰ~Ⅳ 4个级别。Ⅳ级胶质瘤又称胶质母细胞瘤(glioblastoma,GBM) ,是颅内致死率最高的肿瘤之一,生长呈浸润性,血运丰富,边界不清。目前GBM的主要治疗手段为手术切除,术后同步进行放、化疗。但由于肿瘤高度的侵袭性及增殖能力,预后往往不佳[1],患者平均生存期也仅有14个月[2],5年生存率仅5%[3]。研究GBM相关的分子标志物有可能为GBM的诊断、治疗及预后评估提供新的策略。
微小RNA (microRNA,miRNA) 通过与靶基因的3’端非编码区域相结合,能够在转录后水平调节基因的表达。研究显示,miR-194在喉癌[4]、肾透明细胞癌[5]、胃癌[6]、非小细胞肺癌[7]等多种恶性肿瘤中异常表达,但在胶质瘤中的作用尚未见报道。本研究旨在探讨miR-194在不同级别的胶质瘤组织中的表达情况,以及对U87细胞增殖、迁移和侵袭影响,以期为胶质瘤的诊断及治疗提供新的靶点。
1 材料与方法
1.1 胶质瘤组织
23例人脑胶质瘤组织均取于中国医科大学附属盛京医院神经外科,Ⅰ~Ⅱ级7例,Ⅲ~Ⅳ级16例,用于阴性对照的脑组织共5例,来源于脑出血、外伤组织。所有组织离体后立即放入液氮中保存。取材前所有患者均已签署知情同意书,并经过中国医科大学附属盛京医院伦理委员会批准。
1.2 主要试剂及材料
Trizol试剂 (美国Invitrogen公司);DMEM高糖培养基 (美国Corning公司);胎牛血清 (天津灏洋生物科技有限公司);DMSO (美国Sigma公司);转染试剂Lipofectamine3000和Opti-MEM®Ⅰ (美国Invitrogen 公司);TaqMan® MicroRNA Reverse Transcription Kit (美国Ambion公司);TaqMan® Universal Master Mix II (美国Ambion公司);miR-194激动剂miR-194 agomir、拮抗剂miR-194 antagomir (苏州吉玛公司);CCK-8 Kit(上海东仁化学科技公司);基质胶Matrigel (美国BD Biosciences 公司);吉姆萨染液 (北京雷根生物公司);细胞凋亡试剂盒 (上海东仁化学科技公司) 。
1.3 方法
1.3.1 组织总RNA提取与实时荧光定量PCR:胶质瘤组织4 ℃预冷的PBS清洗后加入1 mL Trizol试剂,吹打数次后移入1.5 mL EP管中,静置5 min后加入0.2 mL氯仿,手动剧烈震荡,室温下静置3 min。将样品放入4 ℃ 离心机中,12 000 g离心15 min,取上层水相至新的EP管中,向样品中加入0.5 mL异丙醇,上下颠倒混匀,室温下静置10 min。4 ℃ 12 000 g离心15 min,弃上清,向样品中加入1 mL 75%乙醇。4 ℃ 7 500 g离心5 min,细胞间干燥10~15 min后加入30~40 µL DEPC水。获取的RNA应用TaqMan® MicroRNA Reverse Transcription Kit及TaqMan® Universal Master MixⅡ 试剂盒及7500 Fast Real time PCR系统进行实时荧光定量PCR。以U6为内参,以2-ΔΔCt表示mRNA的相对表达量。
1.3.2 U87细胞培养:U87细胞置于含有10%胎牛血清的DMEM高塘培养液中,于37 ℃、5%CO2的恒温培养箱中培养。每2~3 d传代1次,传代次日更换培养液。取对数生长期、生长状态良好的细胞进行后续实验。
1.3.3 miR-194瞬时转染与分组:使用转染试剂Lipofectamine3000和Opti-MEM®I 将miR-194 激动剂、拮抗剂及阴性对照转染至U87细胞中,并检测转染效率。实验分为5组:空白对照组 (Control) 、转染miR-194 agomir阴性对照组 (pre-NC) 、转染miR-194 agomir实验组 (pre-miR-194) 、转染miR-194 antagomir阴性对照组 (anti-NC) 和转染miR-194 antagomir实验组(anti-miR-194) 。
1.3.4 CCK-8实验检测细胞增殖能力:U87细胞铺于96孔培养板中,每孔大约2 000个细胞,每组细胞铺5个副孔。在37 ℃细胞孵箱中分别培养48 h,加入Cell Counting Kit-8 10 µL后放入37 ℃恒温培养箱中1 h。将96孔板放入酶标仪,选取波长450 nm,测定每孔的光密度(OD)值。
1.3.5 细胞迁移实验:向24孔板内每孔加入600 µL含有10%血清的DMEM高糖培养液,孔内放置孔径为8 µm的Transwell小室。待处理细胞用PBS清洗2次,消化。弃去消化液后加入适量无血清培养液,并吹打成单细胞悬液。细胞计数后取100 µL细胞悬液 (约含10 000个细胞) 均匀地铺在Transwell上室内,放入37 ℃恒温培养箱中培养24 h。24 h后取出小室,用棉棒将上室内面没有迁移过去的细胞擦净,放入提前配制的固定液中 (甲醇∶冰乙酸 = 3∶1) 固定30 min。用PBS清洗小室后晾干。配制吉姆萨染液(染液∶工作液=1∶9)。将小室倒置,吉姆萨染液滴于小室底面染色1 h。用PBS清洗2次,在倒置显微镜(400×) 下观察细胞的迁移情况,每组随机5个视野,统计细胞个数,以此代表细胞的迁移能力。
1.3.6 细胞侵袭实验:Matrigel基质胶提前融化。取50 µL基质胶(500 ng/µL)均匀地铺在小室内面,放入37 ℃恒温箱中4 h,使基质胶凝固。后续实验方法及统计方法同迁移实验。
1.3.7 细胞凋亡实验:应用不含EDTA的胰蛋白酶消化细胞,将细胞轻轻吹打成悬液后转移至1.5 mL离心管中,1 000 r/min离心3 min收集细胞。用PBS继续清洗,1 000 r/min离心3 min,离心后倒掉上清。重复2次。每管加入500 µL Binding Buffer悬浮细胞。每管相继加入5 µL PI和5 µL FITC混匀,室温避光15 min。上机前吹打均匀细胞,流式细胞仪检测细胞凋亡率的变化。
1.4 统计学分析
2 结果
2.1 实时荧光定量PCR检测miR-194在胶质瘤组织
及细胞中表达
与对照组脑组织比较,miR-194在胶质瘤组织中的表达量显著降低,并且表达量随胶质瘤组织级别的升高而减少 (P < 0.05,图1A) 。与正常人脑星型胶质细胞比较,miR-194在人脑U87胶质瘤细胞中表达量也显著减少 (P < 0.01,图1B) 。
2.2 miR-194转染效率的检测
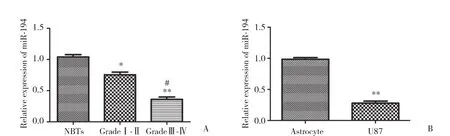
图1 miR-194在胶质瘤组织及U87细胞系中的表达Fig.1 mRNA expression of miR-194 in glioma tissues and glioma U87 cells
与对照组比较,pre-NC组及anti-NC组miR-194的表达水平未见明显变化。与pre-NC组比较,pre-miR-194组miR-194的表达水平显著上调 (P < 0.01) ,与anti-NC组比较,anti-miR-194组miR-194的表达水平显著下降 (P < 0.01,图2A) 。
2.3 miR-194对U87细胞增殖能力的影响
与对照组比较,pre-NC组及anti-NC组细胞增殖能力未见明显变化。与pre-NC组比较,pre-miR-194组细胞增殖能力明显下降 (P < 0.01) ,而与anti-NC组比较,anti-miR-194组细胞增殖能力显著增加 (P <0.01) 。结果表明miR-194能够抑制胶质瘤细胞的增殖能力 (图2B) 。
2.4 miR-194对U87细胞迁移、侵袭能力的影响
与对照组比较,pre-NC组及anti-NC组细胞迁移及侵袭能力未见明显变化。与pre-NC组比较,premiR-194组细胞迁移及侵袭能力明显下降 (P < 0.01) ,而与anti-NC组比较,anti-miR-194组细胞迁移及侵袭能力显著增加 (P < 0.01) 。结果表明miR-194能够抑制U87胶质瘤细胞迁移及侵袭能力 (图2C) 。
2.5 miR-194对U87胶质瘤细胞凋亡的影响
与对照组比较,pre-NC组及anti-NC组细胞凋亡情况未见明显变化。与pre-NC组比较,pre-miR-194组细胞凋亡率明显增加 (P < 0.01) ,而与anti-NC组比较,anti-miR-194组细胞凋亡率显著下降 (P < 0.01) 。结果显示miR-194能够促进U87胶质瘤细胞的凋亡(图2D) 。
3 讨论
GBM由于其侵袭性生长的特点手术往往难以完整切除,肿瘤极易残余、复发。术后常规行放、化疗虽能一定程度上延缓疾病的进展,但血脑屏障、血肿瘤屏障的存在限制了治疗效果,患者仍然难以获得满意预后[8]。近来大量研究[9-10]显示,基因的异常表达以及基因间异常调控作用与胶质瘤的形成、发展密切相关。
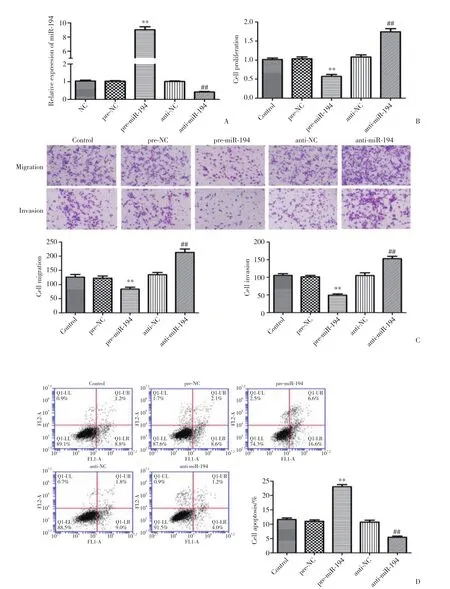
图2 miR-194的转染效率以及对U87细胞增殖、迁移、侵袭和凋亡的影响Fig.2 Transfection efficiency of miR-194 and the effect of miR-194 on the proliferation,migration,invasion,and apoptosis of U87 cells
miRNA是一类长度18~25个核苷酸的非编码RNA,具有高度保守性,不具备开放阅读框架,通过与靶基因的3’UTR区域相结合,在转录后水平抑制或降解靶基因表达,从而抑制蛋白合成。miRNA在胚胎形成、细胞分化、细胞凋亡、细胞死亡、肿瘤的形成等诸多方面发挥着多元化的调控作用。miR-194是miRNA的成员之一,在大部分肿瘤的生长、分化、迁移、侵袭及凋亡过程中起抑癌作用。在骨肉瘤中,离体及在体实验[11]均证明miR-194能够通过靶向作用于CDH2和IGF1R来抑制细胞的增殖及转移。在结肠癌中,miR-194能够通过调控MAP4K4/c-Jun/MDM2信号途径抑制细胞的增殖能力[12]。在膀胱癌中,miR-194通过抑制RAP2B的表达进而抑制膀胱癌细胞的增殖与侵袭能力[13]。然而,也有报道miR-194在前列腺癌、卵巢癌、胰腺导管腺癌中分别通过作用于SOCS2[14]、PTPN12[15]以及DACH1[16]来促进肿瘤细胞的转移、增殖、克隆形成、迁移及侵袭作用。这可能是基因在不同组织中的差异性作用所致。
本研究应用实时荧光定量PCR分析,证实了miR-194在胶质瘤组织中表达量明显低于对照脑组织,且表达量随胶质瘤级别升高而降低。将miR-194转染至U87细胞后,应用CCK-8法检测细胞增殖能力,结果显示过表达miR-194后U87细胞增殖能力显著下降,而沉默miR-194后细胞增殖能力显著增加。迁移、侵袭实验显示,miR-194过表达后细胞的迁移、侵袭能力显著下降,沉默miR-194后细胞的迁移、侵袭能力明显增加。凋亡实验显示,过表达miR-194后细胞的凋亡率显著增加,而沉默miR-194后细胞凋亡率显著减少。上述研究结果表明miR-194在胶质瘤U87细胞中发挥抑癌的作用,可以作为胶质瘤治疗的靶点之一。
然而,胶质瘤发生与发展机制极其复杂,miR-194是通过何种机制、哪些靶基因发挥的抑癌作用有待于今后进一步研究。

