原发性前列腺大细胞神经内分泌癌的临床病理特征和诊治分析
李曾 廖洪 毛顿 谭政 吴毅 肖英明 杨盛柯 钟磊 陈勇吉
原发性前列腺大细胞神经内分泌癌(large cell neuroendocrine carcinoma, LCNEC)是一种十分罕见的前列腺恶性肿瘤,恶性程度高,进展迅速,易早期转移,预后极差,其生物学特点及诊疗不同于普通前列腺腺癌,国内外报道少,且无大宗研究对其进行总结。我院近期收治原发性前列腺LCNEC患者1例,采用CAB(抗雄激素+药物去势)联合化疗治疗,病情缓解,目前处于治疗随访中,我们结合国外文献报道的14例资料,对其临床病理特征和治疗预后等进行回顾性分析。
对象与方法
一、病例收集
国内文献使用“中国知网”、“万方医学网”、“维普期刊全文数据库”等进行系统检索,关键词为“前列腺癌”和“大细胞神经内分泌癌”;国外文献使用“PubMed”、“医知网”、“OVID”、“EBSCO”等数据库进行系统检索,关键词为“Prostate cancer”和“Large cell neuroendocrine carcinoma”,针对篇名和摘要进行筛选,时限从1997年至2017年。检索到国内文献为0篇,国外文献为9篇[1-9],发表时间分布在2000年至2015年。纳入标准:确诊的原发性前列腺LCNEC 报道;排除标准:转移性前列腺LCNEC。初步筛选16例,其中2例因未行免疫组化确诊排除,最终符合条件的有14例,连同我院收治的1例病例总共15例,其中前列腺腺癌伴LCNEC 2例,新发的LCNEC 3例。
二、一般资料
15例中,1例具有前列腺癌家族史(祖父和父亲);发病年龄43~81岁,平均67.2岁;临床症状多以下尿路梗阻、刺激症状或血尿为主,部分伴有骨转移引起的癌痛,1例表现为肠梗阻(腹痛、腹胀),1例合并双肾积水;9例既往有前列腺腺癌病史,其中1例接受根治性前列腺切除术(RP),2例接受过放疗,8例接受过内分泌治疗[手术去势1例,药物治疗7例,其中1例不详、2例单纯使用促黄体生成激素释放激素类似物(LHRHa)、4例使用抗雄药物+LHRHa],内分泌治疗时间从2年~5年不等,平均约2.7年;6例既往无腺癌病史,为新发,单纯性3例,混合性(伴腺癌)3例;PSA方面,除3例未提及外,余12例的PSA从<0.01 ng/ml~170 ng/ml不等(9例<10 ng/ml,3例>10 ng/ml);Gleason评分,除3例单纯性LCNEC不适用和3例未提及外,余9例均在7~10分之间,平均8.5分,属于高危。LCNEC诊断方法:其中经尿道前列腺电切术(TURP)标本诊断8例,前列腺穿刺活检诊断4例,腹腔转移灶和盆腔肿块活检诊断各1例,前列腺根治术后标本诊断1例(表1)。
三、研究方法和数据分析
收集15例前列腺LCENC患者的临床病理资料,包括发病年龄、是否新发、是否合并腺癌、诊断LCENC时PSA的水平、伴有腺癌的Gleason评分、是否有内分泌治疗史及具体内容、诊断方法、病理学检查结果、治疗方案和随访生存情况等,回顾性总结分析其病理特征和治疗预后等。应用SPSS 18.0统计软件进行统计学分析,生存数据分析使用Kaplan-Meier法进行单因素分析。
结 果
一、前列腺LCNEC患者的病理特征
15例中,12例(80.0%)混有腺癌成分(其中3例为新发),3例(20.0%)为单纯性。免疫组化指标:CgA阳性12例(80.0%),其中(++)4例(33.3%)、(+)6例(50.0%)、局灶(+)2例(16.7%);(-)3例(20.0%)。Syn阳性11例(73.3%),其中(++)5例(45.4%)、(+)3例(27.3%)、局灶(+)3例(27.3%);(-)4例(26.7%)。CD56/NCAM,除外未做2例,余13例中阳性10例(76.9%),其中(++)7例(53.8%)、(+)3例(23.1%);(-)3例(23.1%)。PSA,除外未做2例,余13例中(-)8例(61.5%)、(+)2例(15.4%)、局灶(+)3例(23.1%)。PSAP,除外未做4例,余11例中阳性7例(63.6%),其中(++)1例(9.0%)、(+)4例(36.4%)、局灶(+)2例(18.2%);(-)4例(36.4%)。P504S/AMACR,除外未做7例,余8例均为阳性,其中(++)7例(87.5%)、(+)1例(12.5%)(表2)。
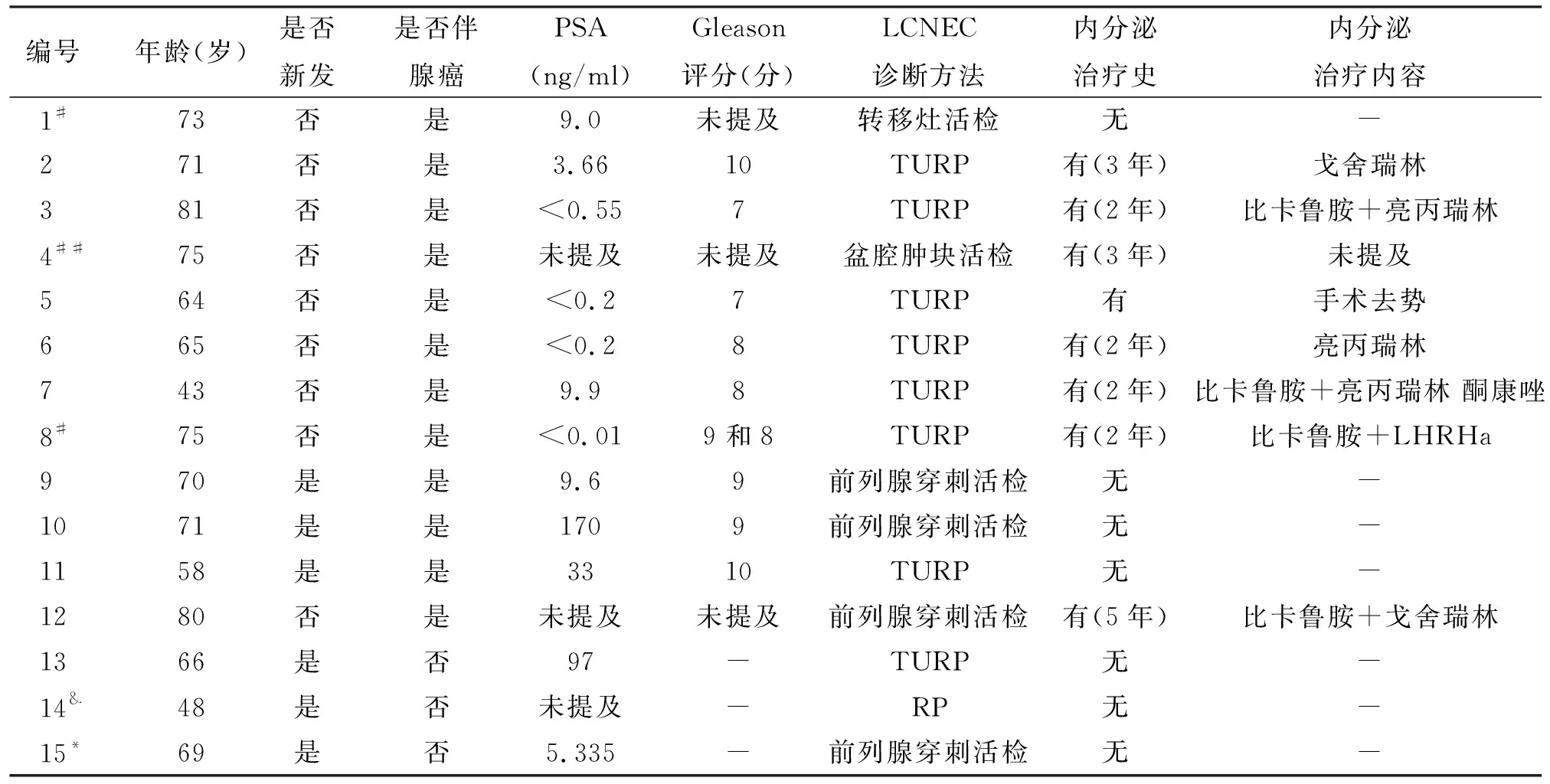
表1 15例前列腺LCNEC患者的一般临床资料
#:放疗史;##:根治手术史;&:家族史;*:我院的病例

表2 15例前列腺LCNEC患者的免疫组化结果
*:我院的病例
二、前列腺LCNEC患者的治疗和转移情况
15例中,姑息对症手术和对症治疗各1例;放疗1例;内分泌治疗3例(其中比卡鲁胺+戈舍瑞林2例,手术去势1例);全身化疗7例(其中米托蒽醌方案1例,卡铂+VP-16方案3例,顺铂+VP-16方案2例,卡铂+VP-16+米托蒽醌方案1例);化疗(顺铂+VP-16方案)联合内分泌治疗1例(我院的病例);化疗(顺铂+VP-16+紫杉醇方案)联合内分泌治疗和RP 1例。15例患者诊断前列腺LCNEC 时均有转移,转移部位主要集中在骨,腹、盆腔淋巴结,肝脏,肺,脑等(表3)。

表3 15例前列腺LCNEC患者的治疗和转移情况
*:我院的病例;RLRP:机器人辅助腹腔镜根治性前列腺切除术;PLND:盆腔淋巴结清扫术
三、前列腺LCNEC患者的生存情况
我院的病例仍在随访中,现已存活6个月,另外14例中,1例在随访3个月后失访,2例生存分别超过15和30个月,11例最终均因转移死亡,生存时间从3周到19个月不等。总体预后差,平均生存时间<1年(11.5个月),中位生存时间约8个月(图1)。
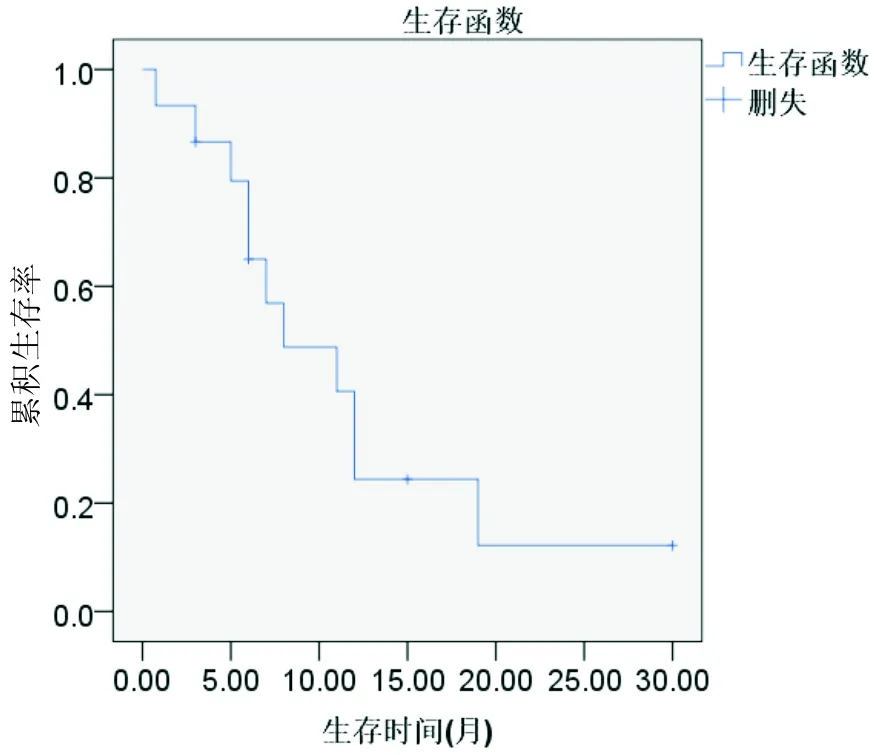
图1 15例患者的总生存情况(Kaplan-Meier分析)
讨 论
神经内分泌肿瘤(neuroendocrine tumors, NETs)是指起源于不同器官神经内分泌细胞的一种罕见恶性肿瘤,能够合成和分泌胺及多胺激素,可发生于全身任何器官,最常见于胃肠道(74%)和肺(10%),发生于泌尿生殖系的少见[10]。根据病理特点和转归,通常分为分化好的类癌、不典型类癌以及分化差的神经内分泌癌(neuroendocrine carcinoma, NEC),后者包括小细胞癌(small cell carcinoma, SCC)和大细胞癌[11]。前列腺的恶性肿瘤95%都是腺癌,NETs发病率低,在0.5%左右,且以类癌和SCC居多,LCNEC罕见,LCNEC还可能同SCC和腺癌同时发生,其可看作是腺癌和SCC之间的一个过渡类型[12]。最新的前列腺癌神经内分泌分化分类包括[13]:①常见的前列腺腺癌与神经内分泌分化;②腺癌与Paneth细胞神经内分泌分化;③类癌肿瘤;④SCC;⑤大细胞癌;⑥混合型(小细胞或大细胞)NEC和腺泡腺癌。大约10%~32.5%的前列腺癌组织中会出现神经内分泌细胞,神经内分泌细胞通常不表达雄激素受体(AR)和PSA,能分泌如CgA、Syn、NSE、CT、5-HT等多种生物活性物质,在细胞生长的多个环节起调控作用,影响肿瘤的生物学行为[14]。神经内分泌细胞数>50%并具有NEC的特定结构,才能诊断为前列腺NEC。
关于前列腺LCNEC的起源和发病机制尚不甚清楚,临床上前列腺LCENC大部分发生在ADT后一段时间或伴有腺癌[1,5],始发即为且单纯者罕见[6-8],可能是ADT导致神经内分泌细胞数增加,诱导其活性从而导致腺癌ADT后发生NEC。或可能来源于非神经内分泌细胞[15]。目前普遍认为NEC起源于前列腺的多能干细胞,具有多向分化潜能,可分化为腺癌或LCNEC、SCC等类型[16]。研究表明NEC和腺癌可能存在一个共同的克隆起源,前者常常有AR、视网膜母细胞瘤(RB)基因表达的缺失和N-Myc PI3K通路的激活,还可能涉及P53信号途径的失活或克隆转变[17]。LCNEC和SCC比腺癌细胞存在更多的基因变异,LCNEC和SCC中的UBE2C基因表达上调,不表达AR、RB1、CCND1[18]。从腺癌发展为NEC的患者中,有65%存在AURKA和MYCN基因扩增现象,两者共同诱导神经内分泌表型[19]。综合分析,大多数前列腺LCNEC可能来源于小部分非神经内分泌细胞在ADT治疗选择压力下的克隆进展和进化,新发的LCNEC可能是由于局部神经内分泌细胞的直接恶性转变机制[3-4]。本文分析的15例LCNEC中,9例有ADT史或诊断时伴有腺癌(3例),占80.0%,新发的单纯性LCNEC只有3例(20.0%)。
LCNEC的临床表现无特异性,主要有排尿困难、尿频、尿急、血尿等,也可表现为会阴部胀痛不适、肛门坠胀等非特异性症状,少部分出现副瘤综合征,如Cushing综合征、ADH(抗利尿激素)增多综合征、高血钙等。诊断时多为晚期,可浸润和压迫膀胱、直肠等,容易转移至肝脏、肺、骨及腹、盆腔淋巴结等远处器官,甚至首先因转移灶症状(如肠梗阻[1])就诊。CT表现无特异性,通常表现为低密度,与正常的前列腺组织难以区分,可出现坏死、囊变,表现为密度不均匀,肿瘤血供丰富,增强后多出现明显强化[6]。和腺癌不同,单纯性LCNEC血清PSA并不增高,混有腺癌时才有可能升高,因此PSA不能作为其肿瘤标志物,但对于区分是否含有腺癌有一定意义。研究显示CEA的升高和降低与疾病的进展和缓解相关[9]。本文有PSA统计的12例病例中,75.0%(9/12)的PSA<10 ng/ml,只有25.0%(3/12)>10 ng/ml,诊断时均有转移,集中在骨、淋巴结、肝脏、肺等部位,我院的病例即PSA无明显升高,但CEA明显升高。
LCNEC确诊主要依靠病理结果,电镜和免疫组化检查有重要价值,Gleason评分不适用于其诊断。免疫组化特异性的神经内分泌标志物主要有CgA、Syn、NSE和CD56等,NSE的敏感性虽高,但特异性低;70%~90%的NEC可出现CgA阳性,敏感性为96%,特异性为92%,与肿瘤转移有关;Syn的敏感性为100%;CD56虽然特异性低,但敏感性高[20]。此外,P504S在前列腺LCNEC和SCC中均可表达,有一定的器官特异性,可用于鉴别原发或转移癌[21],而PSA、PSAP多为阴性。但有些分化较差的肿瘤上述指标可能部分为阴性,而部分神经内分泌标志物又可表达于腺癌细胞,因此,病理诊断必须结合细胞形态学和免疫组化。参考肺LCNEC诊断的相关文献,诊断原发性前列腺LCNEC应同时具备以下标准[3,6-8,13]:①形态学上:细胞大,多角形;核染色质粗,有淡染至嗜酸的胞质,核仁明显,低核质比,细胞内可见巢状、小梁状、栅栏样结构;有丝分裂活跃(>10/10 HPFs);细胞大面积坏死。②神经内分泌免疫指标:除了NSE,CgA、Syn和CD56至少一个阳性。鉴别诊断上,LCNEC和SCC免疫组化特点较相似,区别在于细胞形态结构的特点。同时要与肺、消化道等转移性LCNEC鉴别,TTF-1对于鉴别是否为肺转移来源有重要意义,还需与高级别前列腺腺癌、膀胱癌侵犯、弥漫性大B细胞淋巴瘤等鉴别,结合病史、影像学和病理等可以区分。本文分析的15例中,CgA阳性率为80.0%(12/15),Syn阳性率为73.3%(11/15),CD56阳性率为76.9%(10/13),而PSA阴性率为61.5%(8/13),不过PSAP阳性率较高,为63.6%(7/11),考虑与混有腺癌成分有关,但有1例单纯性LCNEC却强表达PSAP。
由于发病率低,治疗上尚无统一规范方案,总结文献和参照肺LCNEC的治疗经验,可采用手术配合化疗的综合疗法,早期可考虑行RP,即使有局部浸润,但由于大多数确诊时已属晚期,失去手术机会。LCNEC同SCC一样,化疗一般采用以铂类为基础的方案,最经典的是EP(VP-16+顺铂)方案,对SCC的有效率为61%[17],其他如吉西他滨、多西他赛、阿霉素和铂类的组合也获得一些效果,大约10%~50%的患者CgA或NSE等水平会降低[22]。早期治疗失败可能与LCNEC细胞增殖高表达,微血管密度增加,从而促进肿瘤血管生成有关[14]。Okoye等[6]对1例新发单纯性前列腺LCNEC伴盆腔淋巴结转移患者,采用顺铂+VP-16+紫杉醇方案行8个周期新辅助化疗和药物去势治疗后再行RP及PLND,患者术后13个月出现脑转移死亡。由于神经内分泌细胞不表达AR,因此内分泌治疗对于单纯性LCNEC无效,对于混有腺癌成分的可能有一定效果,有学者[5]对2例混有腺癌的转移性LCNEC单纯采用比卡鲁胺和戈舍瑞林治疗,取得较理想结果,患者已存活分别超过15和30个月,但仅是个案报道,尚需进一步总结。包括LCNEC在内的NEC对放疗不敏感,但对于控制患者局部转移症状有效。研究发现Aurora激酶抑制剂在体外和体内均对前列腺NEC敏感,可以完全抑制神经内分泌标志物的表达[23]。对前列腺LCENC采用综合疗法,包括干细胞分化阶段调节因子(SCDSFs)、免疫疗法、消融疗法、内分泌治疗,放疗、化疗,体外疫苗和靶向治疗(如生长抑素类似物)等,或许能改善患者生存[24]。
前列腺LCNEC具有侵袭性、致死性高的特点,预后不受非大细胞成分含量的影响,其他如高龄、LDH及白蛋白水平等也可能同预后有关。多学科综合疗法虽有前途,但未能增加存活率[24]。据最新统计,尽管治疗手段的进步,包括LCNEC和SCC在内的前列腺NEC预后仍差,总死亡率仍高,没有发生变化[25]。复习文献,即使采用包括手术在内的多种疗法,通常生存期不超过1年[6],5年生存率<1%[3],本文统计的平均生存时间为11.5个月。
综上,原发性前列腺LCNEC临床十分罕见,确诊依赖于病理形态学和免疫组化检查,其组织学起源、发病机制和病理特征等还有待进一步认识。其恶性程度高,易转移,治疗效果差,临床可借鉴的经验不多,早期手术结合化疗等综合疗法并积极探索新的治疗模式,可望改善患者的预后。

