肠炎沙门菌的温度、pH值和水分活度主参数模型的构建
戚 成,吴雪扬,陈元美,杜建萍,崔 旸,张春艳,王 翔,刘 箐,董庆利,*
(1.上海理工大学医疗器械与食品学院,上海 200093;2.北京市食品安全监控和风险评估中心,北京 100053)
沙门菌属(Salmonella spp.)是在血清学上相关的兼性厌氧革兰氏染色阴性直杆菌。沙门菌大部分具有两端钝圆的形态特征,广泛存在于自然界中[1],能够在温度7~45 ℃的条件下生长,最适生长温度为35~37 ℃,最适生长pH值为7.2~7.4。沙门菌在外界的生存能力较强,在水中不易繁殖但可以存活2~3 周,其对高温、阳光直接照射以及常用的消毒药品非常敏感,不能耐受较高盐浓度,盐质量分数9%以上就会死亡[2]。在食品加工中,如果食品内部无法达到杀死沙门菌或破坏毒素的温度时,细菌和毒素就会有所残留从而引发污染。唐靓等[3]报道的我国2010—2013年食源性致病菌监测结果显示,沙门菌在肉类中检出率最高为12.55%;其中2006—2012年间上海市生肉中沙门菌检出率高达14.71%。根据1999—2014年我国食物中毒致病因素统计结果显示[4]:微生物性食物中毒占34.61%,其中沙门菌占40%,占细菌性食物中毒事件的首位[5],因此对沙门菌造成的食品污染有待进一步调查和研究[6],从源头上控制沙门菌危害并进行风险评估。
主参数模型(cardinal parameter model,CPM)是一种主要经验二级模型[7],最早由Rosso等[8]提出,通过只定义主要基本环境因子参数(最大值、最小值和最适值)和最适条件时的最大生长率的数值描述微生物生长率和温度的方程,随后又分别于1995年和2001年提出了pH CPM[9]和水分活度CPM[10],近年来模型不断被完善,已经发展成为研究微生物的重要工具[11-13]。CPM作为一种研究致病菌生长状况的工具,其优点在于易于获得参数的初始值,且与Gamma概念相似假定环境因素影响是倍增的。CPM在国外已被应用于大量研究中,Dimakopoulou-Papazoglou等[12]建立了不同pH值和水分活度肠炎沙门菌生物膜形成的CPM,并证明了环境对生物膜形成的影响可通过数学模型定量表达,为食品工业提供了生物膜控制的有用信息。此外Garcia等[14]构建了赭曲霉在不同温度和水分活度下的生长界面主参数模型,并通过CPM预测得到了赭曲霉生长边界从而防止其生长。目前国内对致病菌CPM的研究相对较少,董庆利等[15]构建了铜绿假单胞菌迟滞期关于不同温度、pH值和乳酸钠浓度的CPM,并验证了其能够较好地预测铜绿假单胞菌的生长情况。
为探究肠炎沙门菌在不同环境条件下的生长规律,本研究以液体培养基为基质,建立肠炎沙门菌在不同温度(30~42 ℃)、pH值(6.6~8.0)、水分活度(aw)(0.976~0.997)环境影响下的CPM。此外,通过数学检验值参数以及随机实验验证构建的CPM在预测肠炎沙门菌在缓冲蛋白胨水(buffered peptone water,BPW)中生长的有效性,为实际食品生产、保存和运输中控制肠炎沙门菌的生长提供理论参考依据,以快速有效地对食品微生物的安全性进行评估,同时为准确预测致病菌在食品介质中的生长状态及参数提供了新思路。
1 材料与方法
1.1 菌种、培养基及试剂
肠炎沙门菌(ATCC13076)于(4±0.5)℃冰箱中的大豆酪蛋白琼脂(TSA)培养基上保藏;BPW 青岛海博生物技术有限公司;氯化钠(优级纯)、盐酸、氢氧化钠(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
THZ-103B型恒温培养摇床、LRH-70型生化培养箱上海一恒科学仪器有限公司;移液枪(20~200 μL、1~5 mL) 德国Eppendorf公司;YXQ-LS-75S11型立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;SJ-CJ-1G型单人单面水平送风净化工作台上海尚净仪器有限公司;UV-1600型紫外-可见分光光度计上海美谱达仪器有限公司;PHS-3C型pH计 上海雷磁仪器有限公司。
1.3 方法
1.3.1 不同pH值和aw液体培养基的获得
实验用BPW液体培养基经高压灭菌后,其pH值未发生显著变化[16],因此,培养基pH值的调节利用pH计,通过添加适量0.1 mol/L NaOH或HCl溶液调节到目标数值(表1)。培养基aw与其NaCl含量相对应[12],分别为:0.997(质量分数0.5% NaCl)、0.987(质量分数2.5% NaCl)、0.980(质量分数3.5% NaCl)和0.976(质量分数4.5% NaCl),因此通过添加适量NaCl调节培养基aw,再将调节好的培养基分装于不同锥形瓶中进行高压灭菌,待用。
1.3.2 菌悬液的制备与接种
取保存于4 ℃冰箱中的肠炎沙门菌单菌落无菌操作接种于100 mL的BPW培养基中。于(37±1)℃、120 r/min摇床培养15 h,使菌体浓度达到稳定期(约109CFU/mL),用无菌BPW稀释制成108CFU/mL的菌悬液以备用。根据菌种菌悬液的浓度,取100 μL菌种菌悬液接种到100 mL已根据实验设计(表1)调节好pH值和aw的无菌BPW培养基中,使初始接种量为105CFU/mL。
1.3.3 因素水平设计
本实验中采用的温度、pH值和aw3因素的水平设计如表1所示,共进行33 组实验。其中aw通过调节NaCl在培养基中的浓度达到目标值。
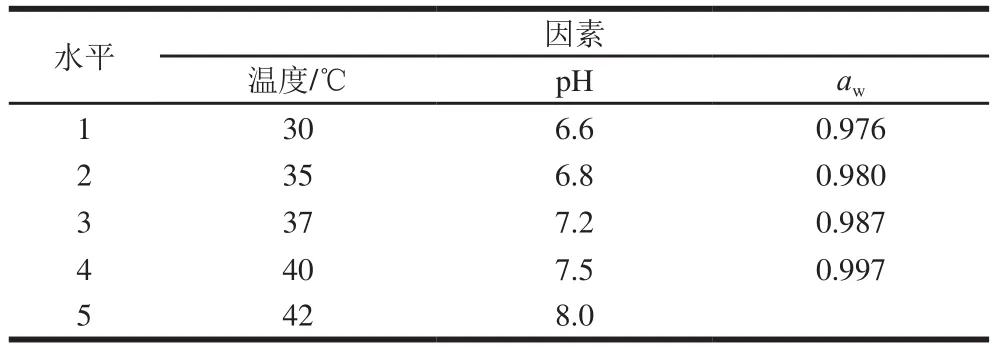
表1 温度、pH值和aw因素水平设计Table1 Levels of temperature, pH and water activity
1.3.4 生长曲线观测
本实验采用比浊法,应用紫外分光光度计测量肠炎沙门菌在波长600 nm的浊度[13],以无菌BPW培养基作为参照。开始培养前先测定每组接种后的培养液的OD值作为初始值,开始培养后,每隔一定时间吸取培养液,测定并记录下OD值。
1.3.5 一级模型的建立
应用DMFit 3.5软件(英国)拟合不同条件下肠炎沙门菌的生长曲线,获得对应的最大比生长率(μmax),选用的Baranyi模型[17]见公式(1)~(3):
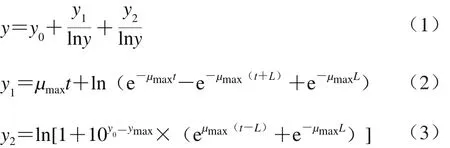
式中:y0为最初培养液OD值;ymax为最终培养液OD值;μmax为最大比生长率/h-1;t为生长时间/h;L为迟滞期/h。
1.3.6 二级模型的建立
一般认为,温度、pH值和aw对致病菌的影响是独立的[18]。基于此,依据Gamma概念,即假设每一个环境条件因子对生长率都有自己独立的影响。通过分别研究温度、pH值和aw的独立影响从而建立肠炎沙门菌的CPM。
1.3.6.1 温度的独立影响
Rosso等[8]所建立的CPM相对于Ratkowsky提出的模型的优点在于其4 个参数都是有明确的生理学意义,并且可以避免由Ratkowsky模型中数学形式所导致的参数间产生结构相关性和增加参数估计的疑难程度等问题[19]。其关于温度模型[5]见公式(4):
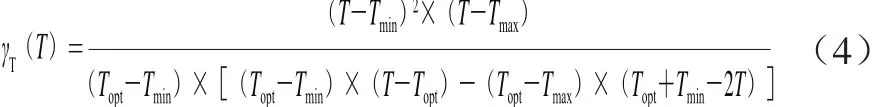
式中:T为不同温度/℃;Tmin和Tmax为预测的最低生长温度和最高生长温度/℃,即微生物没有代谢活动时的温度;Topt为最适生长温度/℃。
已有文献[20-22]报道,沙门菌已经被证明在4 ℃条件下无法生长,且Pin等[23]的研究中也表明肠炎沙门菌在4 ℃时的观测值并没有显示代表性的失活趋势,故取Tmin为4 ℃,以更好地获得更加准确的肠炎沙门菌的生长参数。
1.3.6.2 pH值的独立影响
描述pH值和微生物生长率的关系的基本pH值模型[9]见公式(5):
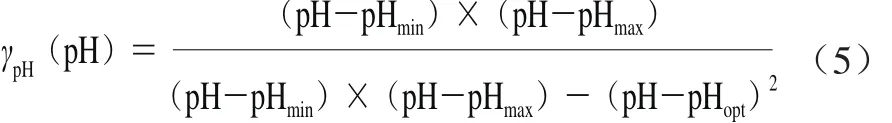
式中:pHmin和pHmax为预测的最小生长pH值和最大生长pH值,即微生物没有代谢活动时的pH值;pHopt为最适生长pH值。
1.3.6.3 aw的独立影响
aw关于微生物生长率影响的模型[10]见公式(6):
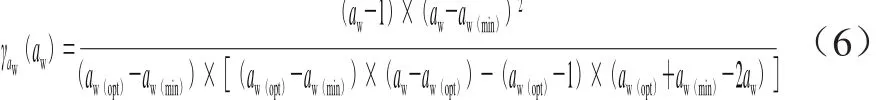
式中:aw为不同水分活度;aw(min)为预测的最小生长水分活度,即微生物没有代谢活动时的水分活度;aw(opt)为最适生长水分活度。由于水分活度无法超越1,也就是纯水,所以为了计算方便,取aw(max)为1,并且已证明了此取值不会影响到其他参数的数值变化[19]。
1.3.6.4 CPM的构建
二级模型是描述环境因子的变化如何影响一级模型中的参数[17]。肠炎沙门菌主参数值的确定,使用Origin 8.0软件(美国OriginLab公司)中的非线性曲线拟合,进行基于最小二乘法迭代计算,使其残差平方和达到最小。本研究采用Zwietering等[18]提出的修正Gamma方程描述3 个环境因子的独立影响见公式(7):
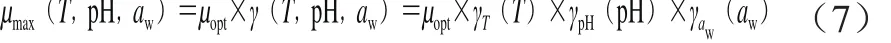
式中:μopt为最适条件下的最大比生长率/h-1。
1.3.7 CPM的可靠性评价
1.3.7.1 模型数学检验
Baranyi模型通过决定系数(determination of coefficient,R2)评价其拟合程度,对所建立的二级模型通过均方误差(mean squared error,MSE)、偏差因子(bias factor,Bf)和准确因子(accuracy factor,Af)进行评价。
MSE是计算拟合数据和原始数据对应点的误差平方和。MSE越接近于0,说明模型拟合的越好,数据预测越精确。表达式见公式(8):

式中:μm为最大比生长率实验观测值/h-1;μp为最大比生长率预测值/h-1;n代表组数。
Af用于评价构建模型的准确程度,Af越大说明模型平均准确性越低,当其值为1时,说明观测值与预测值完全吻合[24]。Bf能够衡量观测值与预测值之间存在的差距大小。当其值小于1时,表明平均预测值大于平均观测值,反之则小于平均观测值[24]。表达式见公式(9)、(10):
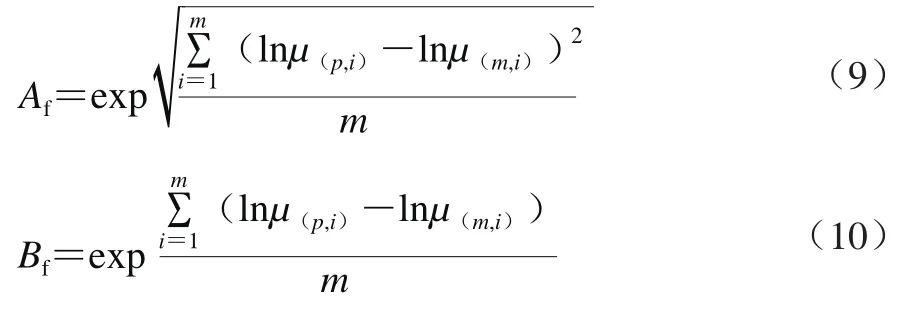
式中:μ(m,i)为最大比生长率观测值/h-1;μ(p,i)为最大比生长率预测值/h-1;m代表组数。
1.3.7.2 模型验证
为了更好的检验构建的CPM的有效性,在设定的实验条件温度(30~42 ℃)、pH(6.6~8.0)、aw(0.976~0.997)范围内,随机选取3 组数据对模型进行拓展检验,相比固有检验,拓展检验能更客观的评价模型的可靠性[25]。
2 结果与分析
2.1 一级生长模型的建立
Baranyi模型拟合的肠炎沙门菌典型生长曲线,如图1所示。
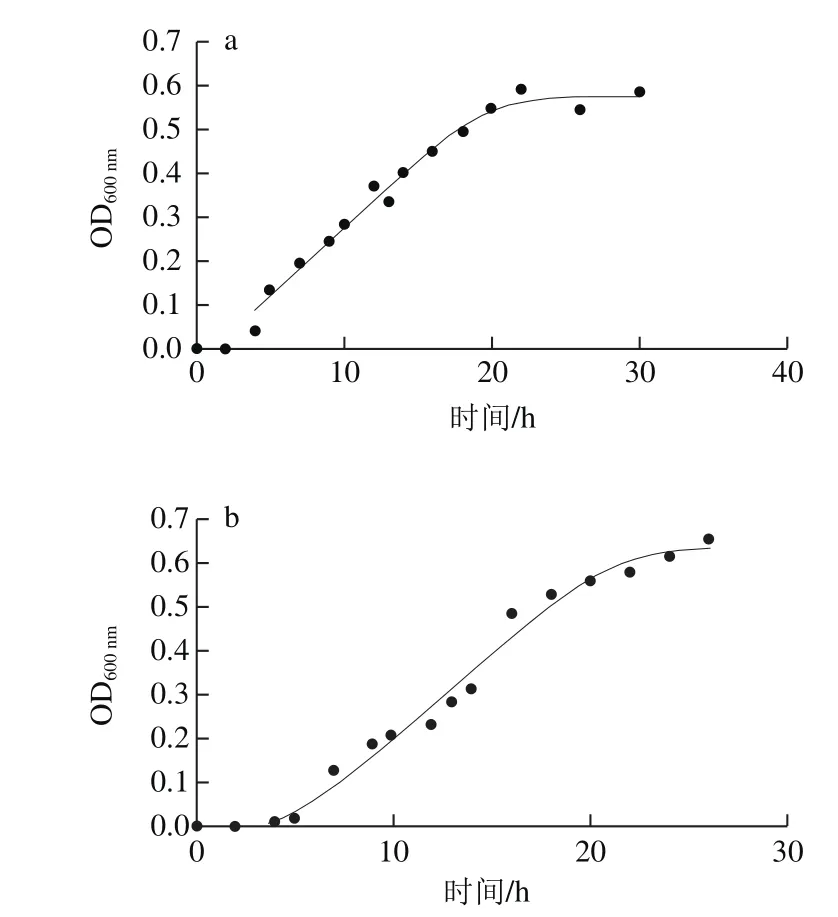
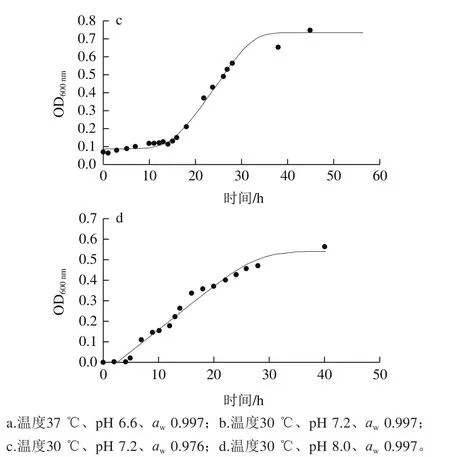
图1 Baranyi模型拟合的不同环境条件下的肠炎沙门菌的典型生长曲线Fig.1 Typical growth curves fi tted to Baranyi model of S. enteritis under different environmental conditions
由图1可看出,拟合的生长曲线均呈现良好的S型,符合微生物的生长趋势,并且在实验范围内,随着温度、pH值、aw越接近最佳生长条件,进入稳定期的时间越短,符合沙门菌的生长规律。
表2 用于拟合主参数模型的Baranyi模型的生长参数与决定系数Table2 Growth parameters and coefcients of determination by Baranyi model for CPM
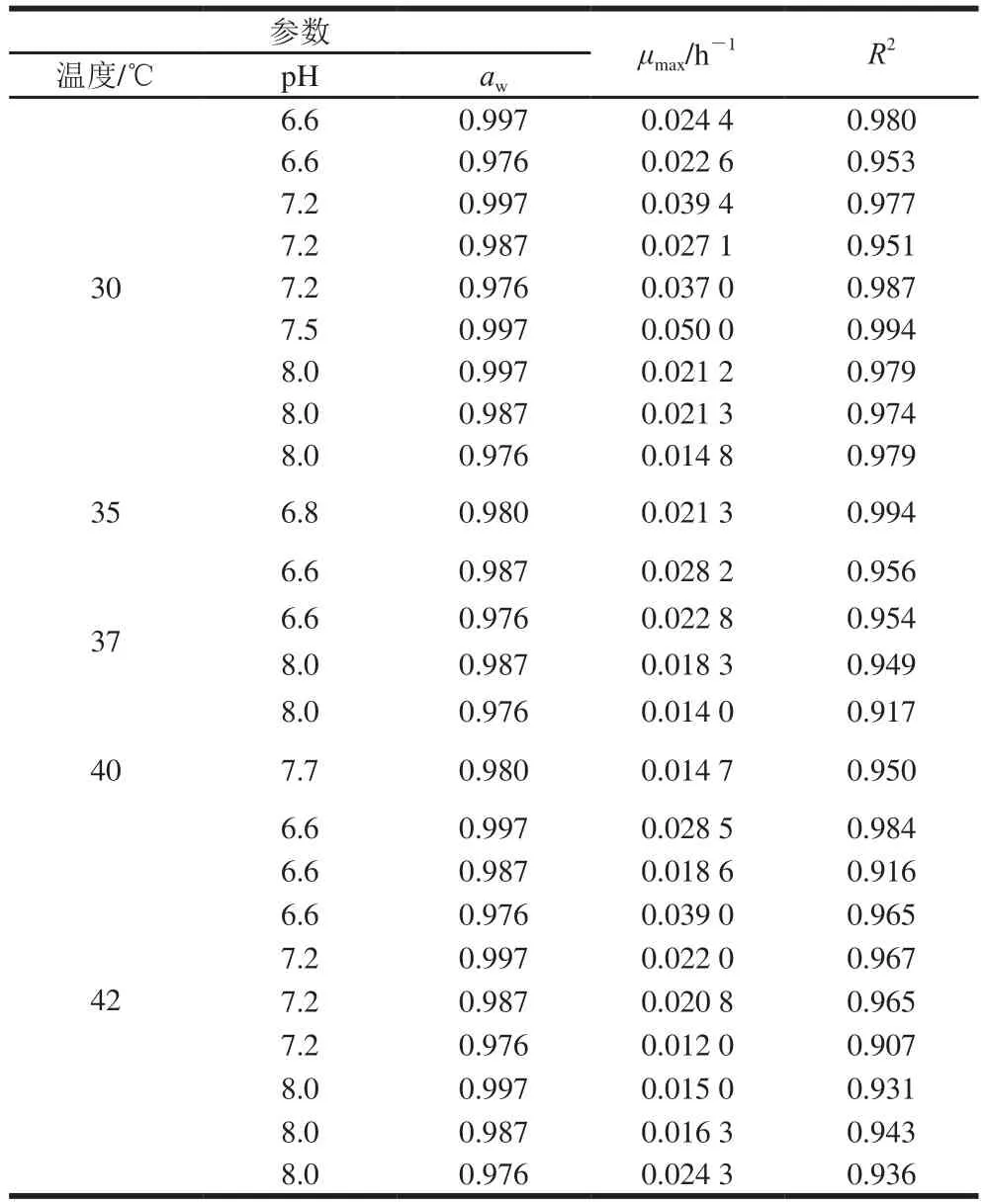
表2 用于拟合主参数模型的Baranyi模型的生长参数与决定系数Table2 Growth parameters and coefcients of determination by Baranyi model for CPM
参数 μmax/h-1 R2温度/℃ pH aw 30 6.6 0.997 0.0244 0.980 6.6 0.976 0.0226 0.953 7.2 0.997 0.0394 0.977 7.2 0.987 0.0271 0.951 7.2 0.976 0.037 0 0.987 7.5 0.997 0.050 0 0.994 8.0 0.997 0.0212 0.979 8.0 0.987 0.0213 0.974 8.0 0.976 0.0148 0.979 35 6.8 0.980 0.0213 0.994 6.6 0.987 0.0282 0.956 6.6 0.976 0.0228 0.954 8.0 0.987 0.0183 0.949 8.0 0.976 0.014 0 0.917 40 7.7 0.980 0.0147 0.950 37 42 6.6 0.997 0.0285 0.984 6.6 0.987 0.0186 0.916 6.6 0.976 0.039 0 0.965 7.2 0.997 0.022 0 0.967 7.2 0.987 0.0208 0.965 7.2 0.976 0.012 0 0.907 8.0 0.997 0.015 0 0.931 8.0 0.987 0.0163 0.943 8.0 0.976 0.0243 0.936
由表2可知,各组R2均在0.900以上,说明Baranyi模型能够较好的拟合实验中不同环境条件下肠炎沙门菌的生长情况。比较上述数据可以发现肠炎沙门菌最大比生长率随温度不同而发生显著变化(如μmax(30 ℃)=0.037 0 h-1和μmax(42 ℃)=0.012 0 h-1),其次是pH值和aw。即温度对肠炎沙门菌生长的影响最大,此结论符合金永国等[5]在关于沙门菌预测模型研究进展中所述温度是食品在生产链中波动最大的因素的说法,并与赵楠[26]和Koutsoumanis[27]等分别在建立酱卤肉中沙门菌的预测模型和建立鼠伤寒沙门菌不同温度和aw界限模型的研究中所述温度对微生物生长的影响最大的结论相一致。
2.2 CPM的建立
通过Origin 8.0软件进行二级模型拟合,得到肠炎沙门菌温度、pH值和awCPM的参数值见表3所示,拟合得到的温度、pH值、aw的CPM,如图2所示。

表3 肠炎沙门菌温度、pH值和aw的CPM参数值Table3 Parameters of CPM for the effects of temperature, pH and aw
由表3可知,肠炎沙门菌的最适生长温度为34.24 ℃,与沙门菌的生长规律相一致[1]。最适生长水分活度(aw(opt))为0.997,与Dimakopoulou-Papazoglou等[12]的研究中求得的沙门菌aw(opt)0.994很接近,最小生长水分活度(aw(min))0.957,也与Pin等[23]的研究中通过平方根模型求出的aw(min)0.947接近。求得的最适生长pH值(pHopt)7.55,在文献[28]中所述培养基中沙门菌的pHopt值为6.8~7.8的范围内。拟合获得的肠炎沙门菌相关参数值,符合上述关于沙门菌生物学特性的描述。此外,拟合得到的温度、pH值、aw主参数模型的MSE较小(小于0.001),说明误差较小,Af接近1,表明预测模型与实际观测相吻合。
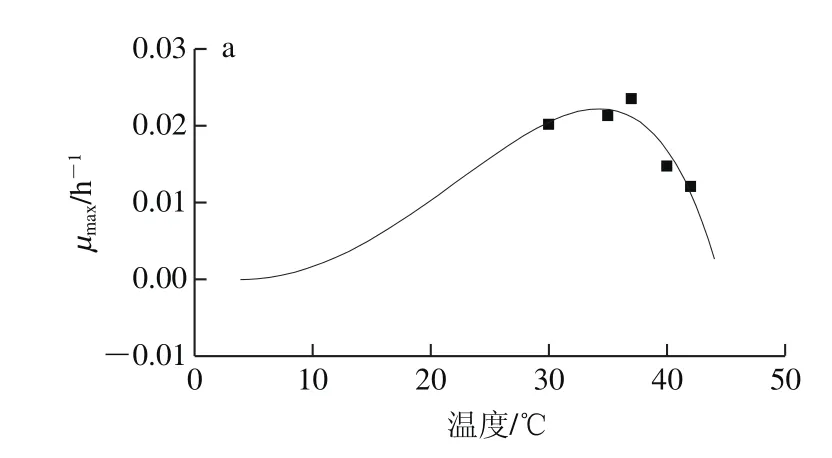
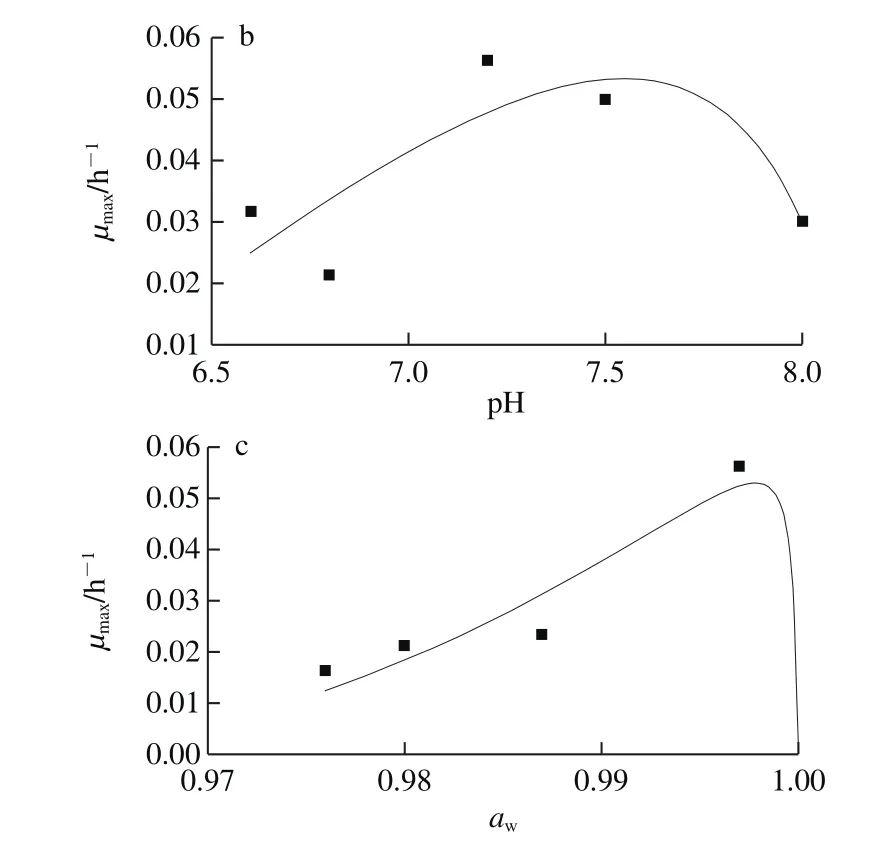
图2 肠炎沙门菌温度(a)、pH值(b)和aw(c)的CPMFig.2 CPM curves for the effects of temperature (a), pH value (b) and aw (c)
由图2可知,肠炎沙门菌的CPM,均呈现良好的拟合效果。温度的CPM曲线(图2a)与Akkermans等[29]关于新型温度、pH值作用模型的研究中得到的温度CPM曲线图呈现相同的趋势。但相比于温度和aw的CPM,pH值CPM的数据点稍显离散,但其和aw的CPM的曲线也分别与Dimakopoulou-Papazoglou等[12]关于肠炎沙门菌生物膜的pH值和aw模型构建研究中得到的模型拟合曲线图像趋势一致,即在实验范围内,μmax随着温度、pH值和aw的增加而增大,但超过某一临界值(最佳值)时,μmax开始迅速降低,同时也显示出沙门菌对该条件变化的敏感程度。
2.3 CPM的可靠性评价
将实验范围内的随机选取的7 组实验,代入已构建的肠炎沙门菌的CPM中,计算得到最大比生长率预测值与实验得到的观测值进行比较,如表4所示。
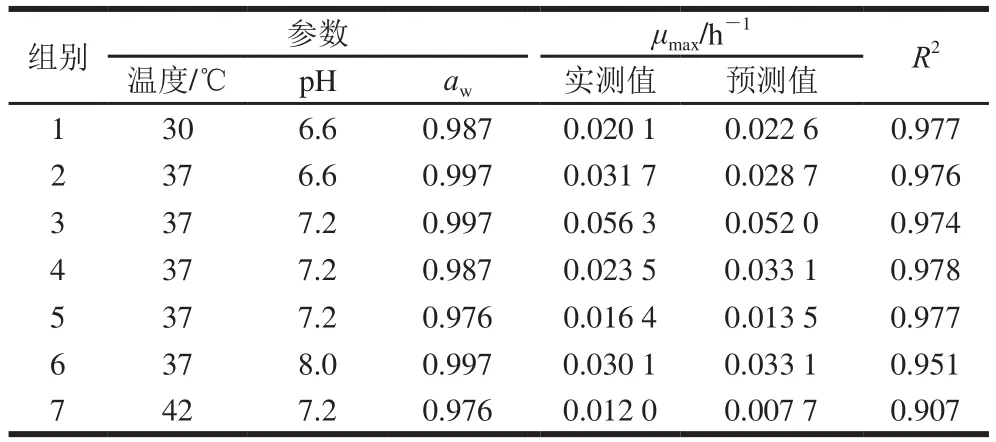
表4 用于验证肠炎沙门菌最大比生长率CPM的实测值与预测值Table4 Observed and predicted maximum specif i c growth rates of S. enteritis by CPM for validation on different growth environments
由表4可以看出,一级模型R2大于0.900表明通过Baranyi模型拟合获得的最大比生长率具有较高的拟合度,此外,CPM的预测值与实测值均比较接近(差值<0.01 h-1),说明本实验构建的肠炎沙门菌CPM具有较高的拟合效果。
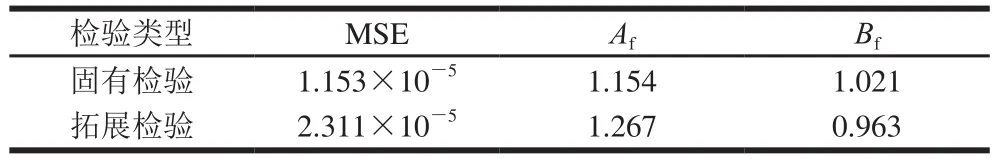
表5 肠炎沙门菌CPM的数学检验值Table5 Mathematical test values of S. enteritis by CPM
一般认为Bf为0.70~0.90或者1.06~1.15范围内说明该模型是可以被接受的[30],由表5可知,CPM固有检验求得的Bf(1.021)和由随机组求得的拓展检验的Bf(0.963)均在较好范围内。对于Af固有检验和拓展检验稍大于1,但也在可接受范围内。此外,用于检验模型拟合度的参数MSE均较小,说明构建的模型准确性较高,能够较好地预测肠炎沙门菌的生长情况。
3 结论与讨论
本实验选用了3 种环境因素建立的肠炎沙门菌CPM,获得了肠炎沙门菌在BPW培养基中主参数值分别为:Tmax44.51 ℃、Topt34.24 ℃、pHmax8.14、pHmin6.09、pHopt7.55、aw(min)0.957和aw(opt)0.997,符合肠炎沙门菌的基本生长规律。固有检验和拓展检验结果,验证CPM得到的MSE分别为1.153×10-5和2.311×10-5、Bf为1.021和0.963以及Af为1.154和1.267均在可接受范围内,表明构建的模型表明模型具有良好的拟合度,可用于预测肠炎沙门菌的生长。
国内外已经建立了大量不同食物中的沙门菌在温度与pH值、温度与aw等2 种环境因素影响下生长模型以及预测模型[12,22]。本实验得到的肠炎沙门菌的主参数值和已有的文献[12,23,31]结论类似,且均在合理的肠炎沙门菌生长范围内。但本研究求得肠炎沙门菌的主参数值与部分已有的研究结果有一定差异,Dimakopoulou-Papazoglou等[12]在pH值和aw对沙门菌生物膜形成的影响的研究中得到pH值主参数值分别为pHmin3.58、pHopt9.71和pHmax6.02。此外Lianou等[32]在建立肠炎沙门菌整合不同pH值和aw的应变率模型所求得的最小生长pHmin3.99,也与本研究有一定差异(pHmin6.09)。造成这种差异的原因可能有实验过程中试剂和实验参数、方法的选择以及实验环境因素的交互作用等。例如Dimakopoulou-Papazoglou等[12]是利用基于结晶紫染色法在微量滴定板孔中进行生物膜光密度的测量(OD580nm),并通过引入了相对生物膜形成指数,作为对pH值和aw对生物膜形成影响的量化指标,此外研究选用的液体培养基的不同可能也是造成结果不同的原因之一。Lianou等[32]则研究肠炎沙门菌菌株变异性并通过累积概率分布作为生长模型的输入用于了建模过程。本研究通过数学检验以及随机验证实验,表明构建的CPM能够很好地预测肠炎沙门菌的生长,可为以后肠炎沙门菌的监控预防和食品安全保证提供参考与理论依据,同时为研究致病菌在食品介质中的生长状态及参数提供了新思路,以减少由致病菌引发的食品安全风险。

