白灵菇蛋白提取及功能特性和结构分析
张艳荣,高宇航,刘婷婷,宋云禹,陈丙宇,王大为*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
白灵菇(Pleurotus nebrodensis),又名白灵侧耳,隶属于担子菌门,伞菌目,侧耳科,侧耳属,是阿魏菇的白色变种。白灵菇子实体色泽洁白,硕大肥厚,子实体形状有掌状、马蹄状、棒状等,是我国唯一具有自主知识产权及明确原产地的食用菌品种资源[1]。目前,国内白灵菇主要来源于工厂化栽培,产地集中在北京、河南、河北、江苏等地,产量逐年递增,据2014年统计全国白灵菇年产量已突破30.80万 t。白灵菇营养物质含量丰富,干品白灵菇子实体中蛋白质为14.70%,碳水化合物为43.30%,脂肪为4.31%,纤维为15.40%,氨基酸总量为10.70%,17 种氨基酸中有8 种必需氨基酸,占氨基酸总量的35%[2]。白灵菇以其细腻脆韧的口感和鲜香的风味走俏国内外市场,随着栽培技术的逐步成熟以及优良种质资源持续开发,未来白灵菇产业定会得到长足发展。
目前国内对白灵菇的加工应用较多是以开发高附加值产品为主的工艺研究和以白灵菇多糖为主的功能成分基础研究,而忽略了对白灵菇蛋白质(white oyster mushroom protein,WOMP)资源的开发利用。李志涛等[3]对白灵菇多糖的提取及免疫活性进行了研究。王耀辉等[4]对白灵菇多糖的抗氧化活性进行了探讨。杨国伟等[5]研究结果表明,以1 000 mL为100%,添加35%白灵菇浆料(自制)、60%麦芽汁、加糖量6%,经过36 h发酵,制作的白灵菇乳酸饮料品质最佳。李凤林等[6]对白灵菇山楂复合饮料研究结果表明,利用白灵菇菌丝发酵液为原料开发白灵菇饮料,白灵菇发酵液培养条件为:装液量80 mL/瓶、接种量为15%、调pH值为6.5、180 r/min振荡、25 ℃培养8~9 d。复合白灵菇饮料最佳配方为:发酵液20%、山楂浆15%、蔗糖10%、总酸质量分数0.4%。
一般植物蛋白具有良好的溶解性、持水性、乳化性等功能性质,在面制品、乳制品等食品工业中有广泛的应用前景。目前对WOMP的制备、功能性质和结构较为系统的研究鲜见报道,因此为了进一步开发白灵菇潜在的营养和应用价值,本研究采用超声波-微波复合辅助碱法提取WOMP并对提取工艺进行优化,同时对WOMP功能特性和结构进行研究,为白灵菇的高附加值利用提供相关理论依据。
1 材料与方法
1.1 材料与试剂
白灵菇 实验室驯化栽培优良菌株(编号AJ01)栽培;无水乙醇、氢氧化钠、溴化钾(均为分析纯)北京化工厂;彩虹245广谱蛋白Marker 北京索莱宝科技有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium doecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)试剂盒(包括30%聚丙烯酰胺、pH 8.8 Tris/SDS分离胶缓冲液、pH 6.8 Tris/SDS分离胶缓冲液、过硫酸铵干粉、上样缓冲液、四甲基乙二胺溶液) 北京鼎国昌盛生物技术有限公司;AccQ-Tag荧光衍生试剂盒(包括荧光衍生试剂、硼酸盐缓冲液、AccQ-Tag流动相A和AccQ-Tag流动相B、17 种混合氨基酸标准液) 美国Waters公司。
1.2 仪器与设备
UWave-1000型微波-紫外-超声波三位一体合成萃取反应仪 上海新仪微波化学科技有限公司;HR2168型搅拌器 飞利浦(中国)投资有限公司;CT15RT台式高速冷冻离心机 上海天美科学仪器有限公司;UV-2300紫外分光光度计 北京普析通用仪器有限公司;Acquity UPLCH-Class型超高效液相色谱系统 美国Waters公司;冷冻干燥机 德国Ghrist公司;MOS-450型圆二色光谱仪 法国Bio-Logic公司;IR Prestige型傅里叶红外光谱仪 日本岛津公司。
1.3 方法
1.3.1 WOMP等电点测定
将10.0 g脱脂白灵菇在温度45 ℃、微波功率24 W、超声波功率400 W、NaOH溶液浓度0.08 mol/L、料液比1∶25(g/mL)条件下提取1.0 h,将提取液pH值分别调到2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5。于3 800 r/min离心15 min,采用考马斯亮蓝法测定上清液中蛋白质含量[7]。
1.3.2 WOMP的提取
1.3.2.1 工艺流程
鲜品白灵菇→45 ℃热风干燥、粉碎(过40 目孔径筛)→脱脂处理→超声波-微波辅助碱法提蛋白(750 r/min,提取1 h)→离心(3 800 r/min,15 min)→上清液→酸沉(1 mol/L的HCl溶液调pH值至3.5)→离心(3 800 r/min,30 min)→蛋白沉淀→真空冷冻干燥→WOMP。
1.3.2.2 WOMP提取的单因素试验
各组试验中称取脱脂后白灵菇子实体粉末(过40 目孔径筛)10.0 g和微波功率24 W保持不变,在单因素试验中考察提取温度、超声波功率、NaOH溶液浓度、料液比和提取时间对蛋白得率的影响。设定提取温度50 ℃、超声波功率500 W、NaOH溶液浓度0.08 mol/L、料液比1∶30(g/mL)、提取时间1.0 h。单因素试验为固定其他因素研究某因素对蛋白得率的影响。各因素水平:提取温度分别为30、35、40、45、50、55、60 ℃;超声波功率分别为200、300、400、500、600、700 W;NaOH溶液浓度分别为0.02、0.04、0.06、0.08、0.10、0.12 mol/L;提取时间分别为0.1、0.4、0.7、1.0、1.3、1.6 h;料液比分别为1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g/mL)。
1.3.3 正交试验设计
在单因素试验的基础上,以提取温度、超声波功率、NaOH溶液浓度、料液比、提取时间为考察因素,以蛋白质得率为考察指标,进行L16(45)正交试验,每组试验3 次平行,并应用SPSS 18.0软件对数据进行分析处理,优化出最佳的WOMP提取工艺,正交试验因素与水平见表1。
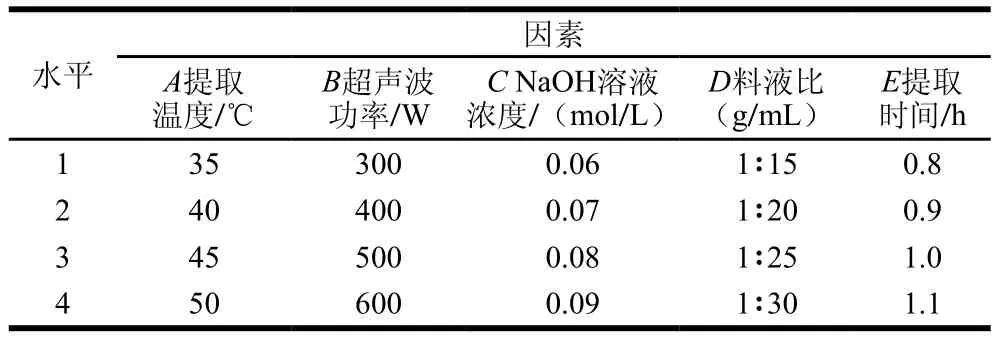
表1 正交试验设计因素与水平Table1 Variables and levels used in orthogonal array design
1.3.4 蛋白得率的计算
参考赵玉红等[8]方法,脱脂白灵菇辅助碱法提取、酸沉后离心,收集上清液,采用考马斯亮蓝法测定上清液中蛋白质含量,取1.0 mL上清液放入试管中,加入5.0 mL考马斯亮蓝溶液混匀静置3 min,测定吸光度,蛋白得率按公式(1)计算:
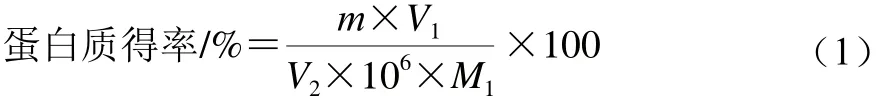
式中:m为标准曲线中查得的蛋白质质量/μg;M1为样品白灵菇质量/g;V1为离心得上清液总体积/mL;V2为测定吸光度所用上清液体积/mL。
1.3.5 WOMP功能性质测定
对WOMP的溶解性、持水性、持油性、起泡性和泡沫稳定性、乳化性和乳化稳定性测定参考刘婷婷等[9]的方法。
1.3.5.1 WOMP溶解性测定
配制10.0 mg/mL样品溶液17 份;将9 份调节不同pH值至2.5、3.5、6.0、7.0、7.5、8.0、8.5、9.0、10.0,室温条件下搅拌20 min,另外8 份分别于30、40、50、60、70、80、90、100 ℃条件下水浴搅拌20 min,离心测上清液中蛋白质含量;WOMP溶解度按公式(2)计算:

1.3.5.2 WOMP持水性和持油性测定
准确称取1.00 g WOMP样品12 份于离心管中,其中6 份加入30 mL蒸馏水,6 份加入10 mL大豆油,分别在30、40、50、60、70、80 ℃条件下水浴振荡1.5 h,静置30 min,3 800 r/min离心40 min,弃去上清液,测残留物的质量,持水性和持油性按公式(3)计算:

1.3.5.3 WOMP起泡性和泡沫稳定性测定
配制10.0、15.0、20.0、25.0、30.0、35.0 mg/mL的WOMP溶液各100 mL,高速搅打10 min,用量筒测量泡沫体积及液体体积。室温静置60 min后再记录泡沫体积,WOMP起泡性和泡沫稳定性按公式(4)、(5)计算:

1.3.5.4 WOMP乳化性和乳化稳定性测定
配制10.0、15.0、20.0、25.0、30.0、35.0 mg/mL的WOMP溶液各100 mL,加入100 mL玉米油,高速匀浆10 min,3 800 r/min离心15 min,测乳化层体积,所得混合液于100 ℃条件下保温60 min,冷却至室温后再次离心,再测乳化层体积,WOMP乳化性和乳化稳定性测定按公式(6)、(7)计算:

1.3.6 WOMP结构测定
1.3.6.1 WOMP氨基酸组成分析
超高效液相色谱分析WOMP氨基酸组成及含量,方法参考文献[10-11],准确称取WOMP样品50.0 mg于100 ℃条件下水解20 h,取1 mL水解液蒸干,用超纯水定容到10 mL备用。将17 种氨基酸标准品梯度稀释,备用。取样品10 μL,加70 μL硼酸盐缓冲溶液涡旋混合,再加20 μL衍生剂充分混合,放置5 min,封口,移入55 ℃烘箱中加热10 min;测定条件:ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm),紫外波长266 nm,柱温49 ℃,样品温度20 ℃;根据测定的必需氨基酸含量按公式(8)、(9)计算WOMP氨基酸评分、氨基酸化学评分:

1.3.6.2 WOMP的分子质量测定
参考孔毅等[12]方法,使用SDS-PAGE凝胶试剂盒配制分离胶质量分数12%,电压100 V;浓缩胶质量分数15%,80 V电压;上样量15 μL;常温固定、染色、脱色。
1.3.6.3 WOMP的二级结构测定
参考韩宇鹏等[13]方法,配制1 mg/mL WOMP中性溶液,选择远紫外光区波长范围190~260 nm;比色池为0.1 cm;光谱带宽1 nm;分辨率0.2 nm;响应时间0.25 s;扫描速率10 nm/min;圆二色光谱分辨率20 mdeg;室温条件下测定蛋白质二级结构并计算相对含量。
1.3.6.4 WOMP的官能团结构分析
参考魏春光等[14]方法,准确称取2 mg干燥WOMP和200 mg干燥KBr粉末,充分研磨混匀后压片。以KBr为背景,在500~4 000 cm-1波数下对WOMP进行红外光谱分析。
2 结果与分析
2.1 WOMP等电点测定结果

图1 WOMP等电点Fig.1 Isoelectric point of WOMP
由图1可以看出,WOMP提取液pH值在2.0~5.5范围内变化时,蛋白提取液经过酸沉、离心后测得上清液中蛋白质质量浓度逐渐降低,pH值为3.5时最低,pH值大于3.5之后,蛋白质量浓度上升趋势明显,因此蛋白等电点为3.5。
2.2 单因素试验结果

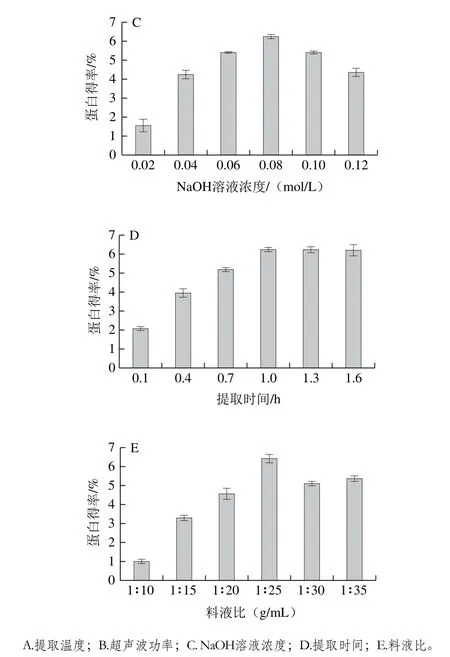
图2 各因素对蛋白得率的影响Fig.2 Individual effects of factors on protein yield
由图2A可知,随着提取温度升高,蛋白得率呈先上升后下降的趋势,在提取温度为45 ℃时得率最高。当提取温度低于45 ℃,升高温度使蛋白质分子空间构象改变,立体结构适当伸展,加强了水分子和蛋白分子之间的相互作用,蛋白质溶解度增加,得率增加;提取温度大于45 ℃,升高温度分子间运动加剧使维持蛋白质空间构象和立体结构的弱作用力消失,一些非极性的基团暴露在分子表面[15],影响蛋白质和水分子之间的相互作用,蛋白质溶解度降低,蛋白得率降低。
由图2B可知,随着超声波功率的增加蛋白得率呈先上升后趋于平缓的趋势。超声波的空化效应和机械效应破坏蛋白质四级结构,使蛋白质小分子的亚基释放[16],一些极性氨基酸残基向蛋白质分子外部迁移,增强蛋白与水分子的相互作用,使溶解度增加[17];超声波能阻止蛋白质中自由氨基群和临近羧基群之间的静电作用而提高蛋白的溶解度[18],当超声波功率大于400 W时反应体系中的蛋白质已经最大程度溶出,因此蛋白得率会趋于平稳[19]。
由图2C可知,蛋白得率随NaOH溶液浓度的增加呈先上升后下降的趋势,在NaOH溶液浓度为0.08 mol/L时得率最高为6.25%,随着NaOH溶液浓度的增加,反应体系中蛋白质分子携带的同种符号的净电荷增加,同种电荷相互排斥阻止了单个分子的聚集,因此溶解度增大[20];而过高的NaOH溶液浓度会使蛋白质水解变性,使蛋白溶解度降低,同时加速其美拉德反应生成黑褐色物质,降低蛋白质纯度[21];过高的NaOH溶液浓度会改变蛋白的营养特性,生成赖氨酰丙氨酸,降低蛋白质的营养价值[22]。
由图2D可知,提取时间大于1 h后蛋白得率随时间的延长变化不大,这与李桂菊等[23]报道的时间对蛋白提取率的影响结果一致,原因是在提取1 h后白灵菇中大部分的蛋白已经溶解在体系中。
由图2E可知,蛋白得率在料液比为1∶25(g/mL)时达到最高,为6.43%,随料液比增加得率稍有下降后趋于平缓。原因是随着溶剂体积的增加,溶质的分散程度增加,溶质与溶剂之间的接触更充分,加速了蛋白质溶出,当料液比增加到一定量时,两相体系接触程度最大化,因此得率变化趋于平缓。
2.3 正交试验结果
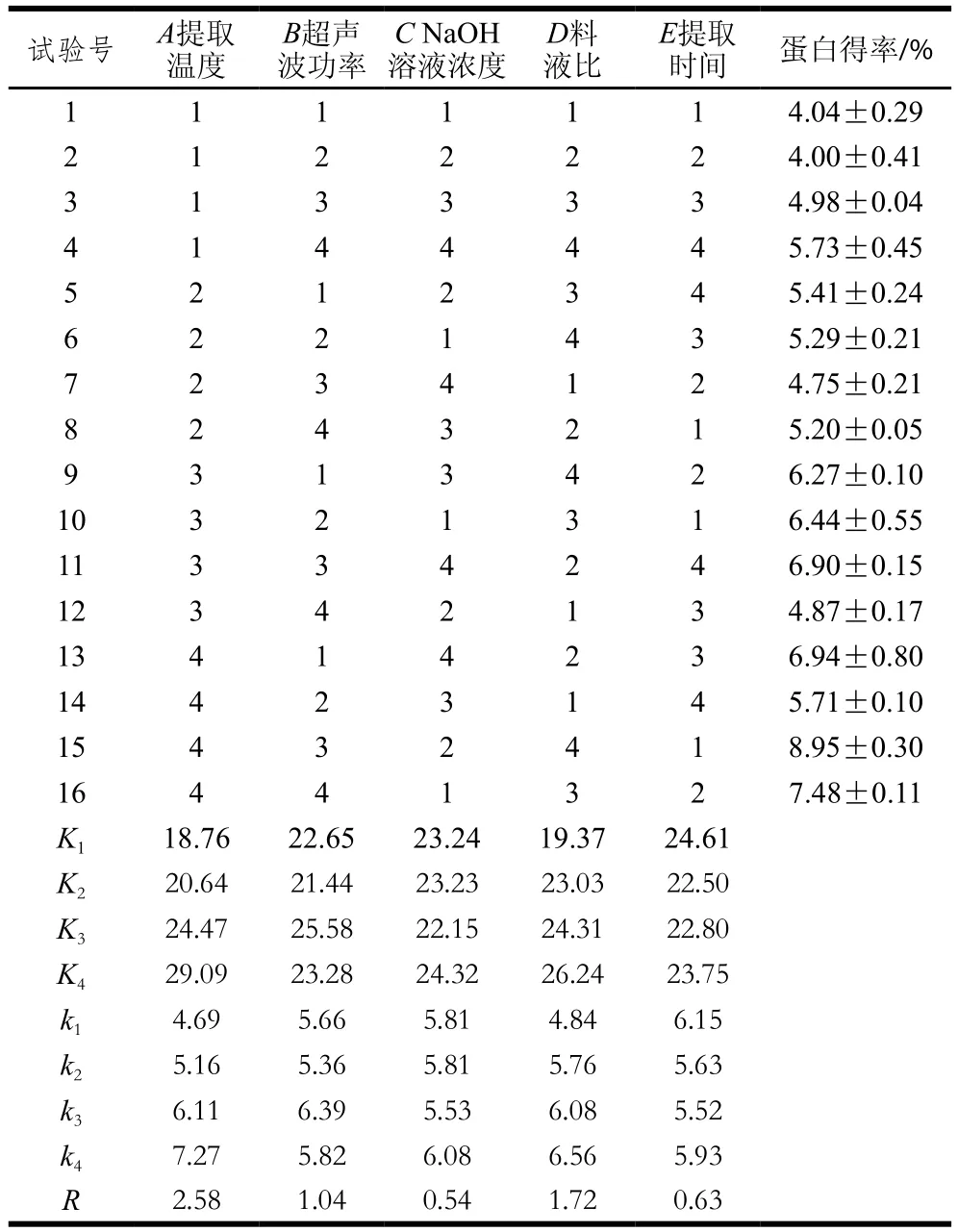
表2 L16(45)正交试验设计及结果Table2 Orthogonal array design L16 (45) with range analysis of experimental results

表3 正交试验方差分析结果Table3 Analysis of variance for the eff ects of five factors on protein yield
由表2可知,各因素对蛋白得率的影响程度大小依次为提取温度>料液比和超声波功率>提取时间>NaOH溶液浓度。由表3可知,除NaOH溶液浓度外其他因素都达到极显著水平(P<0.01),而NaOH溶液浓度对蛋白得率的影响不显著(P>0.05),这一结果与极差分析结果相符。正交分析得到的最优组合为A4B3C4D4E1,该组合不在16组正交试验中,对其进行验证实验,结果得率为(10.28±0.62)%,大于16 组试验中的最优组第15组,故最终确定WOMP最佳提取条件为:提取温度50 ℃、超声波功率500 W、NaOH溶液浓度0.09 mol/L、料液比1∶30(g/mL)、提取时间0.8 h。
2.4 WOMP功能特性
2.4.1 溶解性测定结果
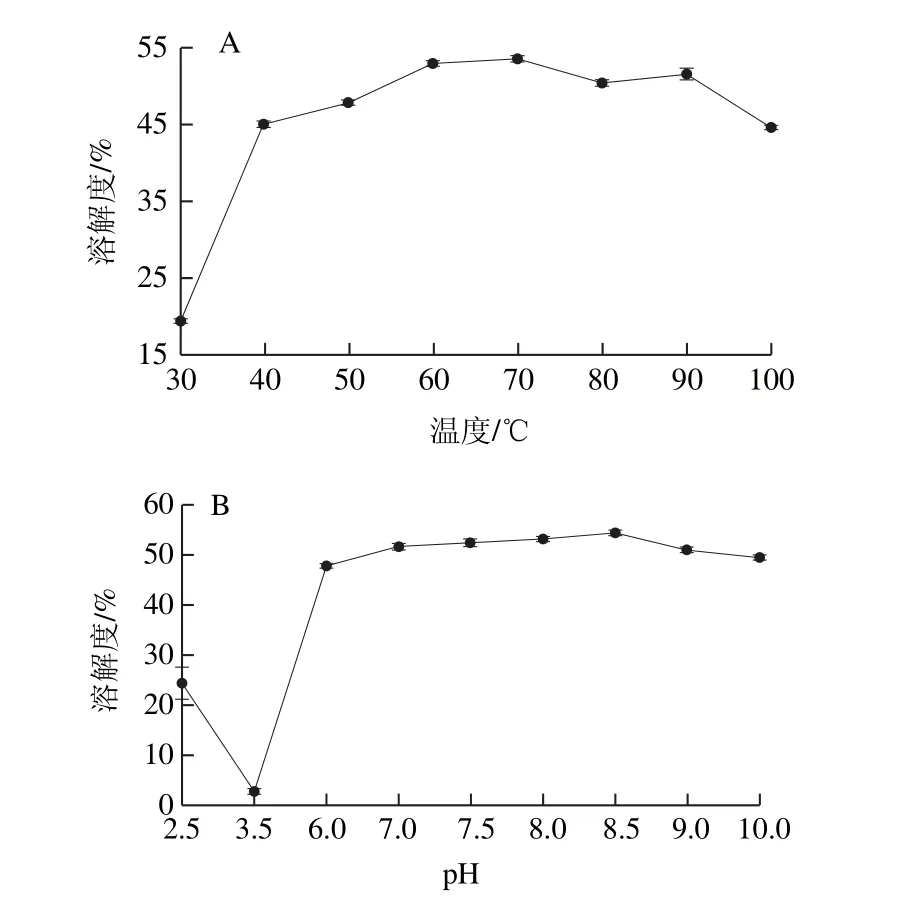
图3 温度(A)和pH值(B)对蛋白质溶解度的影响Fig.3 Effect of pH on solubility of the protein
由图3A可知,pH 7条件下WOMP的溶解度随温度的升高呈先增加后趋于平缓最后降低的趋势,在70 ℃条件下蛋白溶解度最高为53.61%,表明温度对蛋白的溶解度有较大影响[24],适当的升温有助于蛋白质分子的溶解,而温度过高则会导致蛋白质变性使溶解度降低,根据张波等[25]报道,红小豆分离蛋白在55 ℃时溶解度最高,与其相比WOMP在较高温度时有较高的溶解度,说明WOMP有较好的耐热性。由图3B可知,当pH值在等电点附近时,溶解性很低,当pH值偏离等电点时,蛋白质溶解性增加,pH 8.5时蛋白质溶解度最高为54.31%,当pH继续增加时蛋白溶解度有缓慢下降的趋势,WOMP在碱性条件下比酸性条件下的溶解性好。
2.4.2 持水性和持油性测定结果
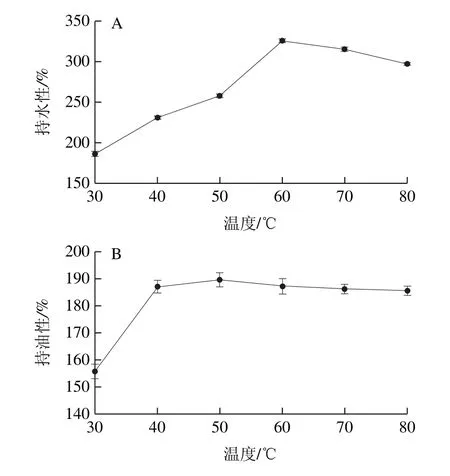
图4 温度对蛋白持水性(A)和持油性(B)的影响Fig.4 Effect of temperature on water-holding (A) and oil-holding (B) of the protein
由图4A可知,温度对WOMP持水性的影响呈现出先上升后下降的趋势,在60 ℃时达到最大为325.27%,蛋白分子在低于变性温度的环境中随着温度的升高,蛋白分子进行适当的伸展[26],一些亲水性基团充分的与水分子结合[27],当温度高于变性温度后,蛋白质变性使非极性基团大量暴露,与水分子之间相互作用减弱,持水性降低[28];由图4B可知,当温度在50 ℃时蛋白持油性达到最大为189.60%,之后持油性逐渐降低,原因是随着温度的升高,蛋白质的变性,分子间的相互作用减弱,使其持油性降低。据文献[9]报道,红小豆分离蛋白和大豆分离蛋白的持油性分别为202%和231%,均高于WOMP。
2.4.3 起泡性和泡沫稳定性测定结果

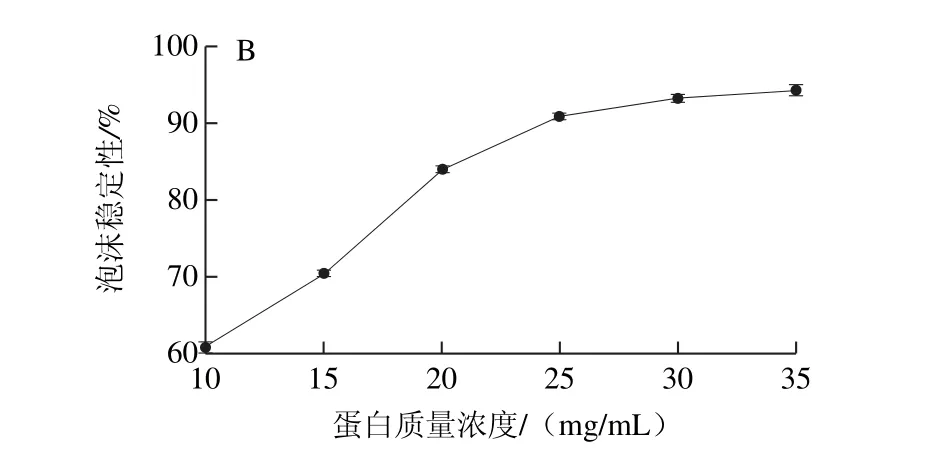
图5 蛋白质量浓度对蛋白起泡性(A)和泡沫稳定性(B)的影响Fig.5 Effect of protein concentration on foaming capacity (A) and foam stability (B) of the protein
蛋白质起泡性的本质是蛋白质分子在一定条件下与水分子和空气形成一种特殊形态混合物的能力,泡沫稳定性是衡量泡沫稳定能力的指标,在食品加工中可以利用蛋白质的起泡性和泡沫稳定性使产品达到特殊的组织状态和口感[29]。由图5可知,在考察的质量浓度范围内,WOMP的起泡性和泡沫稳定性都随着蛋白质量浓度的增加而增加,这是因为蛋白质分子浓度增加,高速搅打时分子间的相互作用增强,表面张力进一步降低进而结合更多气体,形成稳定的气泡。当WOMP质量浓度为35 mg/mL时,WOMP起泡性为237.5%,与大豆分离蛋白123%和红小豆分离蛋白127.5%的起泡性相比[25],WOMP具有较好的起泡性,可以较好地运用到焙烤食品等需要产生并保持气泡的食品中。
2.4.4 乳化性和乳化稳定性测定结果
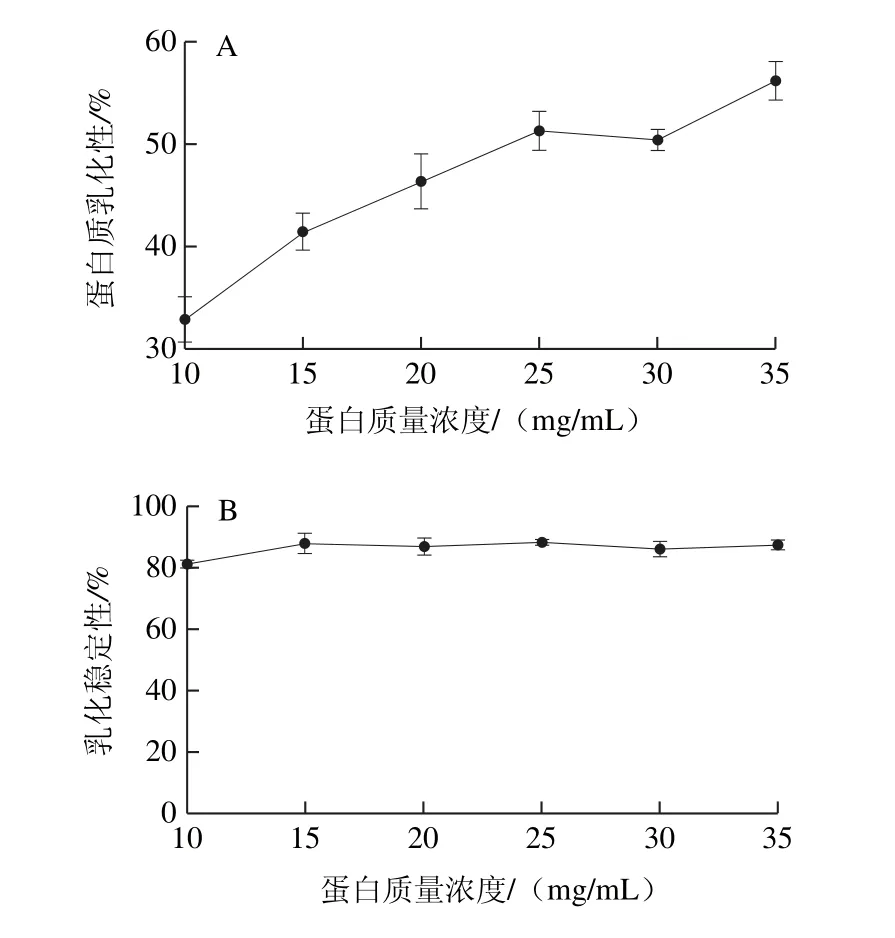
图6 蛋白质量浓度对乳化性(A)和乳化稳定性(B)的影响Fig.6 Effect of protein concentration on emulsifying capacity (A) and emulsion stability (B) of the protein
蛋白质作为一种表面活性物质,既含有亲水性基团又含有亲油性基团,具有降低水-油界面表面张力的作用,同时其降低水和空气表面张力的能力表现为乳化稳定性[30],在食品加工中应用蛋白质的表面活性,使产品具有乳化稳定状态进而可以延长产品货架期[31]。由图6可知,WOMP的乳化性随蛋白质量浓度的增加呈缓慢上升的趋势,而乳化稳定性随蛋白质量浓度增加变化不大,说明在不同的蛋白浓度条件下,WOMP有良好的乳化稳定性。当WOMP质量浓度为35 mg/mL时,WOMP乳化性为58.3%明显高于大豆分离蛋白47%和红小豆分离蛋白46%[25],说明WOMP可以作为良好乳化剂应用到食品中。
2.5 WOMP结构测定结果
2.5.1 氨基酸组成结果

表4 WOMP的氨基酸组分Table4 Amino acid composition of WOMP
由表4可以看出,WOMP含有17 种氨基酸,组氨酸是第1限制性氨基酸,其中必需氨基酸含量为322.86 mg/g,非必需氨基酸含量为487.54 mg/g,必需氨基酸占总氨基酸的比例为39.84%,必需氨基酸和非必需氨基酸的比值为0.66,接近WHO/FAO标准值,表明氨基酸组成合理。
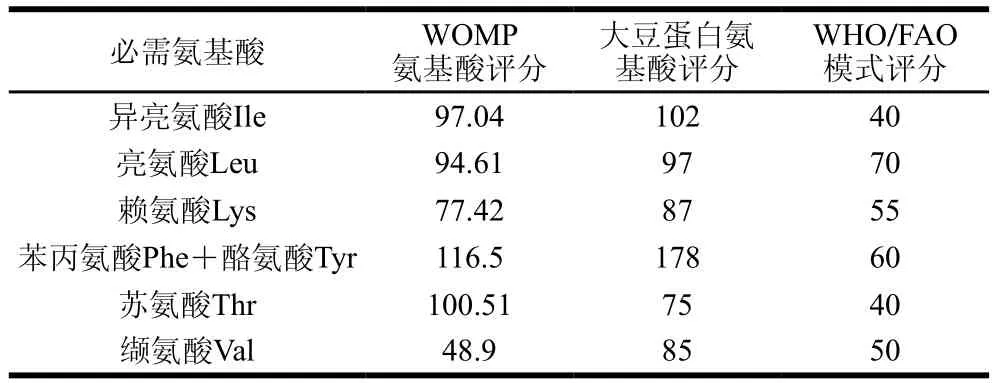
表5 氨基酸评分Table5 Amino acid scores
由表5可知,WOMP的异亮氨酸和亮氨酸评分与大豆蛋白这2 种氨基酸的氨基酸评分接近,苏氨酸评分高于大豆蛋白,其他氨基酸评分低于大豆蛋白;白灵菇必需氨基酸含量与人体所需要量接近。

表6 化学评分Table6 Chemical scores
由表6可知,除缬氨酸和苯丙氨酸+酪氨酸化学评分略低于大豆和鸡蛋蛋白评分外,WOMP氨基酸的化学评分与大豆、鸡蛋等蛋白基本相近,说明其营养价值较高,有非常大的开发潜力。
2.5.2 二级结构测定结果
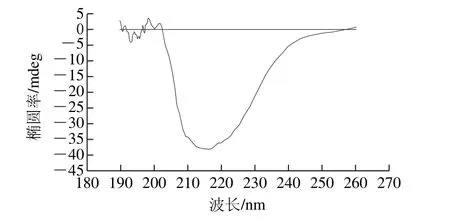
图7 WOMP的圆二色光图谱Fig.7 Far-UV CD spectrum of WOMP
圆二色性是指光学活性物质对左旋(R)和右旋(L)2 种圆偏振光吸收程度不同的现象,它的存在使通过具有光学活性物质的圆偏振光变为椭圆偏振光,且在特定吸收波长处出现。根据这一原理设计的圆二色光谱仪可以测定光学活性物质的圆二色光谱,通过圆二色光谱图可以进一步研究光学活性物质的立体构型[32],蛋白质的肽键检测波长在190~250 nm之间,该区间内有圆二色性,因此可以通过圆二色光谱图反映蛋白质二级结构[33-34]。对WOMP进行圆二色光谱扫描结果见表7和图7,通过蛋白质二级结构分析软件CD-Pro计算得WOMP二级结构中α-螺旋相对含量最高为53%,其次是无规卷曲相对含量为23%,然后是β-转角相对含量为14%,最后是β-折叠相对含量为11%。
2.5.3 WOMP分子质量测定结果
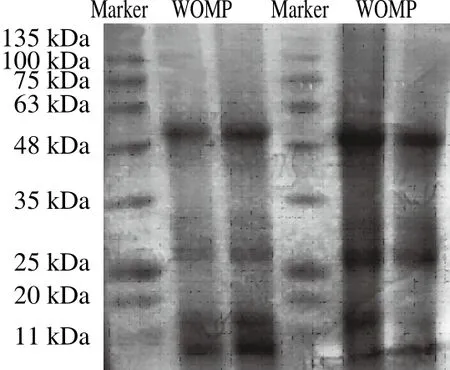
图8 WOMP分子质量电泳图Fig.8 SDS-PAGE profile of WOMP
由图8可以看出,WOMP在48~63、25~35、11~20 kDa以及小于11 kDa范围内有条带,在48~63 kDa之间条带染色程度很深,说明该分子质量的蛋白含量较高[35]。WOMP的亚基分布主要在10~35 kDa之间,占亚基总数的75%,可见WOMP以小分子结构蛋白居多。根据标准蛋白的迁移距离计算出标准蛋白的相对迁移率,以标准蛋白分子质量的对数为纵坐标,相对迁移率为横坐标,得回归方程为:y=-0.606 2x+2.351 8,R2为0.984 6,线性范围为0.51~2.09。根据标准曲线方程计算出WOMP分子质量为48.9、26.3、16.4、10.9 kDa。
2.5.4 WOMP红外光谱分析结果

图 9 WOMP红外光谱图Fig. 9 Infrared spectrum of WOMP
对于蛋白质而言,傅里变换叶红外光谱能够提供蛋白质分子中的氨基基团、酰胺I带(或H—O—H弯曲振动和C=O伸缩振动)、酰胺II带(N—H弯曲)、酰胺III带(或C—O和C—O—C振动)、蛋白质环状结构中的C—C振动,以及C—O—O糖苷键振动波段信息[36]。由图9可知,在3 022.45、2 924.09、1 681.93、1 539.20、1 244.09、1 076.27 cm-1处出现了蛋白质特征吸收峰,分别是:烯烃类—C—H—伸缩振荡吸收峰,烷烃类的—C—H—反对称的伸缩振荡吸收峰,酰胺I带的C=O伸缩振荡产生的特征吸收峰,酰胺II带中NH2的面内变形振荡吸收峰,仲酰胺中C—N的伸缩振荡和NH弯曲振荡吸收峰,NH面内弯曲振荡吸收峰[37]。而且蛋白质二级结构信息重叠在酰胺I带里[38],可以利用波段缩小技术将WOMP红外光谱中的酰胺I带细分,进一步得到WOMP二级结构的信息。
3 结 论
通过超声波-微波辅助NaOH溶液法提取WOMP,结合单因素和正交试验优化出WOMP最佳提取工艺为:提取温度50 ℃、微波功率24 W、超声波功率500 W、NaOH溶液浓度0.09 mol/L、料液比1∶3 0(g/m L)、提取时间0.8 h,蛋白得率为(10.28±0.62)%。温度和pH值均对WOMP溶解度、持水性、持油性、起泡性和起泡稳定性以及乳化性和乳化稳定性有影响,探究温度和pH值对WOMP的影响为进一步开发WOMP相关产品提供了理论基础。探明WOMP中含有17 种氨基酸,而且必需氨基酸占总氨基酸的比例为39.84%,必需氨基酸和非必需氨基酸的比值为0.66,WOMP的氨基酸组成合理,可以作为氨基酸补充剂的原料来源。WOMP的二级结构中α-螺旋相对含量为53%,β-折叠相对含量为11%,β-转角相对含量为14%,无规卷曲相对含量为23%,分子质量分布为48.9、26.3、16.4、10.9 kDa,探明WOMP的结构基础为进一步的研究提供相应的理论支持。
系统全面的研究WOMP的提取工艺、功能性质和结构,可以为WOMP开发提供理论依据,同时也为白灵菇的精深加工提供新的思路,为白灵菇产业的发展带来新的契机。

