香蕉植株上乳酸菌的分离鉴定、系统发育及抑菌特性分析
郗恩光,谭海生,杨劲松,*,崔坤鹏,张万昌,鞠雪莉,李晓雷,张桂和
(1.海南大学食品学院,海南 海口 570228;2.海南大学材料与化工学院,海南 海口 570228)
香蕉(Musa nana Lour.)为芭蕉科芭蕉属植物,主要生长在热带地区。果实营养丰富,味香,收获期较长,温带地区也很重视香蕉的栽培。原产亚洲东南部:中国台湾、海南、广东、广西等地区均有栽培[1]。在我国,香蕉是排在苹果、梨和柑橘之后的第四大水果,香蕉产业已经成为我国南亚热带地区农业支柱性产业,在热区经济和农村社会发展中发挥着重要作用[2]。随着香蕉种植面积的不断扩大,香蕉植株及香蕉副产物上附着的乳酸菌的研究不断得到各界学者的重视。
凡是能从葡萄糖或乳糖的发酵过程中产生乳酸的细菌统称为乳酸菌[3]。乳酸菌分布非常广泛,物种多样性非常丰富,具有重要的学术价值,是多个学科领域的理想材料,而且在多个工业领域的应用价值也很高。此外,这类菌中有些细菌又是人畜的致病菌,因此受到人们极大的关注和重视[4]。徐绍成等[5]从香蕉茎叶中筛出3 株高产酸菌株,分别为植物乳杆菌、短乳杆菌和乳酸片球菌,杆菌产酸速率大于球菌的产酸速率。翟海瑞[6]从柱花草中筛出4 组乳酸菌,分别为海氏肠球菌、粪肠球菌、乳酸乳球菌霍氏亚种及类植物乳杆菌,类植物乳杆菌对柱花草青贮饲料的品质有明显改善。
本研究拟利用MRS选择性培养基,从海南省五指山野生香蕉植株上分离出乳酸菌菌株,对其进行纯化、鉴定。对特殊乳酸菌进行16S rDNA序列同源性分析,构建系统发育树。16S rDNA序列同源性分析就是一种分子水平上鉴定乳酸菌菌种的手段,这种鉴定方法能够从分子和基因水平上认识乳酸菌在香蕉植株上各个部位的多样性及种群结构[7-10]。海南省五指山地区冬暖夏凉,不受寒潮侵袭,也不受台风影响。由于独特的气候条件,使海南省五指山生物种类繁多,为扩大植物源乳酸菌菌种库提供了有力的条件。
1 材料与方法
1.1 材料与试剂
样品为采自海南省五指山上的野生香蕉植株。
牛肉膏、酵母膏、柠檬酸铵(分析纯)、吐温80(化学纯) 国药集团化学试剂有限公司;琼脂 天津市大茂化学试剂厂;葡萄糖、乙酸钠、磷酸氢二钾、硫酸镁、硫酸锰、氯化钠(均为分析纯),二甲基亚砜、异丙醇(均为化学纯) 广州化学试剂厂;蛋白胨广东环凯微生物科技有限公司。
1.2 仪器与设备
SW-CJ-17-D超净工作台 苏州佳宝净化工作设备有限公司;DHG-9203A电热恒温鼓风干燥箱 宁波江南仪器厂;SKP-01电热恒温培养箱 湖北省黄石恒丰医疗器械有限公司;PHS-3E型 pH计 上海雷磁仪器厂;PL303电子天平 梅特勒-托利多仪器有限公司;MDF-382E(N)超低温冰箱 日本三洋公司;YM50FGN全自动高压灭菌锅 上海沪誉贸易有限公司;5417R离心机 德国Eppendorf公司;Millipore纯水仪 默克密理博(中国)有限公司;DYY-7B电泳仪 北京六一仪器厂;S1000高性能聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司。
1.3 方法
1.3.1 样品的采集与制备
利用冰盒将采集的样品运回实验室。分别称取切碎的样品10 g于90 mL 0.85%无菌生理盐水中,振荡均匀,静置,吸取1 mL于9 mL无菌生理盐水的试管中,逐步稀释到10-7,选择10-5、10-6、10-7三个稀释度溶液,备用[11-12]。将剩下的样品分别放入装有MRS液体培养基的真空袋中,进行厌氧富集培养48 h[13]。
1.3.2 样品中其他微生物的测定
运用涂布法将各样品10-5、10-6、10-7三个稀释液,取100 µL均匀涂布到PDA和LB固体培养基中,37 ℃培养48 h,并记录各菌群生长情况。将各样品的10-1稀释液于75 ℃水浴中恒温30 min,取100 µL均匀涂布到LB固体培养基中,适温培养48 h,测定芽孢杆菌含量[14]。
1.3.3 乳酸菌的分离纯化
运用稀释法将富集后的培养液,逐步稀释到10-7,吸取10-5、10-6、10-7三种稀释液100 µL,均匀涂布接种到含有1.5% CaCO3的MRS固体培养基中,37 ℃厌氧培养48 h[15-16]。挑取有溶钙圈的单个菌落,采用划线法进行逐步纯化。观察菌落特征,同时进行革兰氏染色实验和过氧化氢酶触实验,初步确定菌株是否为疑似乳酸菌菌株,以便进行以下实验[17-18]。
1.3.4 乳酸菌属的鉴定实验
根据文献[19-21]方法,对疑似乳酸菌菌株进行生理生化鉴定实验,实验内容包括葡萄糖产气实验、明胶液化实验、硝酸盐还原实验、耐酸实验、耐温实验、耐盐实验及糖发酵实验[22-23],以确定各菌种属的划分。
1.3.5 乳酸菌生长速率和产酸速率的测定
将各菌种以3%的接种量,接入液体MRS培养基中,37 ℃恒温培养,每隔2 h测定各菌种发酵液的pH值以及测定在600 nm波长处的OD值[5],并绘制产酸速率曲线和生长速率曲线[24]。
1.3.6 乳酸菌分子鉴定
利用16S rDNA序列分析对乳酸菌进行分子鉴定,技术路线:基因组DNA的提取→DNA电泳检测→PCR扩增→PCR产物电泳检测→测序。
1.3.6.1 基因组DNA的提取[25]
按照文献[25]进行基因组DNA的提取。
1.3.6.2 DNA电泳检测
取3 µL样品与3 µL 6×Loading buffer混合,加样于预先制备的1.0%琼脂糖凝胶点样孔中进行电泳,电压100 V,在0.5×TBE电泳液电泳20 min。电泳后,在紫外灯下观察。
1.3.6.3 PCR扩增[26-28]
16S引物序列:27f:AGAGTTTGATCMTGGCTCAG;1492R:TACGGYTACCTTGTTACGACTT。
1.3.6.4 PCR产物电泳检测及测序
待扩增反应完毕后,取3 µL PCR产物与3 µL 6×Loading buffer混合,加样于预先制备的1.0%琼脂糖凝胶点样孔中进行电泳,电压100 V,在0.5×TBE电泳液电泳20 min。电泳后,在紫外灯下观察。上机测序,输出峰图。
1.3.7 系统发育树的构建
测序所得的16S rDNA序列校对后,与NCBI的GenBank数据库进行BLAST分析,根据序列同源性,选取不同的模式菌株,采用MEGA 5.0的UPGMA法构建系统发育树,确定菌株的种属关系[12,14]。
1.3.8 滤纸片法测定乳酸菌发酵产物对致病菌抑菌作用
1.3.8.1 未处理的上清液对致病菌抑菌作用[13,29]
将乳酸菌以3%的接种量接种到MRS液体培养基中,37 ℃厌氧恒温培养48 h,测定其pH值,5 000 r/min离心15 min,取上清液。将各致病菌利用生理盐水逐步稀释至106CFU/mL,利用平板涂布法将100 µL菌悬液分别均匀涂布到NA、LB和牛肉膏蛋白胨固体培养基中。灭菌后的滤纸片浸泡在上清液中30 min,将浸泡后的滤纸片沥干平铺到平板上,同时做空白对照,37 ℃恒温培养24 h,观察滤纸片周围是否出现抑菌圈,并用十字测量法测定其抑菌圈直径。
1.3.8.2 排除乳酸和过氧化氢的上清液对致病菌抑菌作用
利用2.5 mol/L的NaOH溶液将上清液中和至pH 7.0,用过氧化氢酶溶液加入到中性上清液中至过氧化氢酶过量,37 ℃水浴2 h后,灭菌后的滤纸片浸泡在上清液中30 min,将浸泡后的滤纸片沥干平铺到平板上,同时做空白对照,37 ℃恒温培养24 h,观察滤纸片周围是否出现抑菌圈,并用十字测量法测定其抑菌圈直径。
2 结果与分析
2.1 微生物菌群的测定结果
从表1可以看出,样品中乳酸菌总数在106~107CFU/g之间,好氧细菌总数在105~107CFU/g之间,霉菌总数在103~106CFU/g之间,酵母总数在102~103CFU/g之间,芽孢杆菌在102~104CFU/g之间。样品微生物菌群中乳酸菌属于优势菌种,酵母菌和芽孢杆菌相对来说较少。
2.2 菌落与菌体特征
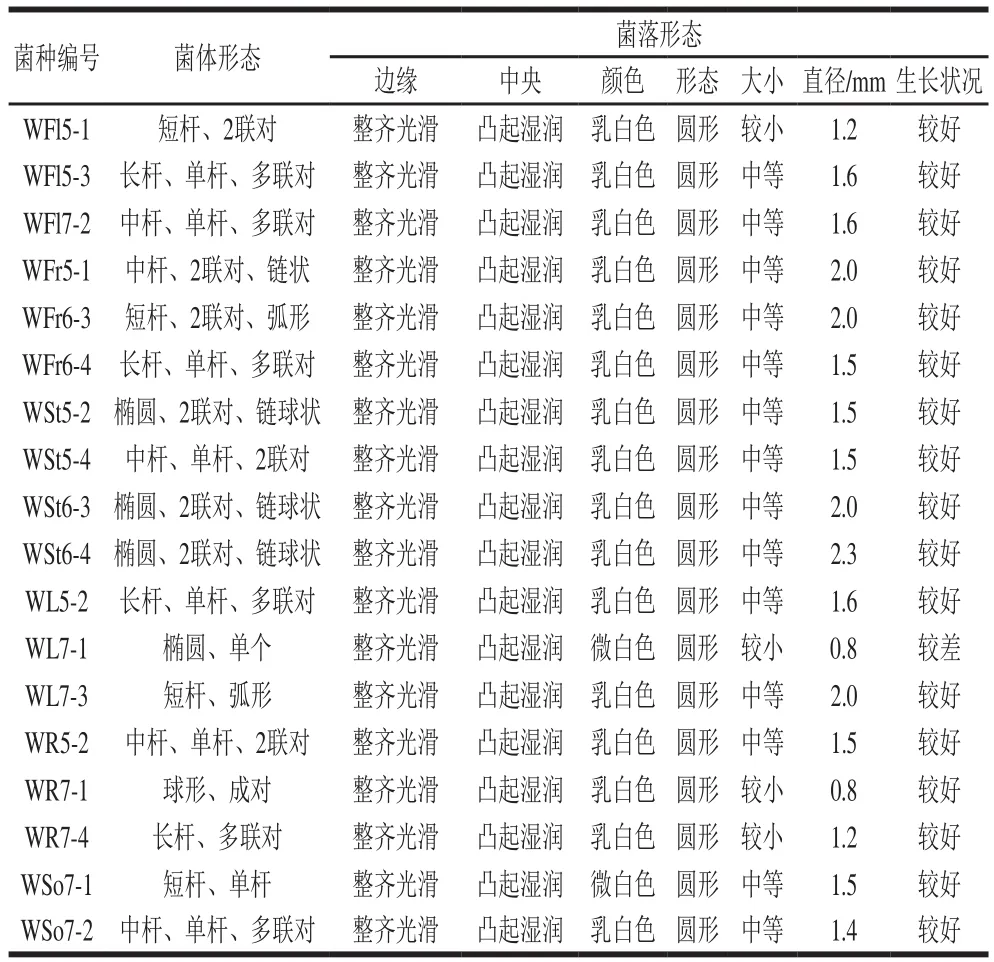
表2 香蕉植株上代表菌株菌体及菌落特征Table2 Colony and cellular morphology of the isolated strains
从样品中共筛出44 株疑似乳酸菌株。根据过氧化氢酶实验以及革兰氏染色实验结果,排除5 株过氧化氢酶实验阳性菌株。从剩下的39 株菌种中挑选18 株进行镜检生理生化实验。表2为18 株菌株的菌体和菌落形态。
从表2可以看出,全部菌株菌落形态基本相似,为生长状况良好、边缘光滑整齐、乳白色、凸起的圆形菌落;只有菌株WL7-1和WSo7-1颜色为微白色,WL7-1生长状况较差;菌株直径在0.8~2.0 mm之间。菌株WR7-1为球状,WSt5-2、WSt6-3、WSt6-4、WL7-1为椭圆状,其余为杆状。
2.3 生理生化实验结果
将选出的18 株疑似乳酸菌菌株进行一系列生理生化鉴定实验,由表3可知,18 株菌株均为革兰氏阳性、过氧化氢酶阴性、明胶液化阴性、硝酸盐还原阴性,产酸性能较好。WL7-1和WFr5-1产气,其余菌株不产气。在耐酸实验中,随着生长环境pH值的升高,菌种生长状况逐渐变好,在pH 7.0时长势最好;WSo7-1、WSo7-2、WSt5-2、WSt6-3和WSt6-4耐酸效果较好。在耐盐实验中,菌种在3.0% NaCl和6.5% NaCl环境下长势基本较好;但是WR7-1菌种在含有6.5% NaCl的培养基中不能正常生长。在耐温实验中,所有菌种在5、45 ℃和50 ℃环境下不能正常生长;在10 ℃环境下WL7-1、WSo7-1、WSt5-4、WSt6-3、WFr5-1、WR5-2能够生长,WSt5-2和WSt6-4长势较好,说明这两株菌耐低温性能较好,其余菌株不能正常生长。
2.4 实验菌株糖类发酵实验结果
根据18 株乳酸菌的菌体和菌落特征、生理生化实验结果、生长曲线和产酸速率曲线,选出具有代表性的5 株菌株,进行糖类发酵实验。WR7-1是唯一菌体特征为球形成对的菌株,同时它的生长曲线和产酸速率曲线较平缓,比较特殊;WFl5-3菌株生长形势较突出,产酸性能较好,同时此菌株的生理生化实验结果和其他大多数菌株相似;WL7-3和WFr6-4菌株的延迟期较短,比其他菌株能够快速适应环境,快速进入对数期和稳定期;WSt6-4菌株长势和产酸量较好,同时耐酸耐低温性能较好。由表4可知,5 株代表菌株利用多糖的情况基本相近,但是不尽相同。WR7-1能利用木糖,WFl5-3能利用山梨糖,WFr6-4能利用鼠李糖,WL7-3能利用少量的糖原和木糖醇;WSt6-4不能利用蜜二糖。
2.5 乳酸菌生长速率测定结果

表3 香蕉植株上代表菌株生理生化实验结果Table3 Physiological and biochemical characteristics of 18 suspected strains
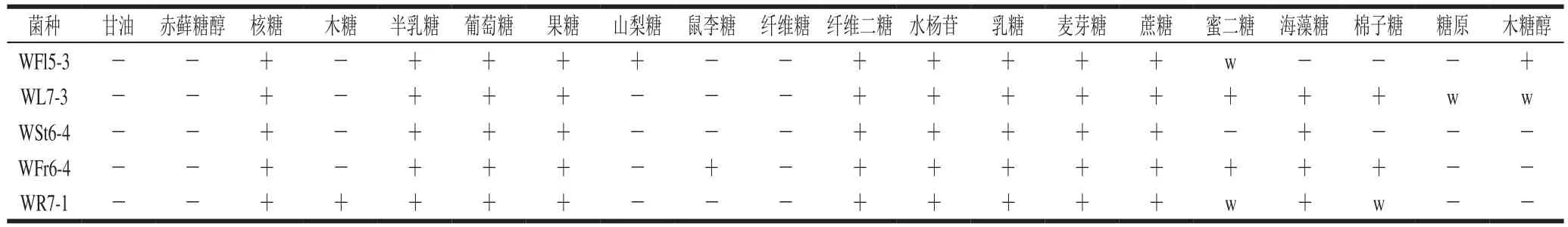
表4 香蕉植株上代表菌株糖类发酵实验结果Table4 Carbohydrate fermentation prof i les of fi ve typical strains

图1 乳酸菌生长速率曲线Fig.1 Growth rate curves of fi ve typical strains of lactic acid bacteria
由图1可知,接种后菌种有短暂的延滞期,过后很快进入对数期生长,14 h后进入稳定期,生长速率减缓,菌种量基本保持恒定;整体趋向“S”型。可以看出,WFr6-4相比其他菌种在对数期长势较快,WR7-1在对数期长势较平缓;达到稳定期后,WFl5-3长势最好,WR7-1长势较差。
2.6 乳酸菌产酸速率测定结果
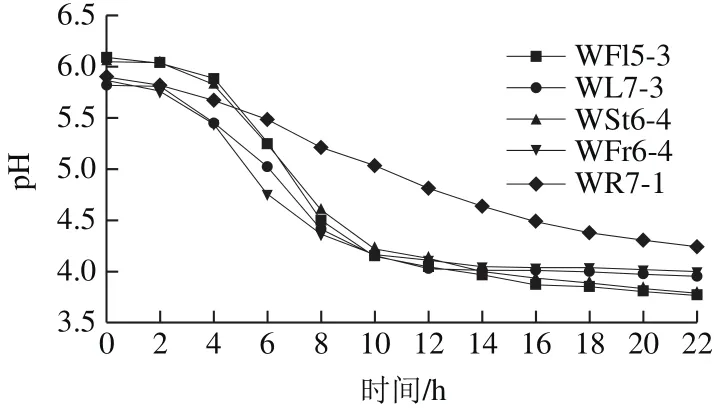
图2 乳酸菌产酸速率曲线Fig.2 Acid production curves of fi ve typical strains of lactic acid bacteria
接种后,每隔2 h测定各菌种发酵液的pH值,由图2可知,随着菌种生长速率增加,产酸速率同时增加,在4 h后,各菌种产酸量明显增加,pH值明显下降;12 h后,产酸量基本恒定。对各菌种进行比较可知,WFr6-4产酸速率较大,WFl5-3产酸能力较强,WR7-1产酸速率较缓和,产酸量较差。各菌种的产酸情况基本一致,但是还有一些差异,可以根据其自身的生物特性应用到不同的生产中。
2.7 16S rDNA序列同源性分析
2.7.1 乳酸菌16S rDNA片段PCR扩增结果
图3为待测菌株16S rDNA片段PCR扩增产物凝胶电泳图,各菌株在1 500 bp处出现单一荧光条带,而且没有明显拖尾现象,符合测序需要。
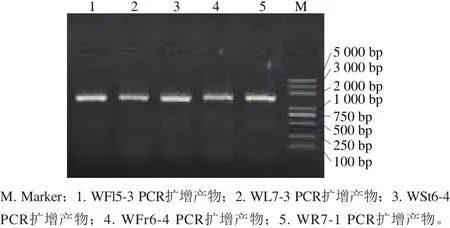
图3 乳酸菌16S rDNA片段PCR扩增产物凝胶电泳图Fig.3 Agarose gel electrophoresis patterns of PCR amplif i ed-products of 16S rDNA fragments from fi ve typical strains of lactic acid bacteria
2.7.2 乳酸菌16S rDNA序列同源性对比结果
将代表菌株进行16S rDNA测序后,将序列结果登录NCBI数据库进行相似性比对,结果见表5。WFl5-3和戊糖乳杆菌(Lactobacillus pentosus)同源性最高,WL7-3和植物乳杆菌(Lactobacillus plantarum)同源性最高,WSt6-4和植物乳杆菌(Lactobacillus sp. SMG131)同源性最高,WFr6-4和植物乳杆菌(Lactobacillus sp.Sy1)同源性最高,WR7-1和酪黄肠球菌(Enterococcus casseliflavus)同源性最高。所有菌种的同源性均达到99%以上,和标准菌株序列覆盖率均达到99%以上,E值都为0.0。
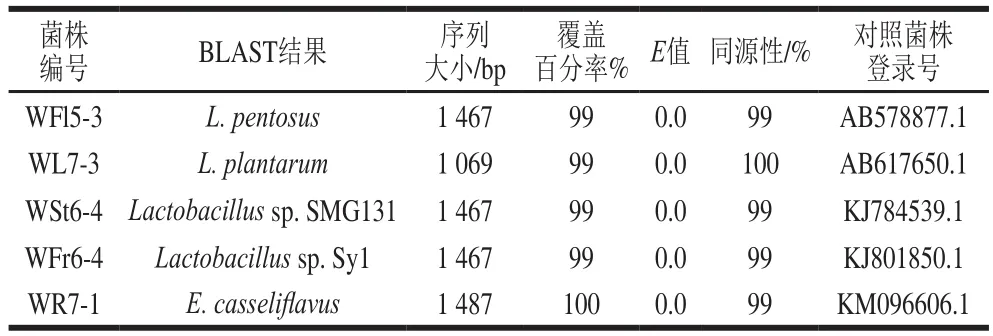
表5 菌株的16S rDNA序列同源性比对结果Table5 Homologous alignment analysis of 16S rDNA sequences from fi ve typical isolates
2.8 系统发育树的构建

图4 利用16S rDNA序列对乳酸杆菌进行构建系统发育树Fig.4 Phylogenetic tree for lactic acid bacteria based on their 16S rDNA sequences
将代表菌株进行系统发育树的构建,如图4、5所示,WFl5-3和戊糖乳杆菌(L. pentosus)系统位置最近,WL7-3和植物乳杆菌(L. plantarum)系统位置最近,WSt6-4和植物乳杆菌(Lactobacillus sp. SMG131)系统位置最近,WFr6-4和植物乳杆菌(Lactobacillus sp. Sy1)系统位置最近,WR7-1和酪黄肠球菌(E. casseliflavus)系统位置最近。根据16S rDNA序列同源性对比和系统发育树的构建,可以得到:WL7-3、WSt6-4和WFr6-4鉴定为植物乳杆菌(L. plantarum),WFl5-3鉴定为戊糖乳杆菌(L. pentosus),WR7-1鉴定为酪黄肠球菌(E. casselif l avus)。
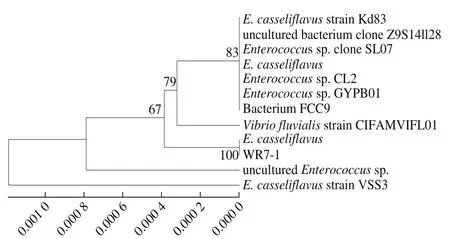
图5 利用16S rDNA序列对球菌WR7-1进行构建系统发育树Fig.5 Phylogenetic tree for WR7-1 based on its 16S rDNA sequence
2.9 滤纸片法测定乳酸菌发酵产物对致病菌抑菌作用结果
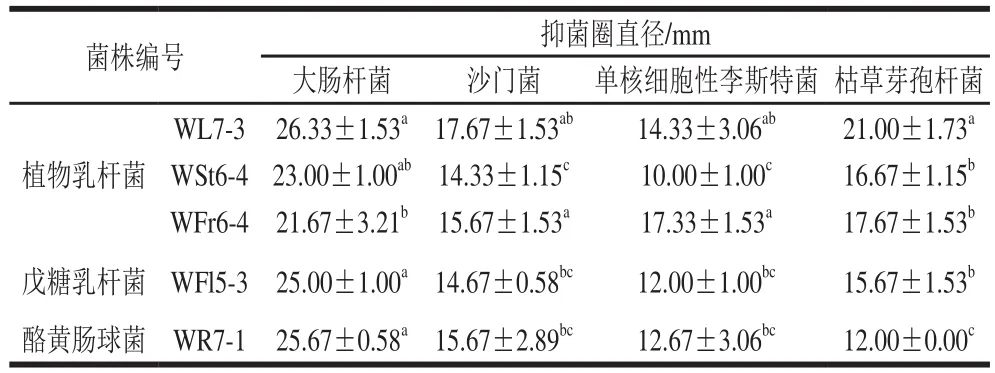
表6 乳酸菌发酵液对指示菌的抑制作用Table6 Antibacterial activity of the fermentation broths of fi ve Lactobacillus isolates on indicator strains
从表6可以看出,乳酸菌抑制致病菌的抑菌圈直径均超过12 mm,抑菌效果很明显。乳酸菌抑制大肠杆菌效果最好,抑菌圈均超过20 mm;抑制单核细胞性李斯特菌效果一般,抑菌圈在12 mm左右。乳杆菌和球菌抑制大肠杆菌、沙门菌、单核细胞性李斯特菌的效果基本一致;但是乳杆菌抑制枯草芽孢杆菌的效果明显好于球菌的抑制效果。其中菌株WL7-3相比较其他菌株抑菌效果最好。菌株WL7-3可作为潜在产细菌素乳酸菌进行研究。
乳酸菌的发酵液都能抑制致病菌的生长,其中抑制致病菌生长的因素有乳酸及细菌素等。在排除有机酸和过氧化氢后,对各菌株的发酵上清液再进行抑菌实验,结果发现滤纸片周围没有明显的抑菌圈,但是滤纸片周围的致病菌相对较少,其中WL7-1效果最明显。可以看出,菌株会产生少量的抑菌物质。在对上清液浓缩之后,滤纸片周围会有较小的抑菌圈。今后可以从乳酸菌发酵条件和促进细菌素产生物质着手,努力寻找最佳的发酵条件和能够促进细菌素物质,以期望能够增加细菌素的产量,为天然防腐剂开发等相关领域研究提供理论依据。
3 结 论
本研究从海南省五指山上野生香蕉植株上6 个部位共筛出44 株乳酸菌疑似菌株,排除5 株过氧化氢酶实验阳性菌株。从剩下的39 株菌种中挑选18 株进行镜检、生理生化实验、糖发酵实验、生长速率测定实验和产酸速率实验。根据结果选出5 株代表菌株,对其进行测序、同源性分析和系统发育树的构建。结果显示:5 株代表性菌株中有3 株为植物乳杆菌(L. plantarum)、1 株为戊糖乳杆菌(L. pentosus)、1 株为酪黄肠球菌(E.casseliflavus)。由此可见,在香蕉植株上乳杆菌属菌种为优势菌种。5 株代表菌株的产酸性能很好,可作为潜在益生菌株作进一步系统研究,能够扩大植物源乳酸菌菌种库,乳酸菌种类较为多样,而且抑菌效果较好。
目前已有学者对香蕉植株部分部位及其他热带植物进行了研究,本研究全面研究了香蕉植株上乳酸菌的多样性及分布,扩大了植物源乳酸菌菌种库,能够为今后的食品发酵工业和青贮饲料发酵业等提供植物源乳酸菌。但是香蕉的品种和种植地区都会对乳酸菌的多样性产生影响,今后要对不同地区不同品种的香蕉植株进行研究,了解相应的乳酸菌多样性,努力建立完善的体系,扩大热带乳酸菌菌种库。

