白及丝氨酸羟甲基转移酶(SHMT)基因的序列分析
沈 访 李 林 潘胤池 张社波 马 激 徐德林*
(1.遵义医学院附属医院,遵义 563000; 2.遵义医学院细胞生物学教研室,遵义 563099)
白及(Bletillastriata(Thunb.) Rchb.f.)是医药、工业、园艺的重要原材料。其假鳞茎是一种常用的中药材,具有抗菌镇痛[1~2]、消肿生肌[3]、防治口腔疾病[4]之功效。近年的药理学研究还发现,白及能合成大量的超氧化物,具有抗菌镇痛及抑制癌细胞增殖作用[1,5]。此外,白及还被广泛用作护肤化妆品、高档卷烟烟蒂胶、工业糊料、浆丝绸、浆纱、涂料、酿酒等工业原料和园艺种植的观赏花草。然而,白及已被我国列为珍稀濒危的中草药物种,同时也被国际贸易公约(CITES)附录二录入加以保护[6],因此,深入了解白及的生物学特性和基因功能对白及的资源开发利用和保护具有重要意义。
丝氨酸羟甲基转移酶(SHMT)广泛存在于生物细胞中并行使着十分重要的生物学功能,是白及等高等植物光呼吸及一碳代谢中的关键酶之一。SHMT在线粒体内与甘氨酸脱羧酶复合体(GDC)共同将叶绿体内光合作用生成的甘氨酸(Gly)转化为丝氨酸(Ser)[7],而Gly和Ser是合成叶绿素、谷胱甘肽、色氨酸、卵磷脂和磷脂、乙醇胺的前体;SHMT也是以5-磷酸吡哆醛(5-PLP)为辅酶的吡哆醛酶,在四氢叶酸(THF)存在的条件下催化合成L-丝氨酸的关键酶[8],一定条件下,SHMT能够催化N5,N10-亚甲基四氢叶酸(CH2-THF)和甘氨酸(Gly)与L-丝氨酸(Ser)和四氢叶酸的可逆反应[9]。同时伴随着甲醇、甲醛、甲酸等一碳单位的产生和代谢,在充分利用一碳代谢的同时消除其对自身的毒害。相关研究发现植物缺少SHMT或甘氨酸脱羧酶(GDC)或酶活性降低时不能进行有氧光合作用,多数会导致严重的生长延迟[10],Bornke F[11]等人认为SHMT可作为除草剂作用的新靶点,当编码含有SHMT肽段的核苷酸序列缺失时植物会表现出生长迟缓或叶片萎黄。研究植物的SHMT基因功能对认识相关化合物的代谢和对该基因的工程应用具有重要意义。
目前关于白及SHMT基因序列信息和蛋白结构与功能特点的研究未见报道。本研究从前期构建的白及转录组数据库中选取出SHMT基因的全长序列,利用系列生物信息学软件对该基因进行氨基酸序列、理化性质、蛋白二级结构、结构功能域、三级结构、亚细胞定位及蛋白质信号肽的分析,并分析白及SHMT基因核苷酸和氨基酸序列的结构特点,以期为该基因的功能验证和基因的应用研究提供理论指导,也为植物SHMT基因的分子研究提供基础资料与参考。
1 材料与方法
1.1 材料
实验用白及资源系本课题组采自贵州省正安县的当地栽培品系,由遵义医学院钱刚教授鉴定。
1.2 方法
1.2.1 白及转录组数据库的构建
提取白及不同生长发育阶段、根茎叶的总RNA进行等量混合成一个混样(mix),平分成两份,mix1和mix2。将mix1和mix2分别进行5G数据量的mRNA转录组测序(测序由苏州吉塞基因测序科技有限公司在Illumina HiSeq 2500测序平台上完成),然后用Trinity Method软件对测序结果中的高质量reads进行de novo组装成两个数据库,进一步将两个组装数据库中共有的unigene序列通过NCBI数据库进行常规的信息学注解,从中挑选出被初步注解为SHMT基因的序列(NCBI登录号:MG544187)进行生物信息学分析。
1.2.2 核苷酸和氨基酸序列特征分析
用NCBI的在线Blast对该序列进行比对,进一步用ORF Finder检测其开放阅读框,再利用DNAMAN软件进行多物种氨基酸序列的多重比对,然后用MEGA5.10软件的临接法(Neighbor-joining)构建系统进化树。
1.2.3 理化性质分析
应用Expasy网站的Protparam tool程序(http://web.expasy.org/protparam/)对SHMT进行氨基酸含量与理论分子量及等电点的分析,利用ProtScale程序(http://web.expasy.org/protscale/)进行丝氨酸羟甲基转移酶的疏水性分析。
1.2.4 结构预测
使用在线软件SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)进行目的序列的二级结构分析,应用InterProScan(http://www.ebl.ac.uk/Tools/pfa/iprscan/)和GenBank目的序列进行功能结构域分析,用同源模型服务软件SWISS-MODEL(http://swissmodel.expasy.org/)进行三维结构预测。

图1 SHMT氨基酸序列特征及比对结果 AFK83583.1:大豆;MG544187:白及;XP_020683851.1:铁皮石斛;EOY05144.1:可可树;XP_003601683.1:蒺藜苜蓿;XP_007222930.1 :桃树;XP_021689869.1:橡胶树;ANU05566.1: 野生大豆;ABO61381.1:美洲山杨;XP_022734347.1:榴莲;XP_020107001.1:菠萝;KHG17052.1:树棉;XP_002522806.1:蓖麻;Consensus:序列相似性 黑色背景表示相似性为100%;粉红色表示相似性大于等于75%;青绿色表示相似性大于等于50% 下同。Fig.1 Amino acid sequence characteristics and multiple alignment results of SHMT AFK83583.1:Glycine max; MG544187:B.striata; XP_020683851.1:Dendrobium catenatum; EOY05144.1:Theobroma cacao; XP_003601683.1:Medicago truncatula; XP_007222930.1 :Prunus persica; XP_021689869.1:Hevea brasiliensis; ANU05566.1: Glycine soja; ABO61381.1:Populus tremuloides; XP_022734347.1:Durio zibethinus; XP_020107001.1:Ananas comosus; KHG17052.1:Gossypium arboreum; XP_002522806.1:Ricinus communis Identical amino acids are highlighted in black; Amino acids similarity in at least 75% are highlighted in pink; Amino acids similarity in at least 50% are highlighted in aomidori The same as below.
1.2.5 功能分析
运用在线工具WOLFPSOPRT(http://wolfpsort.org/)进行序列的亚细胞定位分析、SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽分析、TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)进行跨膜结构域分析。
2 结果与分析
2.1 氨基酸序列分析
ORF finder对编号为目标序列的开放阅读框分析发现,该基因全长1 953 bp,包括一个完整的读码框,共编码471个氨基酸残基。通过NCBI的在线Blast对比及注解初步证实该序列是SHMT基因。应用软件DNAMAN进行多物种氨基酸序列比对,发现白及SHMT基因的氨基酸序列与铁皮石斛、蒺藜苜蓿、可可树、美洲山杨、树棉、橡胶树等植物的SHMT基因序列有同源性(图1),说明该基因在植物中的序列具有非常高的保守性,从比对中发现的几个保守区域,进一步证实该基因为SHMT基因。相似性比对还发现白及SHMT的氨基酸序列与铁皮石斛氨基酸(GeneBank登录号:XP_020683851.1)的相似性最高,达93%。
2.2 系统发育分析
将SHMT基因氨基酸序列在GenBank数据库进行检索,选择相似性高的氨基酸序列用MEGA5.10软件构建物种间系统进化树,Bootstrap方法试验引导复制次数为1 000次,遗传距离标尺为0.01。分析结果如图2所示,其结果表明白及与其它物种的SHMT基因,如可可树(T.cacaoXP_007034218.1)、树棉(G.arboreumKHG17052.1)、榴莲(D.zibethinusXP_022734347.1)、美洲山杨(P.tremuloidesABO61381.1)、蒺藜苜蓿(M.truncatulaXP_003601683.1)等表现出较远的亲缘关系;同为单子叶植物,与大叶藻(Z.marinaKMZ63006.1)、玉米(Z.maysACG33080.1)的亲缘关系仍较远。而与兰科植物铁皮石斛(D.catenatumXP_020683851.1)、蝴蝶兰(P.equestrisXP_020573994.1)同处一分支,亲缘关系最近,序列相似性达80%。
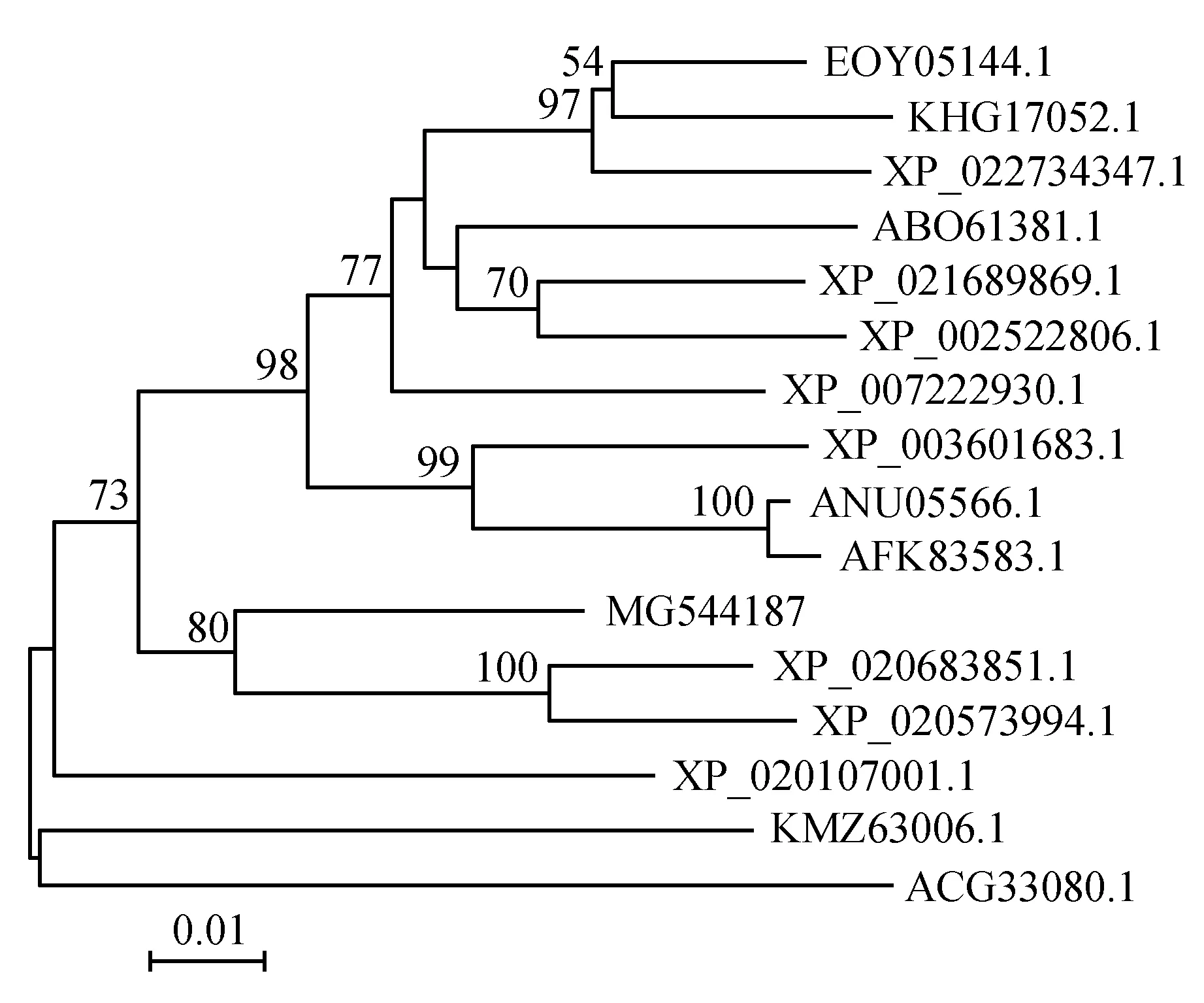
图2 SHMT氨基酸序列进化树分析Fig.2 Phylogenetic tree analysis of amino acid sequences in SHMT
2.3 理化性质预测分析
经在线软件分析,白及SHMT蛋白序列分子量为51.801 06 kD、理论等电点pI为7.17,原子组成为C2324H3614N626O687S17,正电荷氨基酸残基(Arg+Lys)53个,负电荷残基(Asp+Glu)53个,为碱性蛋白。不稳定系数为41.3(>40),表明该蛋白不稳定。疏水性结果分析表明,该蛋白为亲水性蛋白,亲水峰最大值为-0.298,位于第28位氨基酸,该处蛋白质表现出最强亲水性,其平均亲水值为-3.256;最大疏水值为2.222,位于第299位氨基酸,在该蛋白中说明该处的疏水性最强。
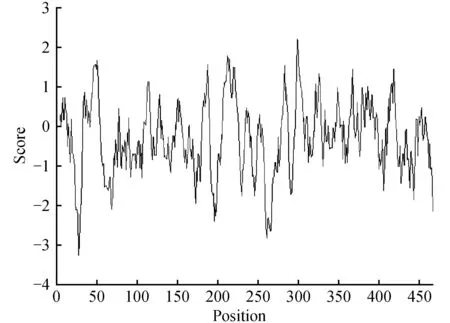
图3 蛋白质疏水性分析结果 疏水峰值大于0,亲水峰值小于0,横轴表示氨基酸位置。Fig.3 Protein hydrophobicity analysis Hydrophobic peak is greater than 0,hydrophilic peak is less than 0,the horizontal axis represents the amino acid position.
2.4 SHMT的保守结构域与二级结构、三维结构预测分析
InterProScan在线工具预测SHMT保守结构域,共有6个结构域、2个SHMT家族、1个位于236-252位(PS00096)的磷酸吡哆醛结合位点(图4A)。SHMT保守结构域主要含磷酸吡哆醛转移酶结构域,分别位于6-462位(SSF53383)、41-303位(G3DSA:3.40.640.10)、304-460位(G3DSA:3.90.1150.10),以及3个未明确分类的保守结构域(其中2个分别被命名为SHMT、Serine Hydroxymethyltransferase),该结构域属于天门冬氨基酸超家族,能催化Ser与THF反应生成Gly和CH2-THF的可逆反应;2个SHMT家族分别位于1-466位(PIRSF000412)、15-4424位(cd00378)图4B为应用GeneBank对该氨基酸进行保守结构域分析,发现该基因中含有一个催化残基的结构域,该结构域属于AAT-I家族,这与InterProScan在线软件的分析结果一致。

图4 SHMT的保守结构域与二级结构、三维结构预测分析 A. InterProScan分析出的结构域;B. GeneBank的Conserved domains分析出的结构域;C.二级结构分析(横轴表示氨基酸位置,蓝色表示α-螺旋,红色表示无规则卷曲);D.螺旋结构模型;E.球形结构模型Fig.4 Conserved domain prediction and secondary structure,tertiary structure prediction of SHMT A. Analysis of the domain of SHMT with InterProScan prediction; B. Forecast of the domain of SHMT with conserved domain in GeneBank,respectively; C. Horizontal axio indicates amino acid site( blue indicates Alpha helix; Red indicates Random coil); D. Helices model of SHMT; E. Ball model of SHMT
用SOPMA对白及SHMT进行二级结构分析(图4C)。在二级结构中,α-螺旋结构(Alpha helix)为38.85%,线状结构为(Extended strand)18.26%,β折叠结构(Beta turn)为10.83%,无规则卷曲结构(Random coil)为32.06%。表明该蛋白质二级结构的主要组成部分为α螺旋结构和无规则卷曲结构。用同源建模原理,通过SWISS-MODEL软件得到SHMT的三维结构模型(图4:D~E),分析出SHMT的QMEAN4模型数据(表1)。从表1中可以看出得到的三维结构模型具有可靠性。
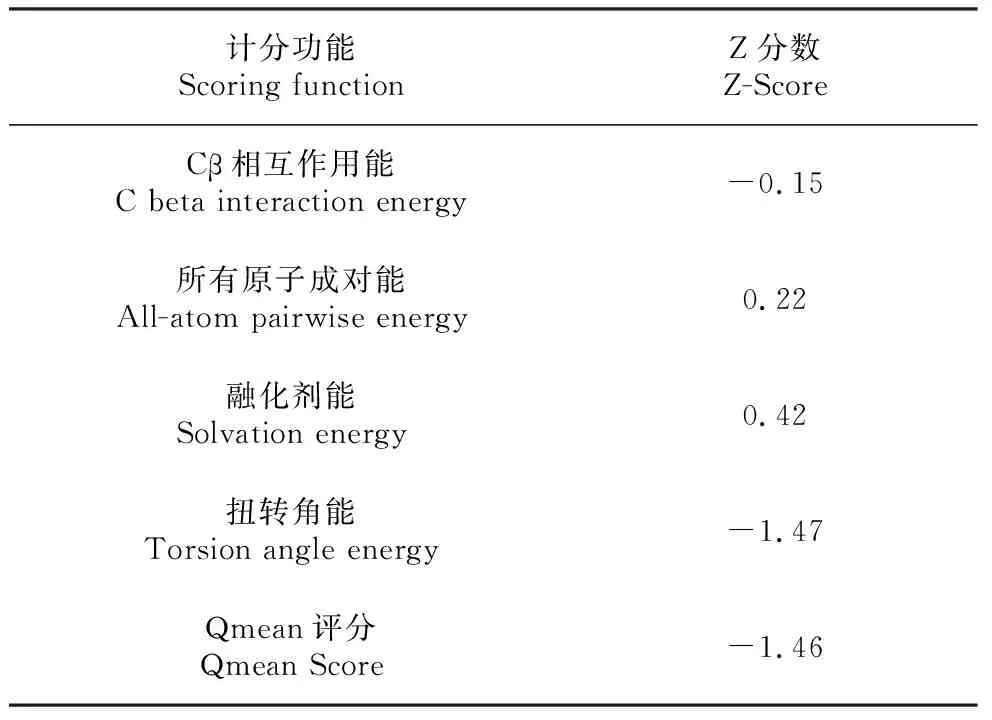
表1 SHMT的QMEAN4值Table 1 QMEAN4 global scores of SHMT
2.5 SHMT信号肽、跨膜结构域、亚细胞定位预测分析
利用在线软件对白及SHMT的信号肽进行预测(图5),结果显示第18位氨基酸残基为最高,分值为0.136;而第52位氨基酸残基具有最高的信号肽,分值为0.130,第18位为最高综合剪切位点,分值为0.117,推断SHMT无跨膜结构和信号肽。其mean S-score值为0.098,由此推断,SHMT也不是分泌蛋白。SHMT含有跨膜结构域总概率为0.004 47,远小于1,所以预测其无跨膜结构域,进一步佐证该蛋白缺乏信号肽的推断,亚细胞定位结果表明该酶定位于细胞质与叶绿体中。

图5 SHMT信号肽预测Fig.5 Signal sequence prediction of SHMT
3 讨论
SHMT克隆与表达调控方面的研究在拟南芥、大豆、可可树、豌豆等植物中已有相应的报道,其中,以拟南芥的SHMT得到较为深入的研究。通过对白及SHMT核苷酸及氨基酸序列分析表明,图1中红色标记部分表示SHMT的三个高度保守区域,分别为第55-71位“LTNKYSEGMPGNRYYGG”、第132-138位“GGHLTHG”,这与MC Hong[12]等人在AnSHMT中检测出的保守区域是一致的。也佐证了该蛋白是具有高度保守性的功能蛋白。此外,第285~290位为一个富含甘氨酸氨基酸序列“SLQGGP”的高度保守结构域结合位点,该位点为磷酸吡哆醛的必须结合位点[13]。植物中与5-磷酸吡哆醛(5-PLP)结合后的SHMT能够催化N5,N10-亚甲基四氢叶酸(CH2-THF)和甘氨酸(Gly)与L-丝氨酸(Ser)和四氢叶酸之间的相互转化,产生的甘氨酸(Gly)与丝氨酸(Ser)为叶绿素、谷胱甘肽、卵磷脂和磷脂、乙醇胺前体的合成提供原材料,植物中SHMT基因的高度保守性,并未因物种进化而产生极大差异,也正是因为SHMT的序列的这种保守性,使得许多学者将古细菌的SHMT作为研究方向,尤其是极端环境中生长的细菌。
Soulages JL[14]等人的研究认为高度亲水性及无规则卷曲结构使得蛋白具有三个功能:(1)作为水分结合蛋白减少水分丧失;(2)作为水和缓冲剂调节水状态;(3)作为水基质或替代物同大分子反应阻止脱水组织中蛋白质的失活。在白及SHMT蛋白的理化性质中也表现出高度亲水性,且二级结构含无规则卷曲结构,推测该蛋白也可能具有减少水分丧失、调节水状态、作为水基质或替代物同大分子反应阻止脱水组织中蛋白质的失活等功能,具体有待进一步研究。
SHMT蛋白的结构在动物、植物和微生物之间有显著差异,功能也有很大不同。哺乳动物的SHMT是含有PLP的亚基构成的同型四聚体,分子量大约为53 kDa,在纯化的大肠杆菌的SHMT蛋白是由相同亚基构成的同型二聚体[15],而嗜热脂肪芽孢杆菌(Bacillussterothermophilus)中分离纯化的重组酶是一个二聚体(90%)和四聚体(10%)的混合物[16],从植物中纯化出来的SHMT则是同型四聚体结构[17],这可能与SHMT在不同的生物中存在变构调控功能有关。结构分析发现,白及SHMT的二级结构主要由α-螺旋结构(Alpha helix)和无规则卷曲结构(Random coil)两个元件构成,三级结构为四聚体结构。GeneBank保守结构域预测表明该蛋白有四个保守结构域,即活性位点结构域、甘氨酸—磷酸吡哆醛结合位点、叶酸结合位点以及二聚体界面结构域,均属于AAT-I家族,其中以活性位点结构域与甘氨酸—磷酸吡哆醛结合位点结构域保守性最强,该结构域在空间三维结构中的位置如(图4E)所示。
在高等植物中,SHMT通常以胞质和线粒体亚型以及叶绿体型存在,在Crithidia fasciculata的领鞭毛体中检测到SHMTⅠ,SHMTⅡ,SHMTⅢ 3种分子形式的SHMT,其中SHMTⅠ是胞质型,另外两种为颗粒状形态,即线粒体型(SHMTⅡ)和glycosomal型(SHMT Ⅲ)[18]。在拟南芥中SHMT家族的SHMT1与SHMT2蛋白产物可能被定位于线粒体基质中,另外3个SHMT基因编码胞质SHMT[9]。通过亚细胞定位发现,白及SHMT蛋白定位于细胞质、叶绿体中,叶绿体中的SHMT参与光呼吸途径,主要功能是从达尔文循环通过核酮糖-1,5-二磷酸的氧合作用回收利用碳和氮,在线粒体甘氨酸裂解系统的共同作用下,使Gly转化为Ser、CO2及NH3[7],推测这可能是SHMT能作为除草剂靶点(造成Gly转化为Ser、CO2及NH3障碍,植物光呼吸受抑制,叶片萎黄或生长迟缓)的原因所在。结合白及SHMT的信号肽及跨膜结构分析结果,该蛋白不具信号肽及跨膜结构,推测白及与豌豆一样,SHMT也有线粒体型、叶绿体型和胞质型之分,且在同一植株中根、茎、叶中含量也不相同[19]。
本研究通过对白及SHMT的生物信息学分析,为进一步阐明SHMT的作用机制及功能应用奠定了理论基础,同时为植物SHMT基因的分子研究提供了理论依据和资料。

