高等植物二氢黄酮醇4-还原酶基因研究进展
于婷婷 倪秀珍 高立宏 韩国军 朱长甫 盛彦敏
(长春师范大学生命科学学院,长春 130032)
高等植物呈现出丰富多彩的颜色依赖于天然植物色素的存在。不同植物的不同器官中存在不同含量及种类的色素,导致植物呈现出不同的颜色。除此之外,高等植物花色主要由四种色素组成,分别为叶绿素、类黄酮(flavonoids)、类胡萝卜素(carotenoids)和甜菜色素(betalains),不同种类的植物,积累的色素的种类也不同[1~6]。自然条件下花青素(anthocyanidins)常以其糖苷衍生物—花青素苷(anthocyanins)的形式存在的,隶属于类黄酮,是一种水溶性天然色素,在植物中广泛存在。类胡萝卜素可与花青素苷或甜菜色素同时存在,但甜菜色素不与花青素苷同时存在[1~2]。植物主要的花青素有:矢车菊色素(cyanidin)、飞燕草色素(delphinidin)和天竺葵色素(pelargonidin)[7](图1)(在B环4′上取代基是羟基者为天竺葵色素;3′和4′上取代基是羟基者为矢车菊色素;3′、4′和5′均为羟基取代的为飞燕草色素)。三种花青素由于在类黄酮骨架上的R1和R2位不同程度的羟基化和甲基化又会衍生出不同的花青素。本文概述了花青素苷合成相关的结构基因和花青素苷合成相关的调控基因,重点结合作者的工作综述了DFR的底物特异性以及克隆的DFR基因在植物基因工程中的应用。
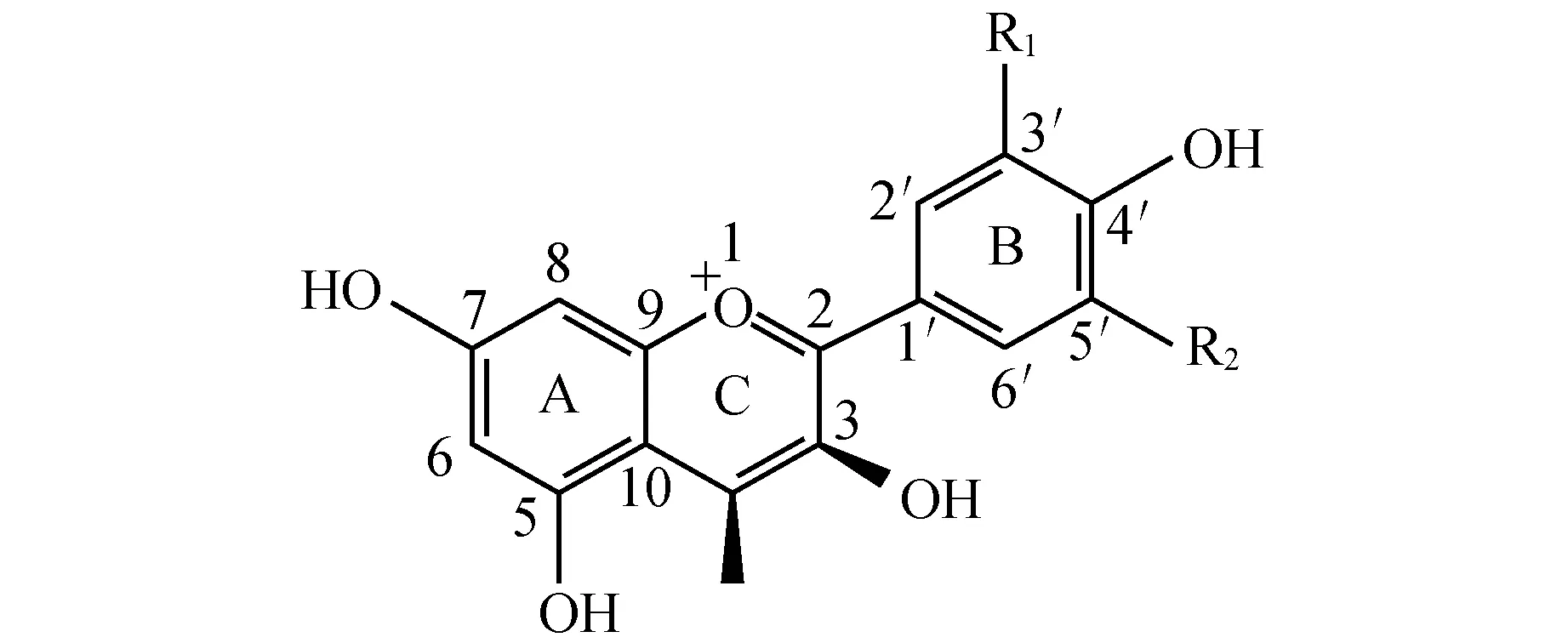

名称NameR1R2天竺葵色素PelargonidinHH矢车菊色素CyanidinOHH飞燕草色素DelphinidinOHOH芍药色素PeonidinOCH3H牵牛花色素PetunidinOCH3OH锦葵色素MalvidinOCH3OCH3
1 花青素苷的生物合成
自20世纪80年代开始,遗传学和分子生物学家通过对玉米(Zeamays)籽粒、金鱼草(Antirrhinummajus)和矮牵牛(Petuniahybrida)以及拟南芥(Arabidopsisthaliana)等模式植物花颜色变异突变体的研究,花青素苷代谢途径及关键酶类已经较为清楚。可将与花青素苷生物合成相关的基因划分为两种类型,一种类型为结构基因,为植物所共同拥有,直接编码相关的关键酶类[8];另一类则是调控基因,该类基因调控合成基因的表达强度以及模式,且控制时空表达的变化[8]。
1.1 花青素苷合成相关的结构基因
花青素苷的生物合成是类黄酮合成途径中的一个分支途径(图2)[9~10]。查尔酮合酶(CHS)催化1个分子的p-香豆酰CoA(p-Coumaroyl-CoA)和3个分子的丙二酰CoA(Malonyl-CoA)缩合成类黄酮途径中的第一个中间产物—柚皮素查尔酮(Naringenin chalcone),它是该途径当中的第一个限速酶,柚皮素查尔酮为类黄酮提供了基本的碳骨架。根据类黄酮化合物结构,将其分为黄酮(flavones)、黄烷酮(flavanones)、黄酮醇(flavonols)、黄烷-3,4-二醇(flavan-3,4-diols)(无色花青素,leucoanthocyanidin)、原花青素(缩合单宁)[proanthocyanidins(condensed tannins)]、异黄酮(isoflavonoids)和花青素苷等主要的类型[3,11~13]。在查尔酮异构酶(CHI)的催化下柚皮素查尔酮转化为类黄酮化合物合成的直接前体—黄烷酮类的柚皮素(Naringenin)。花青素苷的生物合成途径在三个羟化酶[黄烷酮3-羟化酶(F3H)、类黄酮3′-羟化酶(F3′H)和类黄酮3′,5′-羟化酶(F3′5′H)]作用下形成3个分支(图2)。其中,F3′H和F3′5′H能够决定花青素B环羟基化类型,结果将直接影响所产生的花青素苷的种类,克隆的F3′H和F3′5′H基因已广泛应用于改变植物(如康乃馨和玫瑰等)花颜色的基因工程[3]。F3H催化柚皮素C环3位加上一个羟基,生成二氢堪非醇(Dihydrokaempferol,DHK)。F3′H催化DHK的B环3′位置羟基化生成二氢栎皮黄酮(Dihydroquercetin,DHQ),而二氢杨梅黄酮(Dihydromvricetin,DHM)则是由F3′5′H催化DHK的B环3′和5′位置羟基化生成或者催化DHQ生成DHM。二氢黄酮醇(Dihydroflavonols)(DHK、DHQ和DHM)是花青素苷和黄酮醇合成途径的中间产物(图2)。花色的形成依赖于二氢黄酮醇B环上的羟基数目,其数目越多形成的花青素的颜色越蓝。蓝/紫色的花往往包含基于飞燕草色素的花青素苷,洋红色/红色的花主要含有基于矢车菊色素的花青素苷,而橙/砖红色的花含有基于天竺葵色素的花青素苷[3,6]。
在花青素的合成过程中,二氢黄酮醇4-还原酶(DFR)是其下游途径中的第一个关键的酶,直接影响花色的形成。DFR在辅助因子还原型辅酶Ⅱ(NADPH)的参与下,可选择性地催化3种二氢黄酮醇(DHK、DHQ和DHM)形成相应的不稳定无色花青素(Leucoanthocyanidins),包括无色飞燕草色素(Leucodelphinidin)、无色矢车菊色素(Leuc-ocyanidin)和无色天竺葵色素(Leucopelargonidin)(图2~3)[11,14]。生成的无色花青素是花青素苷、儿茶素以及原花色素的共同前体[11~12,15]。而FLS催化3种二氢黄酮醇(DHK、DHQ和DHM)分别形成相应的三个黄酮醇[16]:堪非醇(Kaempferol)、槲皮素(Quercetin)和杨梅素(Myricetin)。DFR和FLS竞争二氢黄酮醇作为其酶的底物(图2)[17]。花青素合酶(ANS)将三种无色二氢黄酮醇转化成花青素,它们与花色的产生直接相关。最后,花青素糖基转移酶(GT),将花青素在细胞质和液泡转变为花青素苷[3,6,8]。GT影响植物花青素的稳定性和可溶性,糖基化的位置即由它决定。
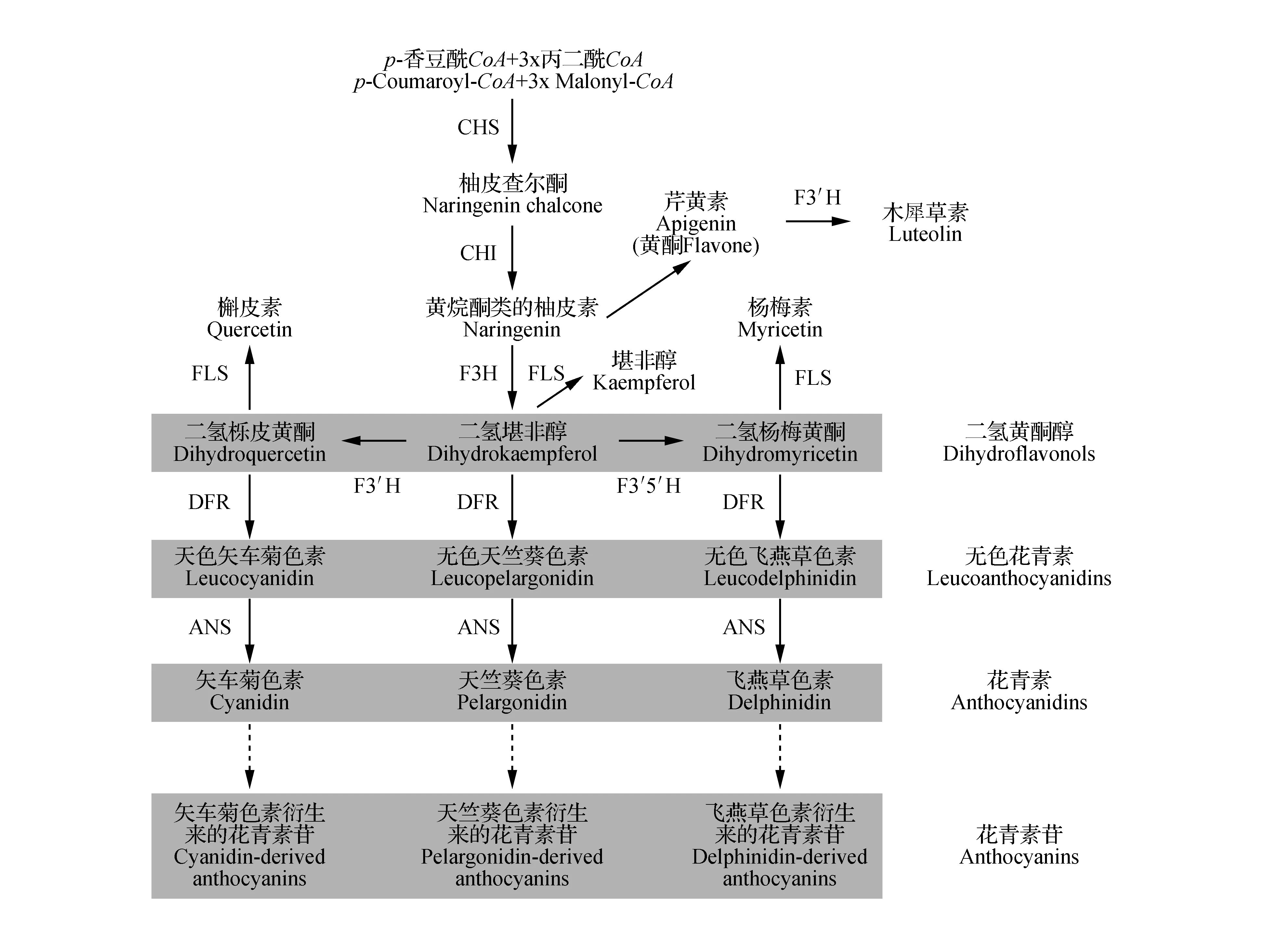
图2 植物类黄酮代谢途径中花青素苷合成示意图[11] ANS.花青素合酶;CHI.查耳酮异构酶;CHS.查耳酮合酶;DFR.二氢黄酮醇4-还原酶;F3H.黄烷酮3-羟化酶;F3′H.类黄酮3′-羟化酶;F3′5′H.类黄酮3′,5′-羟化酶;FLS.黄酮醇合酶;FSⅡ.黄酮合酶Fig.2 A schematic diagram of anthocyanin biosynthesis in plant flavonoid metabolic pathway ANS. Anthocyanidin synthase; CHI. Chalcone isomerase; CHS. Chalcone synthase; DFR. Dihydroflavonol 4-reductase; F3H. Flavanone 3-hydroxylase; F3′H. Flavonoid 3′-hydroxlase; F3′5′H. Flavonoid 3′,5′-hydroxlase; FLS. Flavonol synthase; FSⅡ. Flavone synthase
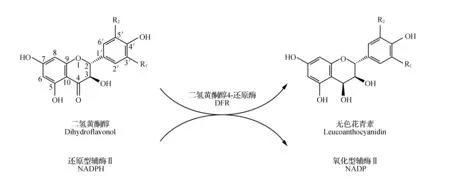
图3 二氢黄酮醇4-还原酶(DFR)的催化反应示意图[14] 在二氢黄酮醇的R1和R2上取代基是氢原子者为二氢堪非醇(DHK),R1上取代基是羟基而R2上取代基是氢原子者为二氢栎皮黄酮(DHQ),在R1和R2上取代基都是羟基者为二氢杨梅黄酮(DHM)。在无色花青素的R1和R2上取代基是氢原子者为无色天竺葵色素,R1上取代基是羟基而R2上取代基是氢原子者为无色矢车菊色素,在R1和R2上取代基都是羟基者为无色飞燕草色素。Fig.3 A schematic diagram of reaction catalyzed by dihydroflavonol 4-reductase(DFR) In dihydroflavonol,dihydrokaempferol(DHK,R1=H,R2=H);dihydroquercetin(DHQ,R1=OH,R2=H);dihydromyricetin(DHM,R1=OH,R2=OH). In leucoanthocyanidins,leucopelargonidin(R1=H,R2=H); leucocyanidin(R1=OH,R2=H); leucodelphinidin(R1=OH,R2=OH).
1.2 花青素苷合成相关的调控基因
众多结构基因编码的酶催化生成花青素苷,这些酶包括CHS、CHI、F3H、F3′H、F3′5′H、DFR、ANS和GT等,生成的花青素苷随后经过各种修饰后会被转运到液泡等部位储存起来。这些基因可被光、温度、蔗糖、干旱、植物激素以及其它生物胁迫等调控[6,18~20],但是花青素苷的生物合成受多种转录因子的调控,并主要发生在转录水平上。也有一些花青素苷途径的调控发生在转录后水平上,此外植物microRNA亦参与调控花青素苷生物合成过程[18]。在花青素苷的合成途径中,转录因子可调控一个或多个基因的表达,通过多步调控作用来调控代谢物的含量。目前已经鉴定了三类起调控作用的重要转录因子:MYB蛋白、bHLH蛋白和WD40(WDR)蛋白[19~25]。在大部分的物种中,都是由MBW复合体来调控花青素苷的生物合成,该复合体由MYB转录因子、bHLH转录因子和WD40蛋白构成,该复合体结合到结构基因启动子的特定DNA序列(顺式作用元件)进行调控[19,25~29],各类器官会差异表达这三种调控因子,通过形成MBW复合体的形式直接来调控花青素苷结构基因的表达[19~25]。MBW复合体的特异性调控作用主要依赖于MYB和bHLH,它们可以结合到特异的DNA序列上,而WD40则不能直接与DNA作用。对于复合体中WD40作用的研究,目前还没有得出明确的结论,有研究者推测WD40可能在参与信号的传递、复合体的稳定或定位等方面发挥作用[19]。祝志欣和鲁迎青[19]详尽地综述了高等植物花青素苷转录因子及其复合体在调控花青素苷生物合成过程中的作用机制,我们在此文中主要综述目前人们对植物DFR底物特异性的研究现状以及克隆的DFR基因在植物基因工程中的应用及展望。
2 DFR的底物特异性
二氢黄酮醇4-还原酶(DFR)是将二氢黄酮醇转变为花青素苷反应的第1个酶,它功能的缺失将直接导致花青素无法形成[30]。因此,DFR是花色形成的一个重要调控点。在不同的物种中,DFR的氨基酸序列在很多区域上有较高的同源性,但研究发现不同物种的DFR对3种二氢黄酮醇底物的偏爱性存在差异,最终植物呈现出不同的花色。例如大花蕙兰(Cymbidiumhybrids)和矮牵牛的DFR不能有效还原DHK,却能有效地催化DHQ和DHM,导致的结果就是,花瓣中积累矢车菊色素苷和飞燕草色素苷,却几乎不积累天竺葵色素苷[31~34]。既使是在FLS、F3′H和F3′5′H缺失的矮牵牛中也只能在花瓣中积累极少量的天竺葵色素苷。非洲菊(Gerberahybrida)DFR能够催化3种二氢黄酮醇,这种对底物的选择性机制解释了为什么矮牵牛中会缺少橙色的天竺葵色素[16,31~32]。关于DFR底物特异性的分子机理,Beld等根据比对玉米、矮牵牛和金鱼草DFR氨基酸序列,推测在DFR中一段13个氨基酸的区域可能负责DFR底物特异性,但没有实验数据证实这一推测[35]。后来,Johnson等发现在非洲菊DFR(GhDFR)中一个氨基酸的替换[第134位天冬酰胺(N)替换为非极性亮氨酸(L)的N134L突变型DFR]可以改变DFR底物特异性[32]。第134位天冬酰胺(N)位于一个由26个氨基酸构成的底物特异性区域[包含Beld等预测的13个氨基酸区域][32,35]。底物特异结合区内的氨基酸排列顺序决定了DFR对不同底物结合的特异性,在不同物种中这个氨基酸的序列也是高度保守的。大多数物种在DFR134位(对应于非洲菊DFR的氨基酸序列)是天冬酰胺(N)或天冬氨酸(D),在145位大多是谷氨酸(E)[32~33]。一些双子叶植物(非洲菊、玫瑰、金鱼草和康乃馨)和单子叶玉米能够以DHK为底物的,其DFR在134位和145位分别是天冬酰胺(N)和谷氨酸(E),而矮牵牛DFR在134位和145位分别是天冬氨酸(D)和谷氨酰胺(Q)[32]。Johnson等发现该底物特异选择结构域内的单个氨基酸的改变就能改变DFR底物特异性,在矮牵牛中,因为在底物特异选择结构域的134位是D,矮牵牛的DFR(PhDFR)就不能催化DHK生成天竺葵色素,而其它很多DFR第134位是N的则可以以DHK为底物[32],但作者未阐述将矮牵牛DFR134位的D替换为N对底物选择的影响。
将非洲菊DFR第134位天冬酰胺(N)替换为非极性亮氨酸(L),在转基因矮牵牛中,非洲菊N134L突变型DFR优先转化DHK而不是DHQ和DHM,这就表明非洲菊DFR第134位天冬酰胺(N)在底物特异性中起着重要的作用[32]。将非洲菊DFR第145位谷氨酸(E)替换为亮氨酸(L),E145L突变型DFR不能还原底物DHK[32]。因此,非洲菊DFR第134位和145位氨基酸(底物特异选择结构域)可直接影响底物特异性[32]。蒺藜苜蓿(Medicagotruncatula)MtDFR2在相应的134位是天冬氨酸(D),体外酶学分析表明能转化DHK,而MtDFR1在该位置是天冬酰胺(N),转化DHK的效率大大提高(MtDFR1对DHK的催化活性约为MtDFR2的2.5倍),进一步验证了该位置是N或D直接决定DFR是否能够转化DHK以及转化效率的强弱[36]。二者对DHM的催化活性都很低,对DHQ的催化活性接近,表明可能还有其它的底物结合位点影响MtDFR对底物的选择[36]。葡萄(Vitisvinifera)DFR的三维结构解析证实了由这26个氨基酸构成的底物特异性结合区的重要性[14],其中有一个特殊的133氨基酸位点(对应于非洲菊DFR的134位氨基酸)负责底物识别,但是它不能单独识别二氢黄酮醇B环羟基化[14]。草莓(Fragagariaxananasacv.elsanta)的DFR2蛋白133位氨基酸(对应于非洲菊DFR134位氨基酸)是天冬酰胺(N),而DFR1在此相应位是丙氨酸(A)[37]。体外酶学分析表明,草莓DFR1倾向于以DHK为底物,而DFR2可分别转换DHQ和DHM为无色矢车菊色素和无色飞燕草色素,但不能以DHK作为底物[37]。草莓DFR1蛋白133位氨基酸为非极性氨基酸(A),这与Johnson等发现的非洲菊N134L突变型DFR的结果是相同的[32]。但观察到的草莓DFR2底物特异性(草莓DFR2可还原DHQ和DHM,但不能以DHK作为底物)不能由野生型非洲菊GhDFR(GhDFR可还原DHK、DHQ和DHM三种二氢黄酮醇,是非特异性的DFR)134位是N(天冬酰胺)的存在所解释[32,37]。综上所述,植物DFR底物特异性并不都是仅仅由相应于非洲菊DFR第134位氨基酸所决定的。仅仅基于DFR氨基酸序列的功能推测可能是不适当的,而通过对大肠杆菌或酵母中表达的DFR基因产物进行的功能分析,尤其是在过量表达DFR基因的转基因植物中的功能分析对于鉴定DFR的功能以及DFR底物特异性是必需的。
3 DFR基因在植物基因工程中的应用
自然界存在一些重要花卉但色彩不全,如矮牵牛、大花蕙兰和鸢尾(Irisspp.)缺少橙色花,而菊花(Chrysanthemummorifolium)、玫瑰(Rosahybrida)和康乃馨(Dianthuscaryophyllus)缺少紫色和蓝色花[2~3,6,31~32,38],这些是用传统杂交育种方法无法解决的问题。在合成花青素苷的过程中,存在不同的酶竞争相同的底物(如FLS、F3′H、F3′5′H和DFR竞争底物DHK)以及同一个酶(如FLS、F3′H和DFR)催化不同的底物的情况(图2),在转基因植物中异源表达的DFR要与內源FLS、F3′H和F3′5′H竞争DHK,这也是影响最终花青素合成的要素。FLS和3个羟化酶活性的有无、强弱以及DFR的底物特异性选择是决定最终合成的花青素苷的种类和花色的主要因素[3,11,38~41]。目前,通过克隆DFR基因进行遗传转化的技术手段可以改变转基因植株的花色(表1)。
Hayashi等研究发现,DFR除了可以调节花色外,当增强其活性时,还可提高转基因水稻对氧化和细菌性病害引起的细胞死亡的耐受力[53]。烟草中过量表达茶树(Camelliasinensis)DFR基因提高了转基因烟草的类黄酮含量和抗氧化能力[54]。因此,应用DFR基因的基因工程对于改变植物花颜色和提高植物抗性和抗氧化物质等具有重要意义。
4 研究展望
虽然已克隆出多种植物的DFR基因并利用其进行遗传转化来改变转基因植物的花色,但决定DFR底物特异性的分子机制目前仍不十分清楚,克隆的编码具有DHK底物特异性的DFR基因也不多。最近的研究表明,鸢尾科的香雪兰(Freesiahybrida)中有8个编码DFR类似蛋白组成的基因簇。对其中的三个FhDFR基因通过对大肠杆菌中表达的DFR基因产物进行的功能分析以及应用拟南芥dfr(tt3-1)突变体的互补实验研究表明,FhDFR1,FhDFR2和FhDFR3能够利用DHM生成无色飞燕草色素,而FhDFR2还可以将DHQ转化为无色矢车菊色素,但FhDFR1,FhDFR2和FhDFR3不能以DHK作为底物[55]。FhDFR的这一底物特异性与香雪兰花瓣中积累的花青素苷种类(主要含有飞燕草色素苷和矢车菊色素苷,但不含有天竺葵色素衍生来的天竺葵色素苷)一致。我们课题组对橙花龙胆(GentianaluteaL. var.aurantiaca)花瓣的类黄酮组份分析研究表明,橙花龙胆橙色花瓣中只含有天竺葵色素苷,而不含有矢车菊色素苷和飞燕草色素苷[8]。因此,我们推测从橙花龙胆花瓣中克隆的DFR基因编码的DFR可能具有DHK底物特异性。目前许多改变植物花颜色的基因工程都应用FLS、F3′H和F3′5′H基因功能缺失突变体[30,42~43]作为转基因受体或应用多基因转化[39,44~45,48]技术在表达具有底物特异性的DFR基因的同时抑制内源FLS、F3′H和F3′5′H基因的表达。然而,许多重要园艺植物很难获得像模式植物矮牵牛那样的FLS、F3′H和F3′5′H基因功能缺失突变体,因此,克隆具有不同底物特异性的DFR基因,尤其是克隆到具有DHK底物特异性的DFR基因在改变植物花颜色的基因工程中具有重要的意义。随着研究的日渐深入,克隆的编码具有不同底物特异性的DFR基因将逐渐增多,这将有助于揭示DFR底物特异性的分子机制以及拓宽应用DFR基因在植物基因工程中的应用。

表1 应用二氢黄酮醇4-还原酶(DFR)基因遗传转化获得的改变植物花颜色的植物物种Table 1 List of plant varieties with flower modification created by expression of dihydroflavonol 4-reductase(DFR) genes

