转BpCUCt白桦生长特征及内源IAA含量的变化
陈 晨 邢宝月 边秀艳 许思佳 刘桂丰 姜 静
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
CUC基因,也叫做CUP-SHAPEDCOTYLEDON,属于植物特异NAC超家族转录因子(Transcription factors),在植物的顶端分生组织(shoot apical meristem,SAM)起始与维持、器官边界形成等多方面发挥重要的作用[1~2],还能够影响侧枝发育[3~4]。在拟南芥(Arabidopsisthaliana)中,共发现3个AtCUC基因,分别为AtCUC1、AtCUC2、AtCUC3。AtCUC1和AtCUC2在不同的芽器官原基及子叶的边界处表达,双突变体cuc1/cuc2导致子叶边界的异位组织生长、器官的融合,以及顶端分生组织SAM的缺失和杯状子叶的产生[1,5~7],cuc2/cuc3双突变体在胚珠分离方面有缺陷[8~9],另外,AtCUC3受到AtCUC1和AtCUC2的调控[10]。据报道,AtCUC1和AtCUC2的表达也受到生长素信号途径基因、KNOX的调控[11~13]。Rossmann等[14]等在番茄中发现,LeCUC基因对番茄(LycopersiconesculentumMiller)小叶腋芽的形成至关重要。Bilsborough等[15]在拟南芥中发现,过表达AtCUC2基因使叶片边缘锯齿加剧,AtPIN1基因与AtCUC2基因相互作用,协同影响生长素在叶缘位置的浓度梯度,从而形成多样的叶边缘形态。
本研究团队采用Illumina技术开展了欧洲白桦(Betulapendula)及其变种裂叶桦(B.pendula‘Dalecarlica’)的转录组分析,测序结果显示,有8 767个unigene上调表达、8 379个unigene下调表达,并在生长素的运输及作用途径发生了明显变化[16]。其中,裂叶桦的BpCUC2、BpPINs基因呈现上调表达,同时也发现一条具有廻文结构的BpCUC2基因(命名为BpCUCt),拟南芥AtCUC2是植物NAC超家族转录因子之一,在生长素极性运输过程中,AtCUC2可以促进AtPIN的极性定位。正是由于AtPIN、生长素和AtCUC2三者的协同作用,保证了植物叶缘不同部位生长素浓度的差异,从而使叶缘产生缺刻[15,17]。为了明确BpCUCt的功能,本实验分别构建了BpCUC2启动子及35S启动子驱动的BpCUCt载体,以白桦合子胚为受体开展转基因研究,观察转基因株系表型变化,并测定转基因株系的内源激素IAA含量,进而揭示BpCUCt的分子功能。
1 材料与方法
1.1 材料
本研究的转基因受体为白桦种子,采自东北林业大学白桦种子强化园。
1.2 方法
1.2.1 白桦BpCUCt序列分析
利用BioEdit和DNAMAN软件对白桦BpCUCt和白桦BpCUC2基因进行序列比对,同时利用NCBI网站的Conserved domain(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测BpCUCt基因的保守结构域。
1.2.2 白桦BpCUCt基因克隆
根据转录组测序得到的白桦BpCUCt序列,由金唯智生物试剂公司合成该基因。以合成的BpCUCt序列为模板,进行重叠延伸PCR扩增,由于其特殊的发夹结构分别设计两对引物进行拼接,并分别在第一对引物的上游和第二对引物的下游添加保护碱基和酶切位点,引物序列见表1。其反应体系如下:10×Pfu Buffer 2 μL,dNTPs(25 mmol·L-1)1.6 μL,模板2 μL,上下游引物(10 μmol·L-1)各1 μL,Pfu DNA聚合酶1 U,无菌水补齐至20 μL。PCR扩增程序如下:94℃预变性4 min;94℃变性45 s,58℃退火45 s,72℃延伸2 min,35个循环;72℃延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳检测。
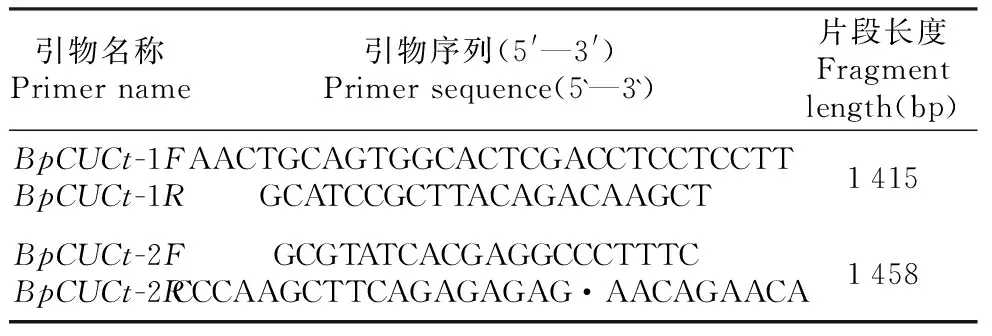
表1 白桦BpCUCt基因重叠延伸PCR扩增引物Table 1 Overlap extension PCR primer sequence of BpCUCt
1.2.3 35S::BpCUCt载体构建
分别以上述PCR产物和pROKII载体质粒为模板,利用限制性内切酶PstⅠ和HindⅢ进行双酶切,酶切反应体系参考徐焕文[2]。酶切产物胶回收后利用T4DNA ligase连接,连接反应体系参考黄海娇等[18],将连接产物热击转入大肠杆菌Trans5α感受态[19],卡那霉素筛选后,挑单菌落进行PCR检测,并将质粒送至生物试剂公司测序,重组质粒命名为35S::BpCUCt(图1:A),再利用三亲交配法[20]将该质粒转入农杆菌获得EHA105(35S::BpCUCt)工程菌。
1.2.4 ProCUC2::BpCUCt载体构建
以白桦DNA为模板,PCR扩增BpCUC2基因启动子序列,反应体系及引物序列参考刘超逸,并在引物序列的5、端加上保护碱基和酶切位点,酶切位点为HindⅢ和XbaⅠ,引物序列见表2。分别以重组质粒35S::BpCUCt和BpCUC2启动子PCR产物为模板,利用HindⅢ和XbaⅠ进行双酶切,酶切产物胶回收及连接同上,获得重组质粒命名为ProCUC2::BpCUCt(图1:B),进而转入农杆菌获得EHA105(ProCUC2::BpCUCt)工程菌。
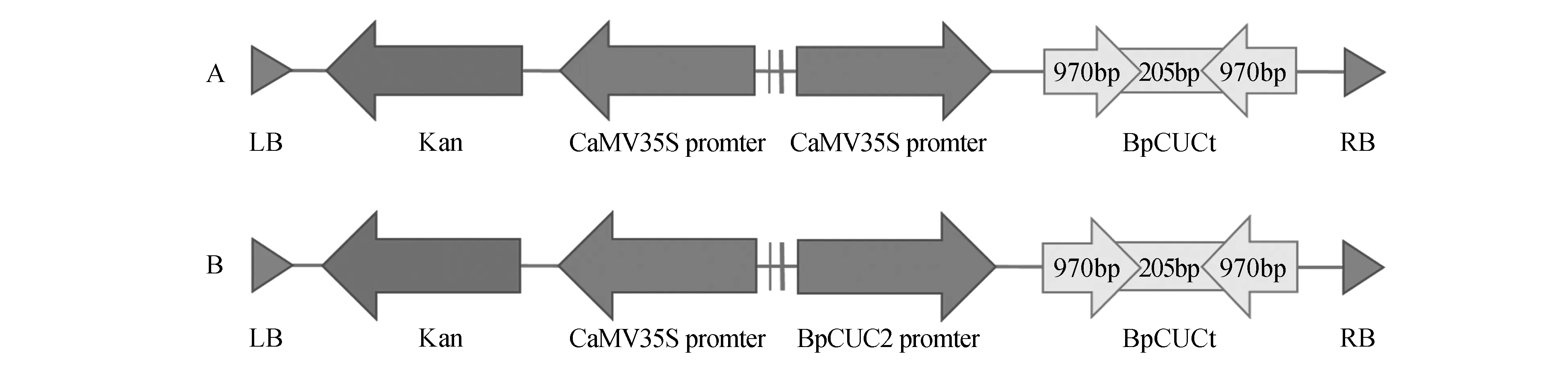
图1 载体构建示意图 A. 35S::BpCUCt载体构建;B. ProCUC2::BpCUCt载体构建Fig.1 Diagram of the vector A. Diagram of the 35S::BpCUCt vector;B. Diagram of the ProCUC2::BpCUCt vector
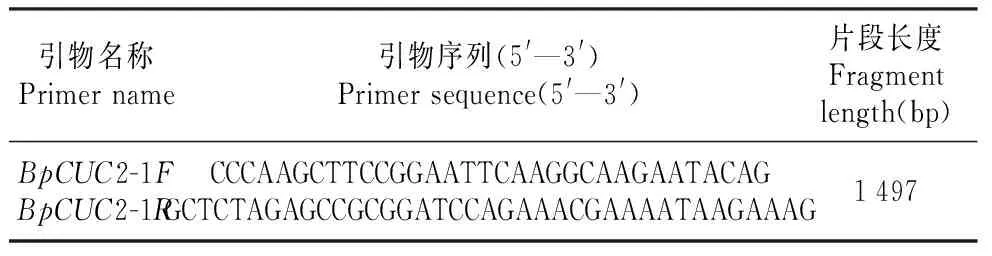
表2 白桦BpCUC2基因启动子序列扩增引物Table 2 PCR primer sequence of BpCUC2 promoter
1.2.5 白桦的遗传转化
采用农杆菌介导的白桦合子胚法进行遗传转化,在80 mg·L-1的kan抗生素筛选条件下,分别获得2个35S::BpCUCt和4个ProCUC2::BpCUCt抗性愈伤组织,再分别将抗性愈伤组织接种至WPM+0.02 mg·L-1NAA+0.8 mg·L-16-BA+0.5 mg·L-1GA3+80 mg·L-1kan+200 mg·L-1头孢霉素培养基上诱导不定芽,进而获得丛生继代苗,WPM+0.4 mg·L-1IBA的固体培养基进行生根培养,20 d后,按照组培微繁技术[21]移入温室继续培养。
1.2.6 转基因白桦的PCR检测
分别以转基因白桦及对照白桦从顶端数起第3片叶为材料,提取DNA并PCR扩增白桦BpCUCt基因片段,引物序列见表1,反应体系及扩增程序同1.2.1。将获得的PCR产物于1.0%的琼脂糖凝胶检测。
1.2.7 转基因白桦的qRT-PCR检测
分别以转基因白桦及对照白桦从顶端数起第3片叶为材料,提取总RNA并进行qRT-PCR,引物序列见表3。反应体系和程序根据黄海娇等[17]方法,进行BpCUCt基因的qRT-PCR,根据公式XN=2-ΔΔCt计算外源基因的相对表达量。
1.2.8 转基因白桦叶片形态调查
2017年8月15日,选取2年生转基因白桦及对照从顶端数起第4片功能叶,使用扫描仪CanoScan LiDE 210对叶片进行扫描,Image J软件测量叶片的长、宽及叶面积,测量方法参考渠畅[16]。利用SPSS21进行F检验统计学分析。
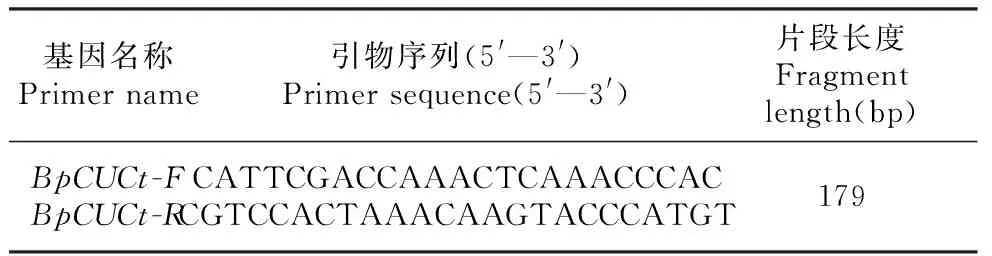
表3 荧光实时定量PCR扩增引物序列Table 3 Primer sequence of the quantitative real-time PCR assay
1.2.9 转基因白桦苗高生长特性
2017年5月初~9月初,每隔15天测量2年生转基因白桦及对照的苗高,获得数据后,采用excel 2010作图。
1.2.10 内源激素IAA测定
分别以转基因白桦及对照白桦从顶端数起第4片叶为材料,将所有材料均分成左叶(L)、叶脉(M)、右叶(R)三组分,其中pc-4株系叶片表型特殊,叶片出现左叶与右叶叶面积大小不对等,故将其左叶>右叶设置为pc-4A组,右叶>左叶设置为pc-4B组,见图9(A、B)。植物激素提取方法参考姜晶[22],并采用酶联免疫吸附测定法进行内源激素IAA测定[23]。
2 结果与分析
2.1 白桦BpCUCt序列分析
利用BioEdit软件进行BpCUCt和BpCUC2基因序列比对发现,二者具有相同的1 238 bp碱基片段,相似度达到了98.3%。利用NCBI网站的Conserved domain工具预测BpCUCt基因的保守结构域,发现该基因在170~538 bp含有NAC超家族所特有的NAM(No apical meristem)结构域(图2),其为典型的植物生长发育相关蛋白[24]。

图2 BpCUCt的蛋白保守结构域Fig.2 Conserved domains on BpCUCt

图3 白桦BpCUCt基因克隆 A.白桦BpCUCt-1序列片段克隆(M. DL2000 Marker(2 000,1 000,750,500,250,100 bp);1-6.BpCUCt-1基因片段;7.水对照);B. 白桦BpCUCt-2序列片段克隆(M. DL2000 Marker;1.水对照;2~3.BpCUCt-2基因片段);C.白桦BpCUCt序列全长克隆(M. DL2000Marker;1.水对照;2.白桦BpCUCt基因片段)Fig.3 BpCUCt gene clone A. BpCUCt-1 gene fragment clone(M. DL2000 Marker(2 000,1 000,750,500,250,100bp);1-6.BpCUCt-1 gene fragment; 7.Water control);B. BpCUCt-2 gene fragment clone(M. DL2000 Marker; 1.Water control; 2-3.BpCUCt-2 gene fragment);C. BpCUCt gene clone(M. DL2000 Marker; 1.Water control; 2.BpCUCt gene)
2.2 白桦BpCUCt基因克隆
以合成的BpCUCt序列为模板,进行重叠延伸PCR扩增,即分别设计两对引物扩增,最终对两段序列片段进行拼接。结果(图3)表明,该扩增片段大小与目的条带一致,说明该基因克隆成功。
2.3 转基因载体的获得
2.3.1 35S启动子驱动的BpCUCt载体获得
以合成的白桦BpCUCt基因为模板,利用设计的带有PstⅠ、HindⅢ酶切位点的特异性引物PCR扩增该序列,分别双酶切pROKII载体质粒及扩增序列,经T4连接酶连接,在50 mg·L-1卡那霉素抗性平板上筛选阳性重组质粒,对阳性质粒35S::BpCUCt测序后,通过BioEdit比对,确定获得了35S启动子驱动的BpCUCt植物表达载体(图4:A)。
2.3.2BpCUC2基因启动子驱动的BpCUCt载体获得
在获得35S::BpCUCt载体基础上,利用设计的带有HindⅢ和XbaⅠ酶切位点的特异性引物PCR扩增BpCUC2基因启动子序列,采用HindⅢ和XbaⅠ酶切35S::BpCUCt载体,胶回收带有BpCUCt及载体片段,同时将扩增序列也用PstⅠ、HindⅢ双酶切,酶切产物经T4连接酶连接,在50 mg·L-1卡那霉素抗性平板上筛选阳性重组质粒,PCR检测后确认获得ProCUC2::BpCUCt植物表达载体构建(图4:B)。
2.4 转基因白桦的获得
分别用EHA105(35S::BpCUCt)和EHA105(ProCUC2::BpCUCt)工程菌侵染白桦成熟种子,经菌液PCR鉴定后(图5),进行共培养(WPM+0.8 mg·L-16-BA+0.02 mg·L-1NAA),在选择培养基上(WPM+2.0 mg·L-16-BA+0.2 mg·L-1NAA+80 mg·L-1卡那霉素+200 mg·L-1头孢霉素)进行筛选培养,20~30 d后合子胚伤口处陆续出现抗性愈伤组织,将其切下更换分化培养基(WPM+0.8 mg·L-16-BA+0.02 mg·L-1NAA+0.5 mg·L-1GA3)继续培养20 d左右即可获得抗性不定芽,挑取生长状态良好的不定芽单株剪切移入生根培养基(WPM+0.4 mg·L-1IBA)中进行生根培养。本实验共计获得2个35S::BpCUCt转基因白桦株系,分别将其命名为35S-1、35S-2,同时获得4个ProCUC2::BpCUCt转基因白桦,分别将其命名为pc-1、pc-2、pc-3、pc-4,35S::BpCUCt和ProCUC2::BpCUCt转基因获得过程分别如图6~7。
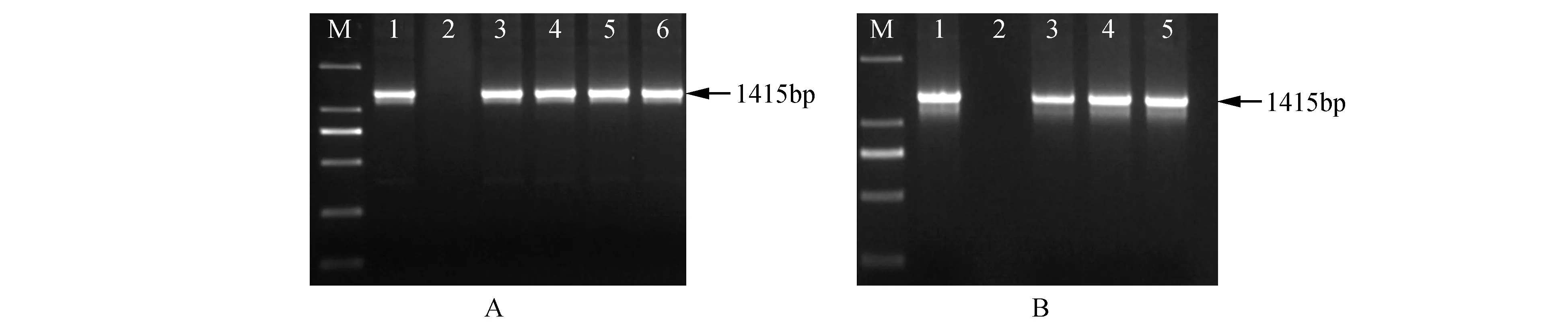
图4 BpCUCt载体构建PCR检测电泳图谱 A.35S::BpCUCt载体构建PCR检测图(M. DL2000 Marker(2 000,1 000,750,500,250,100 bp);1.阳性对照;2.水对照;3~6. 35S::BpCUCt重组质粒);B.ProCUC2::BpCUCt载体构建PCR检测图(M. DL2000 Marker;1.阳性对照;2.水对照;3~5. ProCUC2::BpCUCt重组质粒Fig.4 PCR electrophoretic patterns of vector construction of BpCUCt A.Vector Construction of 35S::BpCUCt(M. DL2000 Marker(2 000,1 000,750,500,250,100 bp);1.Positive control;2.Water control;3-6.Recombinant plasmid of 35S::BpCUCt); B.Vector Construction of ProCUC2::BpCUCt (M. DL2000 Marker;1.Positive control;2.Water control;3-5.Recombinant plasmid of ProCUC2::BpCUCt)

图5 BpCUCt农杆菌菌液PCR检测 A.EHA105(35S::BpCUCt)PCR电泳检测图(M. DL2000 Marker(2 000,1 000,750,500,250,100 bp);1. 35S::BpCUCt质粒;2.水对照;3~4. 35S::BpCUCt农杆菌菌液);B. EHA105(ProCUC2::BpCUCt)PCR检测图(M. DL2000 Marker;1.ProCUC2::BpCUCt质粒;2.水对照; 3~5.ProCUC2::BpCUCt农杆菌菌液)Fig.5 Agrobacterium identification of recombinant plasmid of BpCUCt by PCR A. PCR Electrophoretic Patterns of EHA105(35S::BpCUCt)(M. DL2000 Marker(2 000,1 000,750,500,250,100 bp);1.Recombinant plasmid of 35S::BpCUCt;2.Water control;3-4.Agrobacterium of 35S::BpCUCt);B.PCR Electrophoretic Patterns of EHA105(ProCUC2::BpCUCt)(M. DL2000 Marker;1. ecombinant plasmid of ProCUC2::BpCUCt;2.Water control;3-5.Agrobacterium of ProCUC2::BpCUCt)

图6 转35S::BpCUCt白桦株系的获得 A.含有35S::BpCUCt农杆菌侵染白桦种子;B~C.抗性愈伤组织;D.抗性继代苗;E.组培生根苗;F.移栽苗Fig.6 Regeneration of 35S::BpCUCt transgenic lines A.Agrobacterium of 35S::BpCUCt infected white birch seeds;B-C.Resistant callus;D.Resistance propagation seedlings;E.Rooted seedlings;F.Transplant seedlings
图7 转ProCUC2::BpCUCt白桦株系的获得 A.含有ProCUC2::BpCUCt农杆菌侵染白桦种子;B~C.抗性愈伤组织;D.抗性继代苗;E.组培生根苗;F.移栽苗Fig.7 Regeneration of ProCUC2::BpCUCt transgenic lines A.Agrobacterium of ProCUC2::BpCUCt infected white birch seeds;B-C.Resistant callus;D.Resistance propagation seedlings;E.Rooted seedlings;F.Transplant seedlings
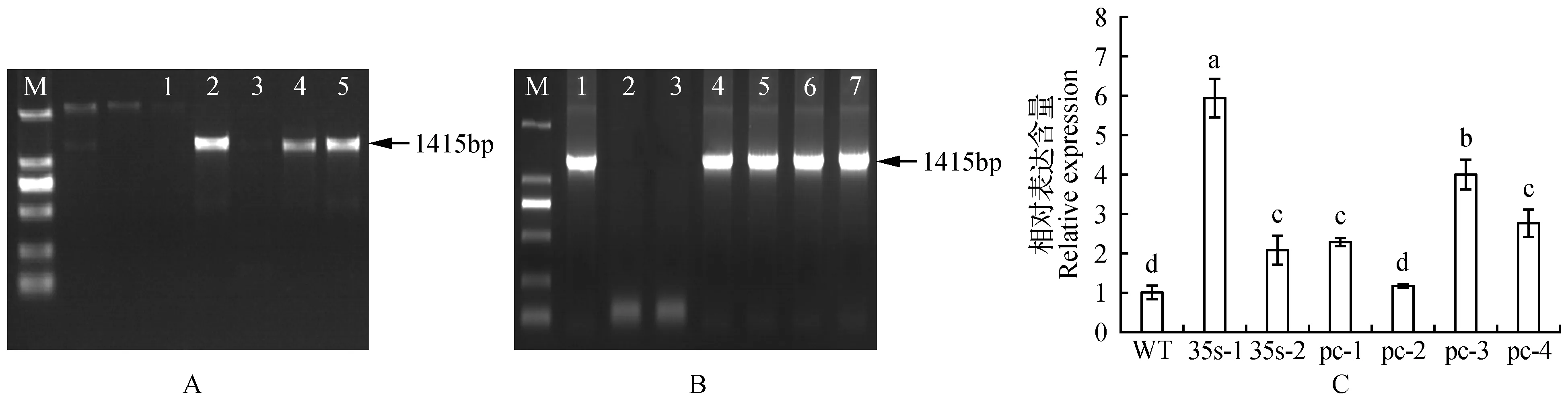
图8 白桦转基因株系PCR检测电泳图谱及荧光定量检测 A.转35S::BpCUCt白桦株系PCR检测(M.DL2000 DNA Marker(2 000,1 000,750,500,250,100 bp);1.阴性对照;2.阳性对照;3.WT;4~5.目的基因);B.转ProCUC2::BpCUCt白桦株系PCR检测(M.DL2 000 DNA Marker (2 000,1 000,750,500,250,100 bp);1.阳性对照;2.阴性对照;3.WT;4~7.目的基因);C.转基因白桦实时荧光定量RT-PCRFig.8 35S::BpCUCt gene transgenic birch PCR detection and qRT-PCR detection A. 35S::BpCUCt gene transgenic birch PCR detection(M.DL2000Marker(2 000,1 000,750,500,250,100 bp); 1.Plasmid control; 2.Negative control; 3.Water control; 4-5.Transgenic lines);B. 35S::BpCUCt gene transgenic birch PCR detection(M. DL2000Marker; 1.Plasmid control;2-3.Negative control;3.Water control;4-7.Transgenic lines);C.Expression analysis determined by qRT-PCR in BpCUCt transgenic lines
2.5 转基因株系的PCR和实时荧光定量RT-PCR检测
分别以转基因白桦35s-1、35s-2、pc-1、pc-2、pc-3、pc-4及对照白桦从顶端数起第3片叶为材料,提取总DNA,进行PCR检测,结果显示,转基因株系及阳性质粒在1 206 bp处均有明显的扩增条带,而水对照和WT均未见扩增谱带(图8:A~B),初步证明BpCUCt基因已经成功转入野生型白桦。
分别从顶端数起第3片叶提取上述转基因株系及对照白桦总RNA,利用实时荧光定量PCR检测白桦BpCUCt基因的表达量(图8:C),除pc-2株系外,相对WT株系其他5个转基因株系的白桦BpCUCt表达量均显著上调,尤其是35s-1株系,相对表达量是WT株系5.74倍。
2.6 转基因白桦叶片形态的改变
对获得的转基因白桦观察发现,在叶片形态及大小等性状均与WT株系明显不同,2个转基因株系的叶片均呈现左右叶片不对称状态(图9:A~B),35s-1、35s-2等2个转基因株系的叶长、叶宽以及叶面积等性状均显著大于WT,例如:35s-2株系的叶面积是WT的2倍。
pc-1、pc-2、pc-3、pc-4等4个转基因株系在叶片大小方面与WT差异不显著(图9:G~I),但在叶片形态方面变化较大。叶片边缘齿裂较WT浅,叶片左右呈现明显不对称,叶基部向叶柄位置凸出(图9:D),并且pc-4转基因株系具有多个SAM组织,主干与侧枝相融合,无明显区分(图9:F)。
CUC2是植物的生长负调控因子,能够抑制细胞分裂,减缓植物的生长,并且CUC2作用于植物多个部位,参与叶缘缺刻、锯齿形成及SAM的形态建成等多个生长发育过,而上述结果恰好说明BpCUCt转基因植株产生了与BpCUC2过表达植株相似的表型,继而二者具有相似的功能。
2.7 转基因白桦苗高生长特性
将获得的转基因白桦及野生型对照于2016年扩繁后移栽至温室,2017年早春开始调查苗高生长情况,结果显示,2个35S启动子驱动的BpCUCt转基因白桦35s-1,35s-2在生长初期与WT并没有表现出明显的差异,进入8月后,苗高生长渐渐减缓,到了9月转基因株系苗高均低于WT株系,其中35s-1株系显著低于WT株系,此时苗高仅为WT的19.41%。
对4个BpCUC2启动子驱动的BpCUCt转基因白桦观察发现,移栽当年的转基因苗木就表现出明显的矮化现象,2个转基因株系苗高均显著低于WT(P<0.01),为WT的69%,翌年5月开始每15 d调查参试株系的生长情况,结果发现,WT株系一直生长最快,尤其是pc-4株系苗高明显矮化,生长也缓慢,到了9月其苗高不仅显著低于WT,也显著低于其他3个转基因株系,此时的苗高低于WT的77%,低于3个转基因株系均值的71%。
2.8 转基因白桦节间距的变化
通过上述测量我们发现转基因白桦苗高产生了变化,因此继而对照白桦的节间距进行了统计,结果如图11所示:WT多数节间距在16~50 cm,而转35S::BpCUCtt和Pr-CUC2::BpCUCt白桦的节间距多数落在40~60 cm,表明转35S::BpCUCt白桦的节间距变长;而P3白桦的节间距多数在6~10 cm,说明P3植株节间距变短,并且转基因株系的侧枝要显著少于WT。上述测量结果表明BpCUCt在影响植物纵向生长的同时,也导致节间距不同程度的改变,影响了侧枝的生长。
2.8 转基因白桦内源IAA含量测定
由于CUC2基因在生长素极性运输过程中起着至关重要的作用,为了弄清转基因白桦叶片左右不对称的原因,实验分别测定叶脉、位于叶脉左侧叶片及叶脉右侧叶片等3部分组织的IAA含量,其中pc-4叶片由于其左右叶片不对称生长,出现两种差异的叶片,左侧叶片明显大于右侧叶片或右侧叶片大于左侧叶片(图12:A~B),因此将其按照左右叶面积大小不同分成A、B两组。左侧叶片IAA含量分析发现:转基因株系(除pc-2外)IAA含量均显著高于WT株系,其中pc-4 A最高,是WT的28.41倍,其他转基因株系间差异不显著;右侧叶片IAA含量分析发现:转基因株系(pc-1株系除外)IAA含量显著高于WT(P<0.01),其中pc-4B的IAA含量最高,是WT的4.74倍,是pc-4 A的2.57倍;叶脉IAA含量分析发现:IAA含量均值为372.39 ng·g-1,高于叶片部位的含量,是叶片含量的3.7倍,转基因株系间的IAA含量差异不显著,只有pc-4的两组叶脉含量显著高于WT及其他转基因株系,分别是WT的1.79和3.0倍。由此初步可见,BpCUCt基因能够影响生长素含量的分布。
3 讨论
现有的CUC2基因的研究多局限于拟南芥、水稻等模式植物中,主要在不同组织器官的形态建成及边界确定中发挥重要的作用,然而有关白桦BpCUC2同源基因功能的报道还比较少。本实验从白桦转录组中发现BpCUC2基因的突变基因将其命名为BpCUCt,构建了35S::BpCUCt和ProCUC2::BpCUCt植物表达载体,获得转基因白桦株系。对其转基因株系进行表型观察和分析发现:转白桦BpCUCt基因植株出现了与BpCUC2超表达株系相似的表型[2]植株矮化、生长缓慢、节间距不规则,侧枝与主干出现不同程度的融合,并且ProCUC2::BpCUCt转基因植株叶缘变平滑、左右叶大小不对称等性状,而35S::BpCUCt转基因株系叶边缘与野生型并无明显区别,说明特异性启动子ProCUC2比35S启动子在叶缘形态发育中的作用更强,这与BpCUC2启动子的研究结果一致[24~26]。该基因主要在顶端分生组织、器官的形态建成及边界确定等多个方面影响植株的生长发育。

图9 转BpCUCt基因植株叶形态特征观察 A.35S::BpCUCt转基因株系表型观察;B.ProCUC2::BpCUCt转基因株系表型观察;C~D.转基因株系pc-4叶缘和SAM发生改变;E~F.转基因株系pc-4主干和侧枝融合;G~H.转基因株系叶长、叶宽、叶面积的测量Fig.9 Leaf morphological characters in BpCUCt transgenic lines A. Phenotype of 35S::BpCUCt transgenic lines; B. Phenotype of ProCUC2::BpCUCt transgenic lines; C-D.Varied leaf margin and SAM of transgenic lines; E-F. Fusion of the main stem and lateral branches in transgenic line pc-4; G-H. Leaf length,leaf width,leaf area of transgenic lines and wild type

图10 转基因白桦苗高生长比较 A.转基因株系及对照;B.35S::BpCUCt转基因株系苗高测量;C.ProCUC2::BpCUCt转基因株系苗高测量Fig.10 Height of BpCUCt transgenic lines A.Transgenic lines and wild type; B.Height of 35S::BpCUCt transgenic lines; C.Height of ProCUC2::BpCUCt transgenic lines
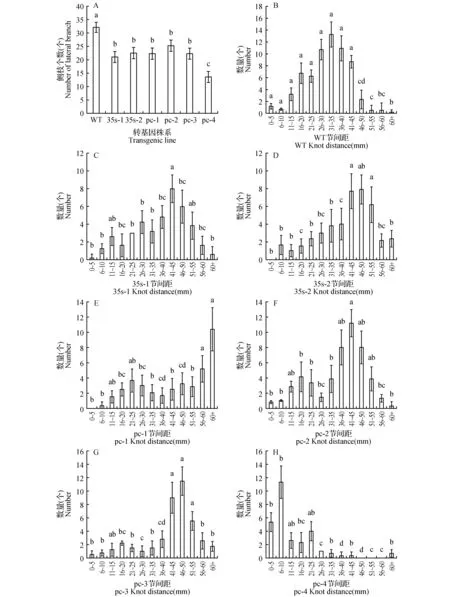
图11 转基因白桦苗节间距比较及侧枝个数 A.转基因株系及WT侧枝情况;B.野生型白桦节间距长度统计;C~D.35S::BpCUCt株系节间距长度统计;E~H. ProCUC2::BpCUCt株系节间距长度统计 转基因株系及WT同一节间距区间的方差分析及显著性Fig.11 Knot distances and the lateral branch number of transgenic lines and wild type A.The lateral branch number of transgenic lines and wild type; B.Knot distances of wild type; C-D.Knot distances of 35S::BpCUCt transgenic lines; E-F.Knot distances of ProCUC2::BpCUCt transgenic lines Variance analysis and significance of the same knot distance interval in transgenic lines and WT
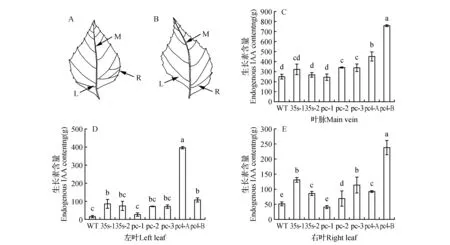
图12 转白桦BpCUCt基因IAA含量测定 A. pc-4A组叶;B. pc-4B组叶片(其中L为左叶,R为右叶,M为叶脉);C.转基因株系左叶生长素含量;D.转基因株系右叶生长素含量;E.转基因株系叶脉生长素含量Fig.12 Endogenous IAA content of BpCUCt transgenic lines A.Diagram of the leaf pc-4A; B.Diagram of the leaf pc-4B(there into,L represents the left leaf,R represents the right leaf,M represents the main vein); C.Endogenous IAA content of the left leaf; D.Endogenous IAA content of the right leaf; E.Endogenous IAA content of the main vein
Bilsborough等[14]在拟南芥中发现,抑制表达AtCUC2基因使叶缘锯齿变浅,而锯齿的产生,正是由于AtPIN1基因与AtCUC2基因的相互作用,协同影响生长素在叶缘位置的浓度梯度,从而形成多样的叶边缘形态。前人研究发现,生长素能够调控植物器官的构建,通过极性运输的方式控制其在不同组织部位的含量[27~28]。测量转基因白桦和WT左叶(L)、右叶(R)及叶脉(M)的内源激素IAA含量发现,转基因株系(除pc-2外)左侧叶片IAA含量均显著高于WT株系;转基因株系(pc-1株系除外)右侧叶片IAA含量显著高于WT;叶脉的形成对叶片的发育有直接的关系,支撑叶片的同时为叶片运输营养物质,叶脉也决定了植物株型的生长[29~30]。转基因株系(pc-1株系除外)叶脉IAA含量均高于WT株系。说明过表达BpCUCt转基因白桦造成叶片内源激素含量发生改变,BpCUC2启动子在白桦的不用组织部位对生长素有不同的响应,证实该基因可能参与了激素的生物合成或信号传导途径[27],上述结果可能也是转白桦BpCUCt基因植株出现了与BpCUC2超表达株系相似的表型的原因。生长素信号通路由多种合成、应答、运输基因共同协作完成,而BpCUC2基因是否与上述基因相互作用,还需要进一步的研究。

