重组干扰素α-2b治疗传染性单核细胞增多症疗效观察
汤 磊
(重庆市巴南区人民医院儿科,重庆 401320)
传染性单核细胞增多症(infectious mononucleosis,IM)是一种单核-巨噬细胞系统急性增生性传染病,主要由Epstein-Barr病毒(Epstein-Barr virus,EBV)感染所致,少数可由巨细胞病毒、弓形虫、腺病毒、肝炎病毒、人类免疫缺陷病毒等感染引起[1-2]。IM多发于学龄期儿童,具有很强的传染性,严重影响患儿的身体健康。抗生素治疗IM无效,一般抗病毒药物治疗效果差,而干扰素治疗IM有较好的效果[3-4]。本研究旨在探讨重组干扰素α-2b治疗IM的临床效果。
1 资料与方法
1.1一般资料选择2013年11月至2017年6月重庆市巴南区人民医院儿科收治的IM患儿174例,均符合IM诊断标准[5]。根据治疗方法将患儿分为观察组和对照组,每组87例。对照组:男48例,女39例;年龄1~12(6.21±2.59)岁(1~3岁33例,4~8岁37例,9~12岁17例);病程1 d至2个月,平均(31.24±4.17)d。观察组:男46例,女41例;年龄1~12(6.35±2.44)岁(1~3岁30例,4~8岁39例,9~12岁18例);病程1 d至2个月,平均(31.31±4.20)d。2组患儿的性别、年龄、病程比较差异均无统计学意义(P>0.05),具有可比性。本研究经过医院伦理委员会批准,患儿监护人均签订知情同意书。
1.2治疗方法2组患儿均给予常规对症治疗,包括退热、保肝、营养心肌等治疗。在对症治疗基础上,对照组患儿给予更昔洛韦(福安药业集团庆余堂制药有限公司,国药准字H20050578)5 mg·kg-1,静脉滴注,每日2次,连续治疗7 d。观察组患儿在对照组治疗基础上给予重组干扰素α-2b (爱尔兰SP公司,进口药品注册证号:S20090002)100万U,加入到2 mL生理盐水中雾化吸入,每次持续15 min,每日2次,连续治疗7 d。
1.3观察指标
1.3.1外周血T淋巴细胞亚群检测分别于治疗前和治疗后抽取患儿清晨空腹静脉血5 mL,置于乙二胺四乙酸抗凝管中,1 000 r·min-1离心5 min,取上清液。采用流式细胞术检测2组患儿外周血T淋巴细胞亚群分布,试剂盒购自重庆中元生物技术有限公司,严格按照试剂盒说明书进行操作。
1.3.2心肌酶谱检测分别于治疗前和治疗后抽取患儿清晨空腹静脉血5 mL,1 000 r·min-1离心5 min,取上清液。应用贝克曼库尔特AU480型全自动生物化学分析仪检测2组患儿心肌酶谱,血清乳酸脱氢酶(lactate dehydrogenase,LDH)、天门冬氨酸转氨酶(aspartate transarninase,AST)、肌酸激酶(creatine kinase,CK)及肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB)水平检测采用速率法,试剂盒购自重庆中元生物技术有限公司,严格按照试剂盒说明书进行操作。
1.3.3EBV-DNA阳性率分别于治疗前和治疗后,抽取患儿清晨空腹静脉血5 mL,采用荧光定量聚合酶链反应检测EBV-DNA水平,严格按照试剂盒说明书进行操作。通过试剂盒自带标准品建立定值标准曲线,根据标准曲线计算样品浓度;标本荧光强度曲线达到阈值时所需循环数(cycle threshold,Ct)≤39为阳性,Ct>40为阴性,计算EBV-DNA阳性率。
1.3.4临床疗效2组患儿治疗后进行疗效判定,判定标准参照文献[6]。显效:治疗3 d内患儿体温降至37 ℃,肝、脾、淋巴结大缩小1/2;有效:治疗 5 d 内患儿体温降至37 ℃,肝、脾、淋巴结大缩小1/3以上;无效:治疗5 d以上体温仍高于37 ℃,肝、脾、淋巴结大缩小不明显。总有效率=显效率+有效率。
1.3.5不良反应观察2组患儿不良反应发生情况。

2 结果
2.12组患儿外周血T淋巴细胞亚群水平比较结果见表1。2组患儿治疗前CD3+、CD4+、CD8+及CD4+/CD8+水平比较差异均无统计学意义(P>0.05)。2组患儿治疗后CD3+和CD8+水平显著低于治疗前,CD4+水平和CD4+/CD8+显著高于治疗前,差异均有统计学意义(P<0.05)。治疗后,观察组患儿CD3+和CD8+水平显著低于对照组,CD4+水平和CD4+/CD8+显著高于对照组,差异均有统计学意义(P<0.05)。
表12组IM患儿外周血T淋巴细胞亚群水平比较

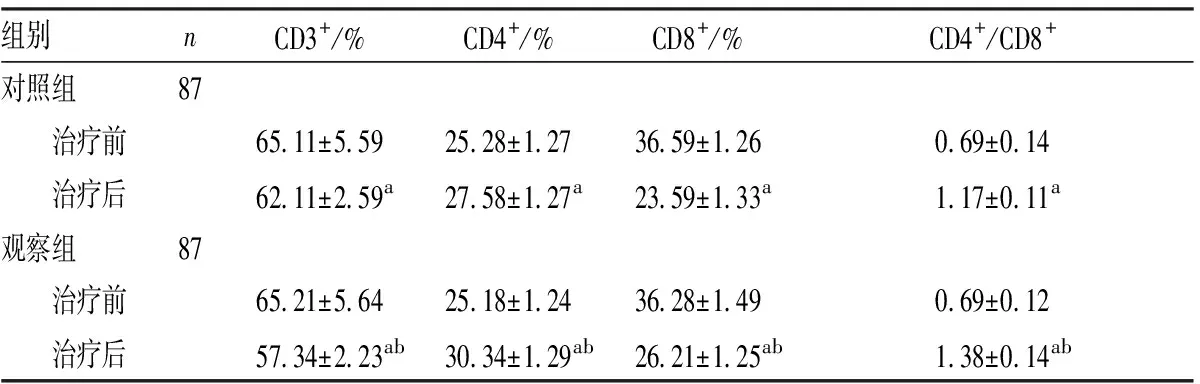
组别nCD3+/%CD4+/%CD8+/%CD4+/CD8+对照组87 治疗前65.11±5.5925.28±1.2736.59±1.260.69±0.14 治疗后62.11±2.59a27.58±1.27a23.59±1.33a1.17±0.11a观察组87 治疗前65.21±5.6425.18±1.2436.28±1.490.69±0.12 治疗后57.34±2.23ab30.34±1.29ab26.21±1.25ab1.38±0.14ab
注:与治疗前比较aP<0.05;与对照组比较bP<0.05。
2.22组患儿心肌酶谱改变比较结果见表2。2组患儿治疗前血清AST、LDH、CK及CK-MB水平比较差异均无统计学意义(P>0.05)。2组患儿治疗后血清AST、LDH、CK及CK-MB水平显著低于治疗前,差异均有统计学意义(P<0.05)。治疗后观察组患儿血清AST、LDH、CK及CK-MB水平显著低于对照组,差异均有统计学意义(P<0.05)。
表22组IM患儿血清AST、LDH、CK及CK-MB水平比较

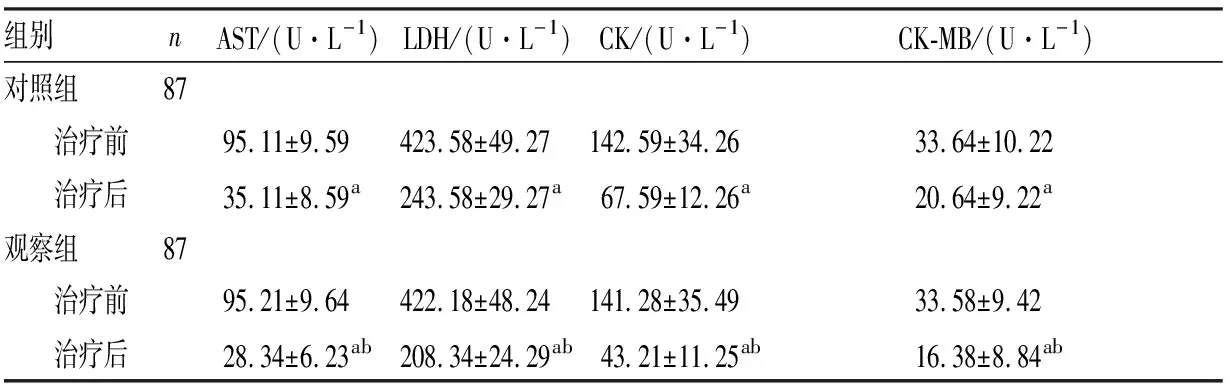
组别nAST/(U·L-1)LDH/(U·L-1)CK/(U·L-1)CK-MB/(U·L-1)对照组87 治疗前95.11±9.59 423.58±49.27 142.59±34.26 33.64±10.22 治疗后35.11±8.59a243.58±29.27a67.59±12.26a20.64±9.22a观察组87 治疗前95.21±9.64422.18±48.24141.28±35.4933.58±9.42 治疗后28.34±6.23ab208.34±24.29ab43.21±11.25ab16.38±8.84ab
注:与治疗前比较aP<0.05;与对照组比较bP<0.05。
2.32组患儿EBV-DNA阳性率比较观察组和对照组患儿治疗前EBV-DNA阳性率分别为97.70%(85/87)、98.85%(86/87),治疗后分别为4.60%(4/87)、16.09%(14/87);治疗前2组患儿EBV-DNA阳性率比较差异无统计学意义(χ2=0.339,P>0.05);治疗后观察组患儿EBV-DNA阳性率显著低于对照组,差异有统计学意义(χ2=6.197,P<0.05)。
2.42组患儿临床疗效比较观察组患儿治疗显效64例,有效21例,无效2例,总有效率为97.70%(85/87);对照组患儿治疗显效38例,有效37例,无效12例,总有效率为86.21%(75/87);观察组患儿治疗总有效率高于对照组,差异有统计学意义(χ2=4.755,P<0.05)。
2.52组患儿不良反应比较观察组患儿发生恶心、呕吐2例,头痛1例,粒细胞减少1例,不良反应发生率为4.60%(4/87);对照组患儿发生恶心、呕吐1例,血小板减少1例,粒细胞减少1例,不良反应发生率为3.45%(3/87);2组患儿不良反应发生率比较差异无统计学意义(χ2=0.691,P>0.05)。
3 讨论
IM主要由EBV感染所致,多发生于学龄期儿童,可通过唾液、血液等方式传播[7-8]。EBV感染后主要侵袭B淋巴细胞,并在细胞中长期潜伏,持续刺激B淋巴细胞增殖和分化[3]。IM患儿的主要临床表现为发热、咽峡炎及肝、脾、淋巴结大,严重影响儿童的身体健康[9]。目前,EBV感染引起的IM尚无特效的治疗药物,多采用抗病毒、免疫调节等治疗[10]。重组干扰素α-2b是病毒进入机体后诱导宿主细胞产生的一种抗病毒低分子量蛋白质,其能够增强机体免疫系统的防御能力,具有抗病毒和免疫调节双重作用[11-12]。重组干扰素α-2b不在人体内代谢,不损害肝脏,直接经肾排泄,无肾毒性[13]。
本研究结果显示,2组患儿治疗后CD3+和CD8+水平显著低于治疗前,CD4+水平和CD4+/CD8+显著高于治疗前;治疗后,观察组患儿CD3+和CD8+水平显著低于对照组,CD4+水平和CD4+/CD8+显著高于对照组;2组患儿治疗后血清AST、LDH、CK及CK-MB水平显著低于治疗前,治疗后观察组患儿血清AST、LDH、CK及CK-MB水平显著低于对照组;治疗后观察组患儿EBV-DNA阳性率显著低于对照组,观察组患儿治疗总有效率高于对照组,且2组患儿不良反应发生率比较差异无统计学意义;提示重组干扰素α-2b能够显著提高IM患儿的免疫功能,改善患儿的心肌酶谱,有效抑制EBV。重组干扰素α-2b本身是一种低分子量蛋白质,其能够诱导机体产生翻译抑制蛋白,指导相关蛋白的翻译并抑制EBV复制所需要的酶,使EBV增殖减慢[14]。另外,重组干扰素α-2b可增强T淋巴细胞和B淋巴细胞的功能,提高机体免疫力,进而杀死EBV。
综上所述,重组干扰素α-2b能够显著提高IM患儿的免疫功能,改善患儿的心肌酶谱,有效抑制EBV复制。

