乳腺癌患者血清PPAR⁃γ基因甲基化qPCR检测及临床意义
韦美德 董家书 周格琛 邓开凤 戴盛明
乳腺癌是女性最常见的恶性肿瘤之一,严重危害女性身心健康[1]。自20世纪70年代末开始,乳腺癌在全球范围内一直位居女性肿瘤的首位,并且其发病率还在以每年1.2%的速度递增,我国新确诊乳腺癌患者占新发癌症患者的25%[2⁃3]。乳腺癌发生发展过程中,抑癌基因甲基化异常是导致疾病发生的重要机制,其可成为肿瘤筛查与诊断有价值的生物标志物[4⁃5]。研究表明,肿瘤患者外周血中循环DNA的浓度明显增加,肿瘤细胞来源的循环游离 DNA(circulating cell⁃free DNA,cfDNA)常携带肿瘤相关的遗传异常如超甲基化,这一特点促使cfDNA有可能成为潜在的生物标志物,因其具有获取简便,侵害性小,实时监测等优势,可为肿瘤的早期诊断,预后评估提供有效依据[6]。过氧化物酶体增殖物激活受体⁃γ(peroxisome proliferator⁃acti⁃vated receptor⁃γ,PPAR⁃γ)是一种由配体激活的核转录因子,活化的PPAR⁃γ可调控脂肪细胞相关基因的表达,具有抗肥胖及抗炎抗肿瘤作用[7⁃8]。本课题组前期的实验结果表明PPAR⁃γ在乳腺癌组织表达低于癌旁组织[9],研究已证实,PPAR⁃γ低表达与该基因的启动子甲基化增加有关[10]。PPAR⁃γ基因甲基化状态在乳腺癌中尚未见报道,本研究拟通过进一步检测乳腺癌患者血清中PPAR⁃γ基因甲基化状况,结合临床病理资料,探讨PPAR⁃γ基因甲基化检测在乳腺癌筛查与诊断方面的应用价值,为PPAR⁃γ甲基化检测在临床中的应用提供理论支持。
1 材料与方法
1.1 研究对象
2015年4月至2016年9月在我院就诊的良、恶性乳腺疾病患者共343例作为研究对象(患者临床资料完整),乳腺癌153例,年龄范围27~75岁,平均年龄(41.7±8.1)岁;乳腺囊肿66例,年龄范围24~66岁,平均年龄(35.7±6.9)岁;乳腺增生 124例,年龄范围22~61岁,平均年龄(32.7±6.9)岁;所有乳腺癌患者术前未接受化疗、放疗及其他抗癌治疗,良性乳腺疾病患者未进行手术及药物治疗;健康对照女性50例,年龄范围25~65岁,平均年龄(35.7±5.5)岁。4组资料在年龄上比较差异无统计学意义(P>0.05)。研究获得伦理委员会批准,患者签署知情同意书。
1.2 标本的采集与储存
清晨空腹采集研究对象全血,置于生化无抗凝剂管,避免溶血。常温静置30 min后,3 000 r/min离心10 min,将血清转移至聚丙烯EP管中,将所有标本统一编码,保存于-80℃低温冰箱备用。收集乳腺癌患者临床信息。
1.3 试剂和引物
血清DNA提取试剂盒(QIAamp DNA Blood Midi Kit,货号51185),重亚硫酸氢盐修饰试剂盒(EpiTect Fast DNA Bisulfite Conversion Kit,货号59824)购自德国凯杰生物技术(上海)有限公司;PCR 试剂(Talent qPCR PreMix,货号 FP209⁃02)购自天根生化有限公司;甲基化阳性对照(Cp⁃GenomeTM Universal Methylated DNA)和甲基化阴性对照(CpGenome Universal Unmethylated DNA)购自美国Millipore公司。根据人源PPAR⁃γ基因启动子序列,由大连宝生物有限公司设计合成甲基化特异引物和非甲基化引物(表1)。
1.4 血清DNA提取与重亚硫酸氢盐转化修饰
根据按照QIAamp DNA Blood Mini Kit操作说明书提取每样品1 mL血清基因组DNA,经NanoDrop 2000测定DNA浓度和纯度。按照Epi⁃Tect Fast DNA Bisulfite Kit说明书对提取的DNA样品和标准品DNA(CpGenomeTM Universal Methylated DNA和CpGenome Universal Unmethyl⁃ated DNA)进行重亚硫酸氢盐转化修饰。

表1 引物序列Table 1 Details of primers
1.5 标准品的制备和标准曲线的建立
NanoDrop 2000测定重亚硫酸氢盐转化修饰后的甲基化阳性对照DNA浓度和纯度,以双蒸水按10倍梯度稀释制作浓度依次为1 500、150、15、1.5、0.15、0.015 ng/μL的DNA标准品,按每拷贝基因组DNA约3 pg计算,分别加入2 μL标准品,则相当于106~10的拷贝数,以不同浓度阳性对照标准品扩增获得的循环值(cycle threshold,CT)为横坐标(x轴),标准品拷贝数的对数值为纵坐标(y轴)制作标准曲线,该标准曲线的制备参考文献[11⁃12]进行。
1.6 实时荧光定量 PCR(real⁃time fluorescent quantive PCR,qPCR)检测 PPAR⁃γ基因甲基化情况
分别检测每一个样品的甲基化情况,PCR反应条件:95℃预变性3 min;95℃变性30 s,55℃退火 30 s,72℃延伸 45 s,40个循环;72℃继续延伸10 min后,进行熔解曲线分析以确认产物的特异性。每次实验以CpGenome Universal Unmethyl⁃ated DNA为阴性对照。根据样品CT值,结合标准曲线分别计算样品的甲基化和非甲基化拷贝数,甲基化水平=甲基化拷贝数/(甲基化拷贝数+非甲基化拷贝数)。甲基化引物出现扩增则认为该样品为甲基化阳性标本。
1.7 统计学处理
所有数据均使用Graph⁃Pad Prism 5.0进行统计,以P<0.05认为差异有统计学意义。PPAR⁃γ甲基化检出率与临床病理特征间的关系用卡方检验分析;各疾病组甲基化水平的比较用Wilcoxon秩和检验。
2 结果
2.1 标准曲线制备结果
甲基化标准品浓度分别为 106、105、104、103、102、10拷贝时,PPAR⁃γ的CT 值分别为 19.6、22.8、25.3、27.9、31.2、34.8,标准曲线相关系数为 0.995,样品甲基化和非甲基化拷贝数计算公式为:拷贝数=10(-0.335×CT值+12.54),见图 1。
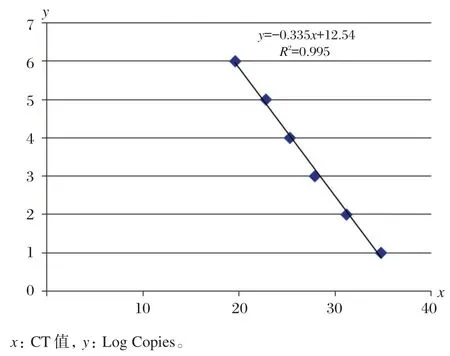
图1 PPAR⁃γ检测标准曲线Figure 1 The standard curve of PPAR⁃γdetection
2.2 各组样本PPAR⁃γ基因甲基化水平
各组乳腺疾病PPAR⁃γ基因甲基化水平分别为:乳腺癌(32.3%~50.2%);乳腺囊肿(27.7%~44.9%);乳腺增生(25.6%~42.5%),与健康对照(23.2%~30.6%)进行秩和检验,差异均有统计学意义(P<0.05),而疾病组间差异无统计学意义(P>0.05),见表2。
2.3 乳腺疾病患者PPAR⁃γ甲基化检出率的比较
乳腺疾病患者血清DNA中PPAR⁃γ甲基化检出率分别为:乳腺癌54.9%(84/153),乳腺囊肿45.5%(30/66),乳腺增生41.1%(51/124),均显著高于对照组的16%(8/50),差异均有统计学意义(P<0.05)(表3),乳腺癌检出率与乳腺囊肿无差异,但与乳腺增生差异显著(P<0.05);153例乳腺癌患者PPAR⁃γ基因甲基化检出率与患者年龄、分期、病理类型以及淋巴结转移均无显著差异(P>0.05),见表4。
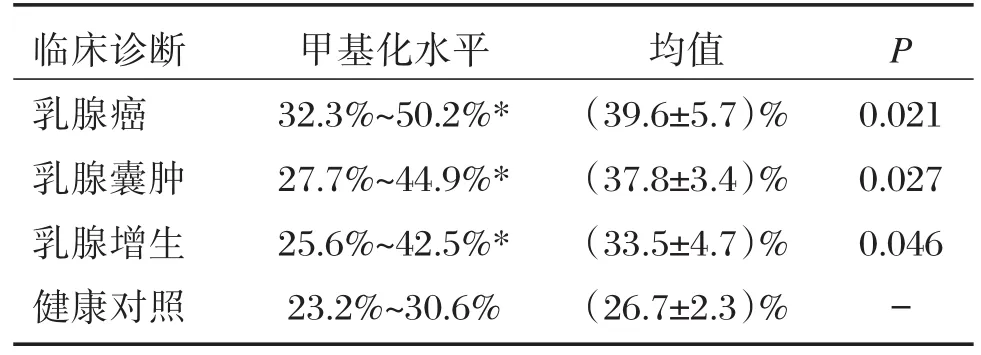
表2 各组样本PPAR⁃γ基因甲基化水平Table 2 The level of PPAR⁃γgene methylation in different group

表3 乳腺疾病样本与正常对照样本PPAR⁃γ甲基化检出率Table 3 The detection rate of PPAR⁃γmethylation in breast disease samples and normal control samples
3 讨论
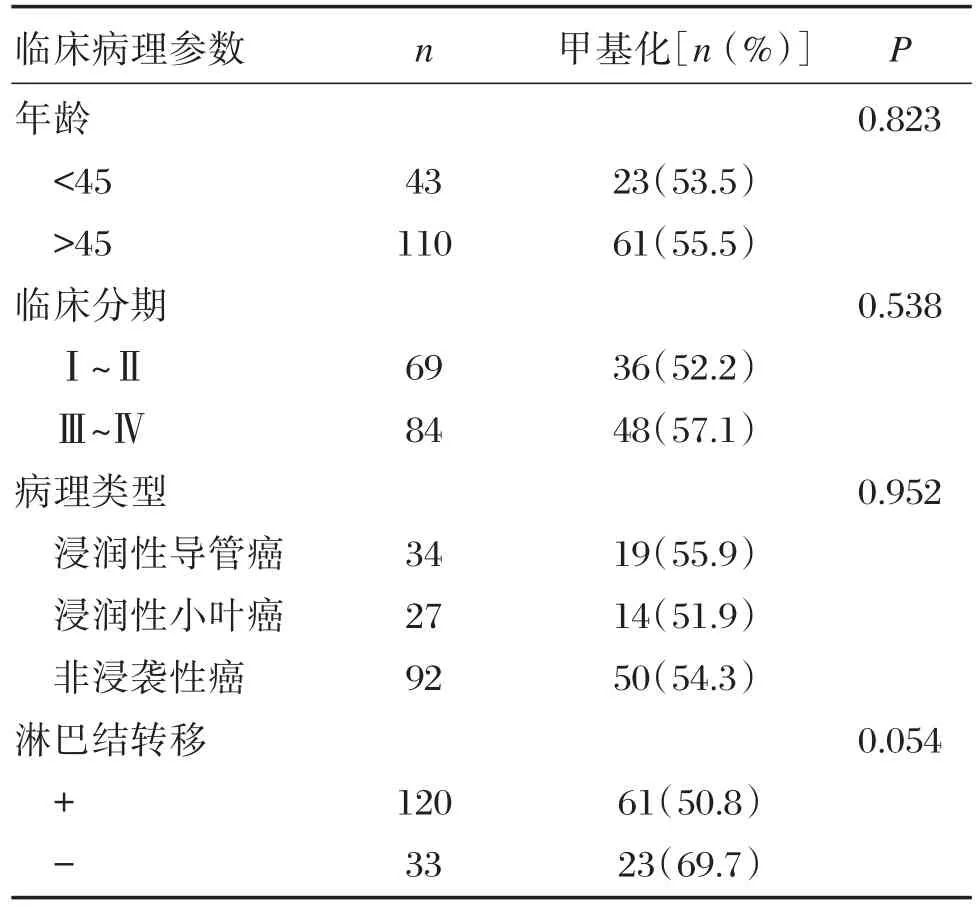
表4 乳腺癌患者临床资料及PPAR⁃γ甲基化检出率Table 4 The clinical data of breast cancer patients and the detection rate of PPAR⁃γmethylation
血清游离DNA可来源于肿瘤细胞溶解或微转移灶排出[13],因此循环DNA检测对某些肿瘤的早期诊断、监测复发、判断肿瘤的活动性有重要价值。DNA甲基化是表观遗传学修饰的方式之一,抑癌基因甲基化导致基因失活和转录抑制,引起细胞代谢紊乱,是肿瘤发生的重要机制之一[14]。相关研究表明乳腺癌血清中多种关键抑癌基因的表达缺失都与其CpG岛高甲基化有关[15]。PPAR⁃γ是核受体基因超家族中的一员,通过配体依赖途径影响下游基因转录[16]。PPAR⁃γ在脂肪组织、结肠、脾脏及巨噬细胞中大量表达,并且被认为可通过调控细胞周期而影响肿瘤生长[17⁃18]。有报道称PPAR⁃γ与雌激素反应元件结合后,可阻止雌激素反应元件和雌激素受体结合,从而抑制雌激素活性,成为临床治疗雌激素依赖性疾病的一种重要途径[19]。越来越多的体内及体外实验证据表明PPAR⁃γ参与抗炎反应[15],并且细胞内PPAR⁃γ的表达对调节性T细胞的抗炎作用是必须的[20]。另外,Apostoli等[21]利用PPAR⁃γ敲除试验,发现PPAR⁃γ激活显著降低了二甲基苯丙蒽介导的恶性乳腺肿瘤体积,且不考虑基因型;Abduljabbar等[22]研究发现高表达的PPAR⁃γ与没有接受激素治疗的雌激素受体阳性肿瘤患者的生存期延长有关,提示PPAR⁃γ的激活和表达很可能起到控制肿瘤生长的作用。本课题组前期实验结果发现PPAR⁃γ在癌组织中低表达,研究已证实,PPAR⁃γ低表达与该基因的启动子甲基化增加有关[10]。Sharma等[23]认为血浆游离DNA和原发性乳腺癌肿瘤标本中存在较为一致的表观遗传学改变,在乳腺癌的监测与预后判断中具有潜在价值。检测游离DNA的各种生物学特性有可能用于肿瘤患者的无创性诊断。关于血清还是血浆用于肿瘤基因检测目前有不同的讨论。Takeshita等[24]认为血浆的检测敏感性更高。Park等[25]则认为,虽然血浆中的游离DNA浓度范围相比血清大,但血清游离DNA含量在癌症组和正常组之间也有明显差异,从血清检测DNA亦可。另外,血清提取样本DNA比血浆更稳定,有利于增加检测反应的灵敏性和稳定性[26]。综合以上因素,本研究拟选用无抗凝剂的血清作为检测样本。
目前在乳腺癌中已报道的异常基因甲基化有结肠腺瘤样息肉(adenomatous polyposis coli,APC)基因、乳腺癌易感基因1(breast cancer susceptbili⁃ty gene 1,BRCA1)、人类RUNT相关转录因子3(human runt⁃related transcription factor 3,RUNX3)、张力蛋白同源基因(phosphatase and tensin homolo⁃gy deleted on chromosome ten,PTEN)等[27⁃29],为DNA甲基化用于乳腺癌的筛查与诊断提供了重要依据。本研究评估了乳腺癌患者血清PPAR⁃γ基因甲基化状态,进而分析PPAR⁃γ基因甲基化检测在乳腺癌筛查与诊断的意义。结果显示,乳腺癌患者血清中PPAR⁃γ基因甲基化检出率明显高于乳腺增生患者以及健康对照组,差异均具有统计学意义(P<0.05),而与乳腺囊肿无显著差异,并且疾病组PPAR⁃γ基因甲基化检出率都显著高于健康对照组(P<0.01),表明PPAR⁃γ基因甲基化在疾病人群中的发生率增加;PPAR⁃γ基因甲基化检出率与乳腺癌患者年龄,临床分期,病理类型以及淋巴结转移无相关性;另外,疾病组PPAR⁃γ基因甲基化水平无差异(P<0.05),但都显著高于健康对照组(P<0.05),乳腺癌组PPAR⁃γ基因甲基化水平可显著区分健康对照人群,但不能与乳腺良性疾病区分开,说明PPAR⁃γ甲基化水平增高提示人群存在罹患乳腺疾病的可能。
本研究通过荧光定量检测方法发现乳腺癌血清中PPAR⁃γ基因甲基化水平增高,在乳腺癌筛查和诊断中具有一定的临床应用前景,待进一步扩大临床样本检测,以提供更准确的分子生物学依据。