广东江门地区13 725例新生儿遗传性耳聋基因筛查结果分析
唐佳 曾钦龙 李秋丽 冯建江 关翠柳 容丽玉 容林惠 吴玉宇邓筹芬 孙淑湘 孙铁兰 李智明 谭淑明 谭洁亮 罗良平
耳聋是最常见的遗传病之一,据世界卫生组织(World Health Organization,WHO)统计2018年全球听力残疾人达4.66亿(4.32亿成人,3 400万儿童),超过世界总人口5%[1]。中国先天性耳聋在新生儿中的发生率为1‰~3‰,每年新增3万聋儿,90%以上耳聋患儿出生于听力正常、无明显耳聋家族史的家庭[2⁃3]。导致听力障碍的原因有很多,在新生儿中约一半的耳聋是由遗传因素引起的,随着儿童年龄增长遗传因素致聋比例进一步增长至60%以上[4⁃5]。在我国导致非综合征性耳聋的基因主要为GJB2、GJB3、SLC26A4、线粒体 DNA12S rRNA4种基因,其中常见致聋基因GJB2、SLC26A4和线粒体DNA12S rRNA突变导致的耳聋病例占约占 40%[6]。在人群中GJB2、GJB3、SLC26A4、线粒体DNA12S rRNA基因突变的携带率分别为3.01%、0.37%、2.02%、0.19%,总体携带率约为 6%[7]。
反向斑点杂交技术是Saiki等[8]于1989年提出的,该方法将多种核酸探针固定在膜条上,通过与扩增后的待检核酸靶序列通过碱基互补配对杂交,一次即可进行多种基因亚型的分类,因此有很高的检测效率,而且简单经济,目前广泛应用于地中海贫血、G6PD缺乏症、乙型肝炎病毒、人乳头瘤病毒等基因分型[9⁃10]。
为了解江门地区新生儿常见耳聋基因突变携带率和突变类型,本研究对13 725例新生儿采用反向斑点杂交法对4种常见耳聋基因进行筛查,为当地大规模开展耳聋基因筛査提供依据,对明确遗传性耳聋高危的新生儿实施有效的干预,降低耳聋发病率。
1 材料与方法
1.1 研究对象
以2016年6月至2018年2月在江门市妇幼保健院和开平市妇幼保健院出生的13 725例新生儿(男7 228例,女6 497例)为研究对象。经家长签署耳聋基因筛查知情同意书后,采集新生儿脐带血进行耳聋基因检测,同时在新生儿出生后48 h进行听力筛查。本研究由江门市妇幼保健院伦理委员会批准通过。
1.2 方法
1.2.1 听力筛查
新生儿于出生后48 h利用瞬态诱发耳声发射(transient evoked otoacoustic emission,TEOAE)进行听力初筛,不通过的新生儿42天后复查TEO⁃AE,复查不通过的新生儿再做自动判别听性脑干诱发电位(automated auditory brainstem response,AABR),AABR仍不通过就建议3个月内转诊到江门市中心医院作听力诊断。
1.2.2 基因组提取和耳聋基因筛查
脐带血基因组提取按照Lab⁃Aid 820核酸提取仪及配套试剂磁珠法(厦门致善生物科技股份有限公司)说明书操作。耳聋基因筛查利用遗传性耳聋基因检测试剂盒(PCR反向点杂交法)(深圳亚能生物技术有限公司)严格按照说明书操作,通过PCR扩增,杂交,洗膜,显色等步骤,完成4种基因16个常见耳聋基因突变位点的筛查,包括GJB2基因(c.35delG、c.176⁃191del16、c.235delC、c.299⁃300delAT);GJB3基因(c.538C > T、c.547G >A);SLC26A4基因(c.1174A > T、c.1226G> A、c.1229C >T、c.1975G >C、c.2027T>A、c.2168A >G、IVS7⁃2A > G、IVS15+5G > A);线粒体 DNA12S rRNA基因(m.1494C>T、m.1555A>G)。
1.3 追踪随访和遗传咨询
对听力筛查及16个耳聋基因突变位点检测结果为阳性的新生儿,进行遗传咨询与随访,进一步通过听力诊断和基因诊断确诊,采取必要的干预和治疗措施。
1.4 统计学分析
采用SPSS 22.0软件进行分析,计数资料以百分数(%)表示,实验数据采用卡方检验统计分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 听力筛查结果
13 725 例新生儿听力初筛不通过者2 295例,初筛阳性率16.72%;初筛未通过者于出生后42天行复筛,仍未通过者进行AABR检测,AABR不通过者133例,复筛阳性率为0.97%(133/13 725),于3个月内行听力学诊断和基因诊断。
2.2 耳聋基因筛查结果
13 725 例新生儿16个耳聋基因突变位点筛查出耳聋基因阳性511例,总阳性率为3.72%,其中GJB2基因突变 242例(c.235delC 215例,c.299⁃300delAT 21例,c.176⁃191del1 65例,c.35delG 1例),占检出人数的47.36%;SLC26A4基因突变210例(IVS7⁃2 A>G 137例,c.1229 C>T 47例,IVS15+5 G>A 12例,c.2168 A>G 10例,c.1975G>C 3例,c.1226G>A 1例),占检出人数的41.09%;线粒体DNA12S rRNA基因突变29例(m.1555 A>G 27例,m.1494C>T 2例),占检出人数的 5.67%;GJB3基因突变26例(c.538 C>T 10例,c.547 G>A 16例),占检出人数的5.09%,经过统计学分析GJB2突变人数与SLC26A4、线粒体DNA12S rRNA、GJB3突变人数相比差异均有统计学意义(P<0.05)。并发现双基因杂合突变2例,单基因复合杂合突变2例,见表1。
2.2 听力筛查和聋病易感基因联合筛查的结果
13 725 名新生儿中最终通过听力筛查者13 592人,未通过者133人,筛查未通过率0.97%(133/13 725)。13 592名听力通过者中的聋病易感基因异常的为497例。133例听力未通过者中的聋病易感基因异常的为14例,497例新生儿为耳聋基因异常而听力筛查通过。听力筛查与聋病易感基因联合筛查共检测出高危儿630例,阳性率为4.59%,与单独听力筛查相比,检出率提高了4.7倍,听力筛查和耳聋基因筛查阳性率两者比较差异有统计学意义(χ2=227.2,P<0.05)。
3 讨论
目前国内使用的新生儿听力筛查法主要有OAE和AABR,方便快速、经济有效而被广泛应用于临床。听力筛查易出现假阳性、假阴性结果,具有一定的时效性,迟发性耳聋及药物性致聋均可通过新生儿听力筛查,导致迟发性耳聋、渐进性耳聋及部分先天性耳聋的大量漏诊[11⁃12]。仅通过听力筛查不能明确耳聋的致病原因,无法评估患儿的预后。
耳聋基因筛查可以明确耳聋的致病原因,能发现听力正常的耳聋基因突变携带者,指导婚配和优生优育,避免生育遗传性耳聋患儿,同时耳聋基因筛查可以筛查出药物性致聋和迟发性耳聋新生儿,通过早期干预避免致残。本研究利用联合筛查的方法,在江门地区13 725例新生儿中推广应用取得了较好效果,与单独听力筛查相比,检出率提高了4.3倍,因此新生儿听力联合耳聋基因筛查具有很好的临床推广前景,可以实现对遗传性耳聋的早发现、早诊断、早干预。
本研究在13 725例新生儿中筛查出阳性病例511例,其中GJB2基因突变242例,为检出人数第一位的基因。2002年,迈阿密大学Liu等[13]证明c.235delC是中国人最常见的GJB2基因突变,人群携带率为1.3%。本研究16个突变位点中最常见突变为c.235delC,共检出215例c.235delC病例,突变率为1.57%,与上述研究报道[13]一致。c.235delC纯合子会引起极重度先天耳聋,该突变会导致从第78个氨基酸起连续插入2个错误氨基酸,并在第81个氨基酸提前终止翻译,最终合成一个截短没有生物活性CX26蛋白。本研究发现GJB2基因 c.235delC纯合突变 2例和c.176⁃191del16/c.235delC复合杂合突变1例。对GJB2基因突变导致的重度遗传性耳聋患者,应通过植入人工耳蜗进行治疗,在6个月前治疗和干预,儿童的语言交流能力会明显优于较晚发现听力障碍的儿童。
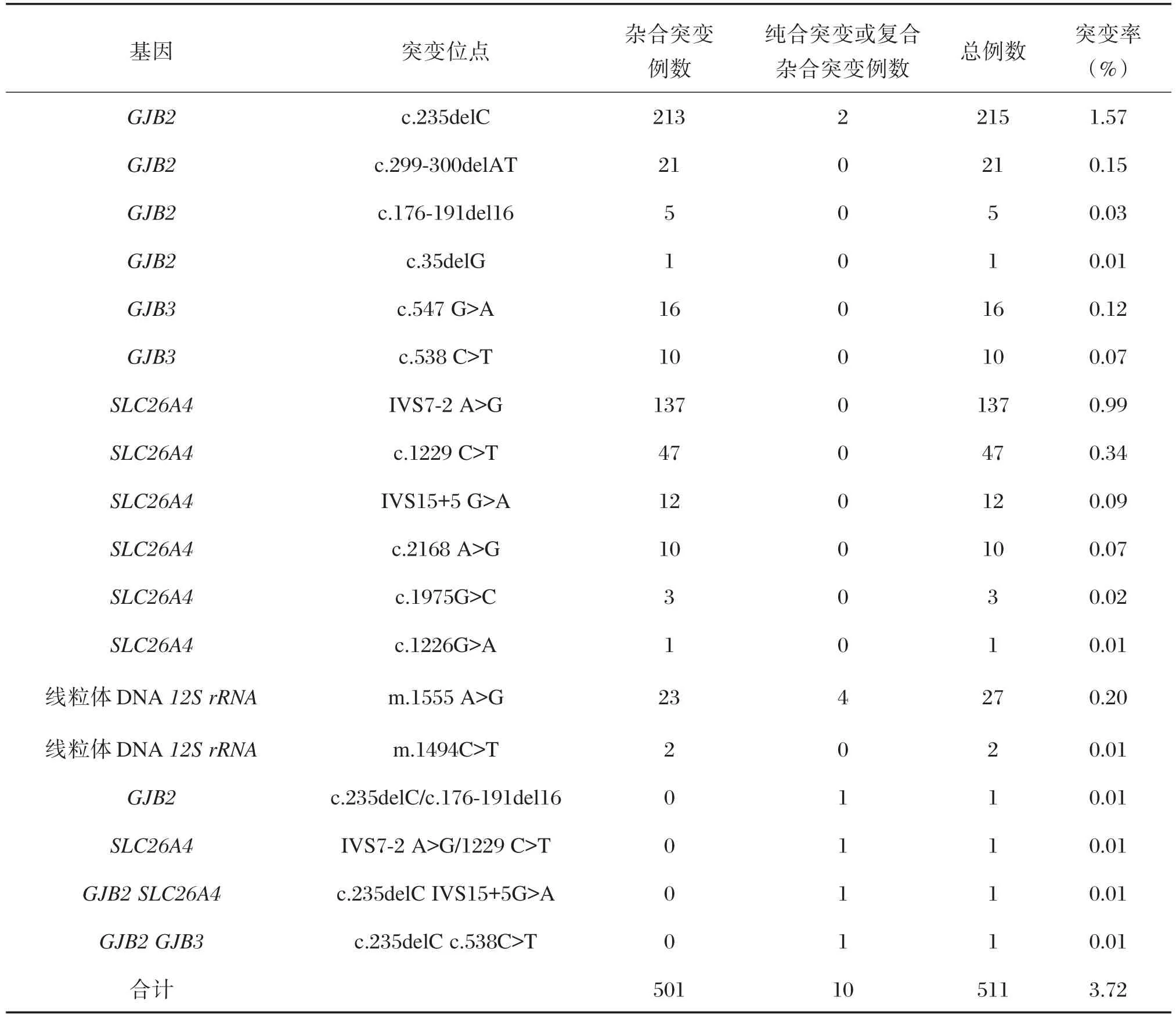
表1 13 725例新生儿耳聋基因筛查结果和突变率Table 1 Deafness gene mutation rates in 13 725 newborns
本研究发现1例GJB2基因c.235delC合并GJB3基因c.538C>T复合杂合突变,该新生儿听力诊断为重度耳聋。2009年,迈阿密大学Liu等[14]发现 CX26(GJB2)和 CX31(GJB3)均在耳蜗中表达,两者结合组合成半通道蛋白,当CX31发生突变时对CX26具有显性失活效应,由于CX26是耳蜗中主要缝隙连接蛋白,表达量高于CX31,因此单独CX31突变对听力的影响有限,但是当CX26同时发生了突变时情况就会变得严重。
GJB3基因于1998年由夏家辉等研究中国两个常染色体显性遗传非综合征性耳聋的家系时定位并克隆[15]。GJB3的错义突变c.547 G>A和无义突变c.538 C>T被认为与高频听力下降有关[16]。本研究发现26例携带GJB3基因杂合突变,10例c.538 C>T突变,16例c.547 G>A突变,需对这些新生儿定期随访和听力检查监测听力情况。
SLC26A4称非Na+依赖的氯化物/碘化物转运蛋白,属于跨膜阴离子转运蛋白。2002年,Rotman⁃Pikielny 等[17]发现SLC26A4基因突变会导致编码蛋白滞留在内质网或不能正确锚定在细胞膜上,影响内耳中内淋巴液的回收循环,造成前庭导水管扩大。2007年,301医院 Wang等[18]研究发现,在中国绝大部分前庭导水管扩大和Mondini内耳畸形耳聋患者都携带SLC26A4基因突变,其中最常见的IVS7⁃2A>G。本研究发现SLC26A4基因突变210例,包括IVS7⁃2 A>G 137例,与上述研究报道[18]一致。IVS7⁃2A>G和c.1229 C>T双重杂合子表现为重度耳聋,本研究发现1例SLC26A4基因IVS7⁃2 A>G和c.1229 C>T双重杂合突变。
氨基糖苷类抗生素与突变后的线粒体DNA12S rRNA结合后会影响线粒体蛋白质合成,蛋白翻译效率被抑制了最少40%~50%,使得合成蛋白质量不足以维持线粒体正常功能,最终影响耳蜗功能[19]。本研究发现29例线粒体DNA12S rRNA基因突变(m.1555 A>G 27例,m.1494C>T 2例),对这些药物敏感性耳聋基因携带者及来自同一母系的所有药物性致聋基因携带的家族成员,均需要进行用药指导,避免使用氨基糖苷类抗生素[20]。
本研究发现江门地区耳聋基因突变携带率为3.72%,包括GJB2突变携带率为1.76%,SLC26A4为1.53%,线粒体DNA12S rRNA为0.21%;GJB3为0.19%;李振安等[21]报道佛山地区40 672例新生儿耳聋基因突变携带率为3.31%;熊怡等[22]报道中山地区906例新生儿耳聋基因突变携带率为4.75%;潘丽等[23]报道珠海地区9 775例新生儿耳聋基因突变携带率为4.2%。通过比较分析发现江门地区耳聋基因突变携带率低于中山、珠海地区,高于佛山地区,其中SLC26A4突变携带率江门地区与佛山、珠海地区相近,三者明显高于中山地区。同时发现江门、佛山、珠海、中山地区4种基因突变携带率均为GJB2>SLC26A4>线粒体DNA12S rRNA>GJB3。
目前,研究表明与耳聋相关的基因有100个左右,致聋基因突变有近千种[12]。所导致的耳聋中,30%为综合征性耳聋,70%为非综合征性耳聋,非综合征性耳聋的遗传方式包括常染色体隐性遗传(70%),常染色体显性遗传(15%),X染色体连锁遗传(1%)和线粒体DNA遗传(约1%)[24⁃25]。本研究也存在不足,只筛查了4个基因16个位点,尚不能完全覆盖已知耳聋基因突变类型,故存在一定程度的漏诊,只能作为筛查手段,因此需做好宣教工作。高通量测序技术的快速发展,未来通过高通量测序建立适合中国人的耳聋基因筛查体系,可以更加全面高效、低成本的实施新生儿耳聋基因筛查工作。
综上所述,江门地区新生儿常见耳聋基因突变携带率较高,常见突变为GJB2基因c.235delC和SLC26A4基因IVS7⁃2 A>G,开展新生儿听力筛查联合耳聋基因筛查有助于耳聋的早发现、早干预,能有效控制聋哑残疾的发生,具有良好的社会效益,本研究为江门地区推广耳聋基因筛査提供了重要科学依据。