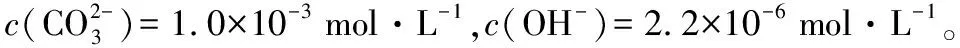NaHCO3溶液教学中的几个问题的辨析
河北 韩万中

一、NaHCO3溶液酸碱性的判据
人教版高中化学《必修1》第56页首次学习使用酚酞试液验证NaHCO3溶液呈碱性,体现了实验观。至《选修4》学习盐类水解时,很多老师运用水解原理来解释NaHCO3溶液呈碱性的原因,这是对NaHCO3溶液酸碱性成因的一种片面的认识。
用pH计测定0.1 mol·L-1NaHCO3溶液的pH为 8.40,这是实验判据。

事实的真相究竟是怎样的?

NaHCO3在水中全部电离后,存在如下两个平衡:
电离常数:Ka2=4.7×10-11。
NaHCO3水溶液的理论pH究竟是多少?可以通过下列计算得到:





作为一种思维方式,尽可能地将定性问题建立成合理模型,转化为定量计算分析,可以触类旁通,分析推理诸如NaHSO3、NaHC2O4等溶液的酸碱性,克服死记硬背的不足,提高分析问题的科学性。
上述分析虽有超纲之嫌,但对强化学生从理论层面上求证及探究的意识大有裨益。
例1.(2014年全国Ⅱ,11节选)pH相同的 ①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③,是否正确?
当年该问题给出的参考答案是正确。
像NaHCO3这样的酸式盐既可以水解又可以电离,属于两性物质,不能只考虑水解因素而不考虑电离因素。难道高考题给出的参考答案真的错了吗?我们不妨让实验事实说话,用pH计分别测定0.1 mol·L-1的CH3COONa、NaHCO3、NaClO溶液的pH,其pH分别是9.00、8.30、10.30,这显然有点违背那个所谓“越弱越水解”的规律了。

二、厘清NaHCO3溶液中微粒浓度大小排序的“乱象”

在NaHCO3溶液中,存在下列三个平衡:


实际情况果真如此吗?




三、NaHCO3溶液能不能和CaCl2溶液反应?
对于NaHCO3的性质,很多资料都明确指明NaHCO3与CaCl2不发生化学反应,理由是Ca(HCO3)2可溶,NaHCO3与CaCl2之间不符合复分解反应发生的条件。这一说法非常普遍,充斥着教辅和课堂,如2017年5月天津人民出版社出版的《一本涂书化学》第65页、2017年6月首都师范大学出版社、教育科学出版社出版的《同学教材分层讲练高中化学必修1》第88页等。
2010年浙江理综25题中的一个小题:设计一个实验方案,探究Na2O与空气接触后生成可溶性盐的成分(不考虑结晶水合物)。题目中的可溶性盐的成分是Na2CO3,或NaHCO3,或Na2CO3与NaHCO3的混合物,评卷细则要求凡答“取少量样品溶于水后滴加CaCl2溶液,若有白色沉淀产生,说明含有Na2CO3”者均未给分,不给分的原因虽然没明说,但话外音是明确的:CaCl2能与NaHCO3溶液发生反应且生成白色沉淀。
实验是化学的最高法庭。分别取10 ml 0.5 mol·L-1NaHCO3溶液于小试管中,用滴定的方法,滴加0.05 mol·L-1的CaCl2溶液,至开始观察到白色浑浊,记录滴加CaCl2溶液的体积。共进行三次平行实验,平均值为1.34 mL。

该实验事实说明NaHCO3可与CaCl2溶液能发生反应。至此我们可以理解2010年浙江理综25题(5)问指出的答案不给分的原因了,那就是CaCl2不仅能和Na2CO3溶液反应生成白色沉淀,而且也能和NaHCO3反应生成白色沉淀。评分细则“教育”我们教学时要遵循物质的本质属性,充分考虑化学反应的复杂性,切不可想当然、人云亦云,给学生传递违背客观事实的信息,否则会产生一些科学性误导。而这一误导不仅仅是知识性误导,更重要的是思维和方法的误导,思维误导比知识误导更可怕、危害更严重。
从上述分析看,我们可以推测NaHCO3和CaCl2溶液浓度越低,越难产生浑浊和气体,而中学阶段进行的实验一般为常量范围内的定性实验,所配溶液浓度不会太低,所以我们确定两者能够发生化学反应。
例3.(2013年全国Ⅰ,27节选)写出下图中沉钴所发生的化学反应的化学方程式: 。