既熟悉又陌生的金属元素——以金属元素为背景的试题解题策略初探
吉林 赵鑫光 杨竞翔
在高考化学试卷中的非选择题的物质结构部分,经常以高中教材以外的金属元素作为命题背景,这体现了不同知识点的横向联系和高考命题的综合性。以这些学生不太熟悉的金属单质及其化合物为载体,综合考查化合物的制备与检验、化学基本概念、化学反应原理、物质结构与性质等方面的内容。本文选择几种典型的非主族金属元素加以介绍。并配例题、解析,以期能使学生通过练习掌握该类试题的解题策略。
1.钛及其化合物



【典例1】钛及其化合物在现代工业生产及人们的日常生活中有着重要的用途。工业上用钛铁矿石(主要成分为FeTiO3,含SiO2、FeO及Al2O3等杂质)经如图所示工艺流程制备二氧化钛:

(1)净化钛铁矿石时,________(填“需要”或“不需要”)除去杂质FeO。
(2)净化钛铁矿石时,需用浓氢氧化钠溶液处理,写出该过程可能发生的离子方程式:_______________________________________。
(3)步骤③发生反应的化学方程式为_______________________________________。
(4)步骤④⑤⑥的目的是_______________________________________。
(5)步骤⑦中发生反应的离子方程式为_______________________________________。
(6)电解TiO2可制得金属钛,同时产生氧气,若使用熔融ZrO2/Y2O3作电解质,TiO2为阴极,石墨为阳极,则阴极发生的反应为_______________________,阳极的石墨需要定期补充,其原因是_______________________________________。

2.钒及其化合物


【典例2】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分如下表:

物质V2O5V2O4K2SO4SiO2Fe2O3Al2O3质量分数/%2.2~2.92.8~3.122~2860~651~2<1
以下是一种废钒催化剂回收工艺路线:

回答下列问题:



(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式:_______________________________________。

3.铬及其化合物





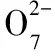

(1)第①步反应的离子方程式是_______________________________________。
(2)第②步中用pH试纸测定溶液pH的操作是______________________________________。
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有________。
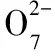
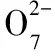
4.锰及其化合物


【典例4】化学为人类造福既要有效去除污染物同时又要充分利用资源,某兴趣小组利用软锰矿(主要成分为MnO2,还含有少量Fe、Al、Cu、Ni等金属的化合物)作煤燃烧尾气中的脱硫剂,同时生产MnO2作为电池材料,其工艺流程示意图如下图所示:

请回答下列问题:
(1)用MnCO3可以除去溶液中的Al3+和Fe3+的理由是_______________________________________。
(2)己知:25℃、101 kPa时,



SO2与MnO2反应生成MnSO4的热化学方程式是_______________________________________。
(3)MnO2可用作超级电容器材料。用惰性电极电解MnSO4溶液时在________极可产生MnO2,其电极反应式为_______________________________________。
(4)MnO2是碱性锌锰电池的正极材料。已知放电时正极区域的碱性增强,每消耗1 mol MnO2时转移1 mol电子,试写出相应的电极反应方程式:_______________________________________。
(5)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将am3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,将SO2的脱除率为89.6%,最终得到MnO2的质量为ckg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2________kg。

5.钴、镍及其化合物
(1)单质钴和单质镍常温时在空气中能稳定存在,加热条件下可生成CoO和NiO。
(2)CoO和NiO均不溶于水,可溶于酸,CoO还可溶于强碱,但不溶于氨水,而NiO可溶于氨水。


(5)CoCl2呈蓝色,CoCl2·6H2O呈粉红色,常用作变色硅胶中的添加剂来指示硅胶的吸水能力。
【典例5】现欲从某含镍废催化剂中回收镍并制得 NiSO4·7H2O 晶体,已知该废催化剂中主要含金属镍,还含有铝、铁、三氧化二铝及不溶于酸也不溶于碱的惰性杂质。其工艺流程示意图如下所示:

部分金属离子完全沉淀时溶液的pH如下表所示:

沉淀Al(OH)3Fe(OH)3Fe(OH)2Ni(OH)2pH5.23.29.79.2
(1)用碱液“浸取”的是为了除去含镍废催化剂中的________________________(写化学式)。
(2)用酸液“浸取”时使用的酸是________。过滤后,滤液②中可能含有的金属离子是________(写离子符号)。
(3)加入H2O2时,发生反应的离子方程式为_______________________________________。
(4)调节pH=2~3是为了_______________________________________。
(5)操作①主要进行的操作步骤及操作顺序是_______________________________________。
(6)在强碱溶液中用NaClO氧化NiSO4,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为_______________________________________。

6.铜、银及其化合物



(4)CuCl、CuI等亚铜盐均为白色难溶于水的固体。


(7)[Ag(NH3)2]OH具有一定的氧化性,与含有醛基的物质在一定条件下可以发生银镜反应。

【典例6】银是一种化学性质不活泼的贵金属,常用作金属货币和首饰,近年来在化学电源和照明器具等方面也有广泛应用,试回答下列问题:
(1)佩戴久了的银饰品表面会逐渐失去银白色的金属光泽,变暗变黑,试用化学方程式解释原因:_______________________________________。
(2)向500 mL 0.18 mol/L的AgNO3溶液中加入500 mL 0.20 mol/L的盐酸,混合后的溶液中Ag+浓度为________mol/L;溶液的pH为________。
(3)硝酸银溶液必须避光保存,在光照的条件下会分解生成单质银和红棕色气体,试写出所发生的化学反应方程式:_______________________________________。
(4)写出如图所示的原电池装置中正极发生的电极反应:________,若起始时,银电极和铜电极的质量相等,反应开始后当两电极质量差为2.80 g时电路中转移的电子的物质的量为________。


7.锌及其化合物



【典例7】制造锌钡白的主要原料之一是硫酸锌,如图是利用ZnO(含有少量FeO、CdO、PbO杂质)制备硫酸锌的工艺流程示意图:

已知:H2O2是一种弱酸,常温下其水溶液的pH≈5,Fe3+完全沉淀时的pH≈3。
试回答下列问题:
(1)为了提高浸取的速率,除了适当增大硫酸的浓度外还可以采取哪些措施?________________________________________________________________________(写出两条即可)。
(2)“净化1”后的滤渣B主要成分为________,能够除去Cd、Pb的原因是_______________________________________。
(3)“净化2”中需要加入过氧化氢,其电子式为________,滤渣C的主要成分是________,该过程发生反应的离子方程式为_______________________________________。
(4)在明代宋应星所著的《天工开物》一书中,有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红……冷淀,毁罐取出……即倭铅也。”试写出该过程中主要发生的化学反应方程式:____________________。(注:炉甘石的主要成分是碳酸锌,倭铅即金属锌)


