肝门部胆管癌外科治疗预后影响因素分析*
刘连杰,王石,王烯冬,武志雄
肝门部胆管癌(hilar cholangiocarcinoma,HCCA)系起源于肝总管1/3节段处至肝门横沟区胆管的粘膜上皮癌,约占全部肝外胆管癌的70%[1],主要侵犯肝总管及其分叉部左右侧肝管。手术是目前治疗HCCA的主要手段,以根治性切除术患者预后最佳。但HCCA起病隐匿,早期确诊率低,大部分患者就诊时病情已进展至中晚期,手术切除难度大,预后较差。研究显示,HCCA切除率在50%左右,且患者术后3 a生存率较低[2]。早期研究认为HCCA患者的年龄和病理学分型等与患者外科手术后预后有关[3]。近年来,有学者指出,手术方式、肿瘤浸润及转移等均对HCCA患者的生存产生影响[4]。因此,为探讨HCCA患者外科手术治疗后影响预后的因素,本研究分析了我院收治的120例HCCA患者的临床资料,现将结果报道如下。
1 资料与方法
1.1 一般资料 2010年1月~2014年1月我院收治的HCCA患者120例,男75例,女45例;年龄26~79岁,平均年龄(54.8±7.8)岁;病程 3~12个月,平均(6.3±2.2)个月。临床表现有黄疸者120例,皮肤瘙痒37例,上腹部疼痛或不适49例,食欲不振46例,全身乏力39例。均经外科手术及术后组织病理学检查证实为HCCA,术前及术中均未进行其他抗肿瘤治疗。术后均完成3年随访调查,随访终止时间为2017年5月。获得患者及其家属知情同意。排除未接受手术治疗、非原发性HCCA、合并其他恶性肿瘤者。
1.2 手术方法 术前行心电图和影像学检查,测定肝肾功能。行手术切除者67例,其中行根治性切除30例,姑息性切除(R1,R2)37例和行胆管引流术53例(内引流术30例,外引流术23例)。对Bismuth-CoretteⅠ型行肝外胆管切除、肝管空肠Roux-en-Y吻合术;对Ⅱ型行肝叶、肿瘤和肝外胆管切除术,左右肝管重建,并行肝管空肠Roux-en-Y吻合术;对Ⅲ型a者行肿瘤、右半肝和肝外胆管切除,左肝管空肠Roux-en-Y吻合术,对Ⅲb型行肿瘤、肝中央部和肝外胆管切除,右肝管空肠Roux-en-Y吻合术;对Ⅳ期者,行肿瘤、肝中央部和肝外胆管切除,左右肝管空肠Roux-en-Y吻合术。对肿瘤以上扩张胆管与空肠行Roux-en-Y吻合术和吻合内引流术30例,肿瘤未能切除而行T管外引流23例。
1.3 相关标准 参照Bismuth-Corette分型标准对HCCA肿瘤进行分型[5],即Ⅰ型:肿瘤位于肝总管,未侵犯汇合区;Ⅱ型:肿瘤侵犯肝总管或左右肝管汇合区;Ⅲ型:肿瘤侵犯肝总管、左右肝管汇合区,并已侵犯右肝管或左肝管;Ⅳ型:肿瘤侵犯肝总管,左右肝管汇合部,并侵犯左右肝管。参照国际抗癌协会(Union for International Cancer Control,UICC)通过的TNM标准进行临床分期[6],即T1:局限于胆管,可达肌层或纤维组织;T2:肿瘤超出胆管壁,达周围脂肪组织或侵犯邻近肝实质;T3:侵犯门静脉或肝动脉单侧分支;T4:侵犯门静脉或门静脉双侧分支,或侵犯肝总动脉或二级胆管。N0:无区域淋巴结转移;N1:区域淋巴结转移,包含肝动脉、门静脉、胆囊管、胆总管区域淋巴结;N2:淋巴结转移至腔静脉、主动脉、肠系膜上动脉或腹腔动脉。M0:无远处转移;M1:远处转移;M1a:远处转移局限于胸腔内;M1b:远处器官单发转移灶;M1c:多个或单个器官多处转移。肿瘤切除情况分级。R0:根治性切除;R1:镜下切缘阳性;R2:肉眼切缘阳性。
1.4 统计学方法 应用SPSS 19.0软件处理数据,计数资料以%表示,采用x2或fisher检验,计量资料以(±s)表示,采用 t检验,采用 Kaplan-Meier法计算生存率和生存期,采用Log-rank检验相关性,采用Cox回归分析影响预后的危险因素,以P<0.05为差异有统计学意义。
2 结果
2.1 典型病例介绍 患者男,72岁。因反复右上腹疼2月伴黄疸1周入院,CT平扫见肝左叶稍低密度灶,肝门部局部包块形成,病变沿胆管壁生长,局部节段胆管壁增厚,管腔狭窄。增强扫描见胆管环状强化(图1、图2)。行肝门胆管癌姑息性根治术、肝门空肠吻合术和空肠营养管植入术。组织病理学检查见肝门胆管中高分化性腺癌伴粘液腺癌,侵及胆管全层和神经。术后3个月行CT复查,见肿块和结节灶消失,恢复良好(图3、图4),血生化检查恢复正常。

图1 术前腹部CT表现

图2 术前腹部CT表现

图3 术后腹部CT表现
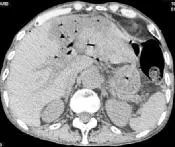
图4 术后腹部CT表现
2.2 HCCA患者总体生存情况 本组120例HCCA患者术后 1 a、2 a和 3 a生存率分别为 67.5%(81/120)、45.8%(55/120)和 25.0%(30/120),其中根治性切除患者生存率显著高于姑息性切除或胆管引流术患者,姑息性切除患者又显著高于胆管引流术患者(P<0.05,表 1)。
表1 不同治疗HCCA患者术后生存率(%)和生存时间(±s)比较
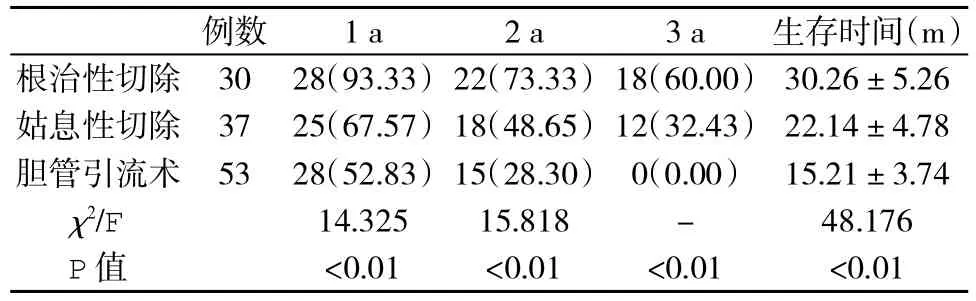
表1 不同治疗HCCA患者术后生存率(%)和生存时间(±s)比较
例数 1 a 2 a 3 a 生存时间(m)根治性切除 30 28(93.33) 22(73.33) 18(60.00) 30.26±5.26姑息性切除 37 25(67.57) 18(48.65) 12(32.43) 22.14±4.78胆管引流术 53 28(52.83)15(28.30) 0(0.00) 15.21±3.74 χ2/F 14.325 15.818 - 48.176 P值 <0.01 <0.01 <0.01 <0.01
2.2 不同临床和病理因素HCCA患者治疗后3 a生存率比较 根治性切除手术、切缘为R0、肿瘤高分化、TNM分期为T1/T2期、淋巴结转移为N0、无门静脉侵犯的HCCA患者3 a生存率显著升高(P<0.05,表 2)。
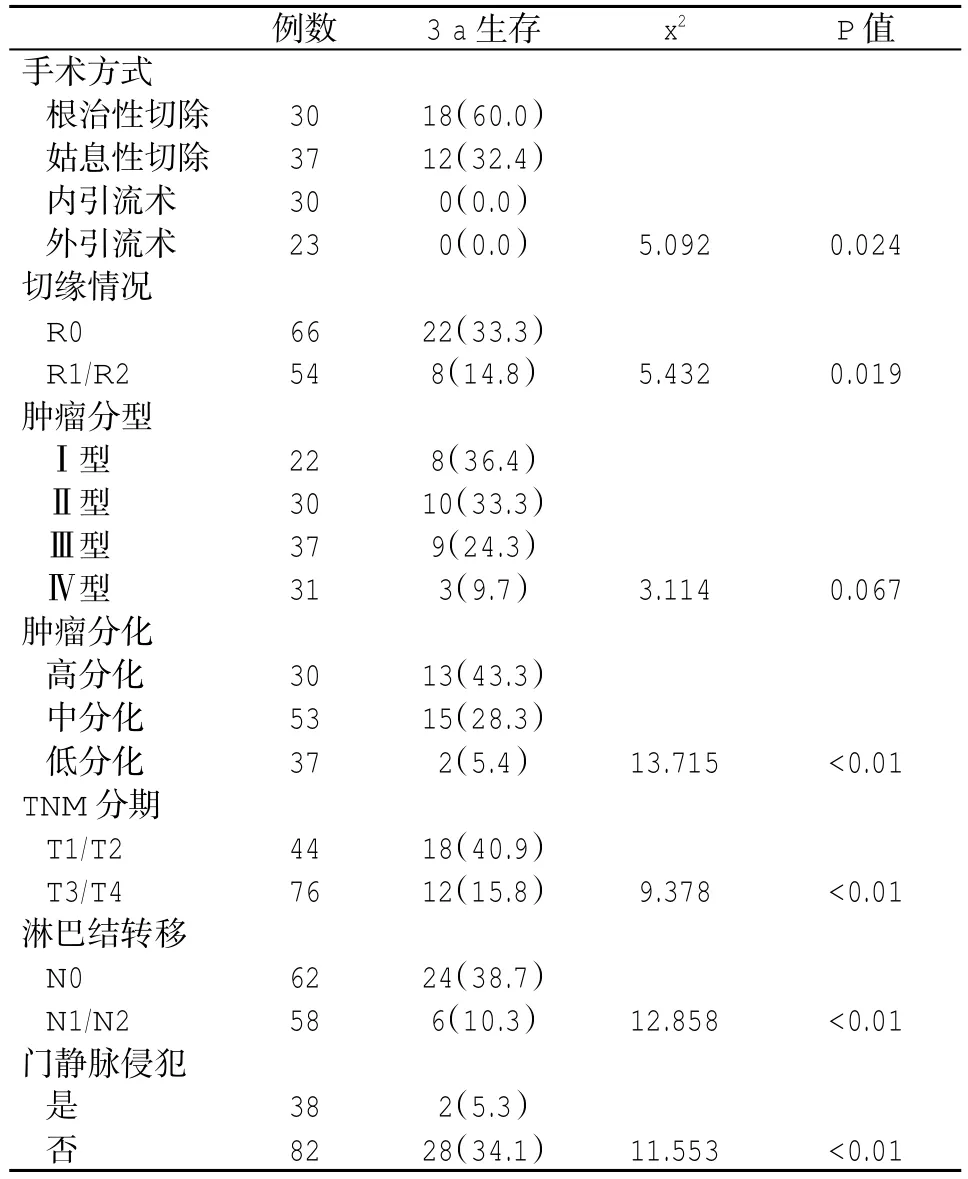
表2 不同临床和病理参数HCCA患者生存率(%)比较
2.3 各临床和病理参数对HCCA患者外科治疗后生存影响的COX多因素分析 纳入在单因素分析中有统计学意义的参数行COX多因素分析,其赋值见表3。经COX分析显示,手术方式、切缘情况、细胞分化程度、TNM分期、淋巴结转移和门静脉侵犯均为影响HCCA患者外科治疗后生存的独立危险因素(P<0.05,表 4)。

表3 临床和病理参数赋值表
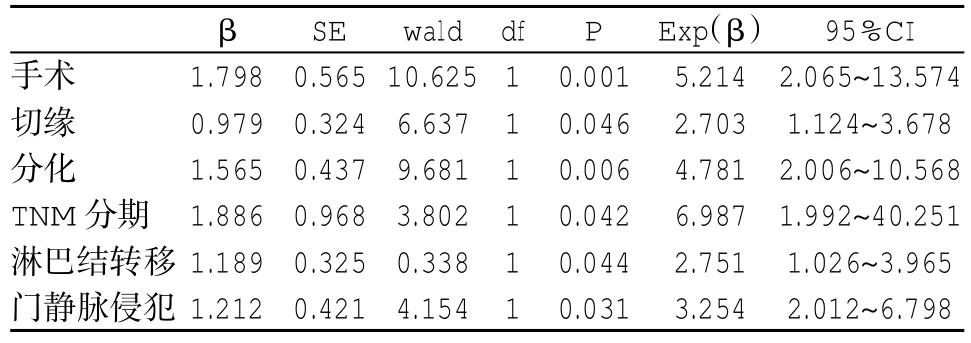
表4 影响HCCA患者外科治疗后生存的COX多因素分析
3 讨论
HCCA为发生于肝外胆管与肝脏连接部位的肿瘤,解剖位置复杂,易变异及侵犯附近重要血管组织,属常见难治性恶性肿瘤,好发于中老年群体[7]。HCCA症状出现得晚,肿瘤多呈浸润性生长,临床治疗困难,预后差[8,9]。研究发现,未能及时治疗的HCCA患者中位生存率仅在6个月左右,且放化疗及其他靶向药物辅助治疗对HCCA效果有限[10]。外科手术治疗仍为治疗HCCA的首选手段。有人对50例经外科手术治疗的HCCA患者进行随访调查发现,5 a生存率低于20%[11]。也有临床研究显示,经根治手术治疗的HCCA患者5 a生存率仅为14.9%[12],而明确影响HCCA患者预后的危险因素,则可为改善患者预后提供指导。
早期研究发现,肿瘤根治程度、门静脉浸润、淋巴结转移等均为影响HCCA患者预后的相关危险因素[13,14]。也有学者指出,超过60岁的HCCA患者预后较小于60岁患者差[15]。肿瘤生长和增殖情况均对HCCA患者的预后产生影响[16]。本研究分析了患者年龄、性别、手术方式、切缘情况、肿瘤分型、临床分期、病理分化程度、淋巴结转移、肿瘤浸润等因素作为研究变量,分析其对HCCA患者外科治疗后生存率的影响,结果发现,手术方式、切缘情况、分化程度、TNM分期、淋巴结转移、门静脉侵犯均为影响HCCA患者外科治疗后预后的独立危险因素,而年龄、性别和肿瘤分型等对患者预后均无明显的影响。一般行根治性手术切除治疗的HCCA患者3 a生存率较高,可能为根治性手术可实现R0切除,肿瘤切缘阳性率低,术后复发率低,肿瘤转移风险小。肿瘤分化程度则为肿瘤生长和增殖程度的反映[17],分化程度越低,肿瘤恶性程度越高,易侵犯十二指肠韧带神经、淋巴血管系统,近端可侵犯肝动脉、门静脉及肝实质,远处可转移至腹腔、胰周、腹主淋巴结,肿瘤侵袭程度高,预后通常较差[18,19]。
TNM分期为反映肿瘤侵犯深度、淋巴结转移及远处转移的主要系统。一般T分期越高的患者其肿瘤侵犯深度越高,常累及周围组织器官,手术根治效果差,切缘阳性率高,预后通常较差。此外,HCCA患者淋巴结转移特点表现为沿肝内外胆管及淋巴分布流向而发生转移[20-25]。同时,可沿十二指肠韧带内神经淋巴结间隙转移,且随淋巴结转移的增多,术中清扫淋巴结的难度逐渐增大。淋巴结转移患者术后复发和转移的风险大,是导致患者预后差的关键原因。因此,为避免阳性淋巴结残留,术中必须重视规范化淋巴结清扫,彻底清扫肝门部、胆总管、胰头、十二指肠、肠系膜动脉等区域淋巴结,必要时可行主动脉旁淋巴结清扫,以降低患者术后复发和转移风险,改善其预后。

