miR-1301在甲状腺乳头状癌中的表达变化及其临床意义*
乔德辉 季昳驰 周翔宇 周阳 杨辉 程炼
(西南医科大学附属医院甲状腺外科,四川 泸州 646000)
甲状腺癌是最常见的内分泌肿瘤,其中以甲状腺乳头状癌(Papillary thyroid cancer,PTC)最为常见(>80%)。尽管95%的PTC患者治疗后预后很好,但仍有部分患者预后较差[1-2]。目前诊断甲状腺癌金标准是细针穿刺活检(fine-needle aspiration biopsy; FNA)。然而FNA受肿瘤大小、位置和技术水平等影响,部分患者不能及时明确诊断和治疗[3]。PTC中最常见的BRAF基因突变尚不能作为其独立的结果预测因子[4]。因此,探寻PTC的早期诊断、术前风险评估和监测复发标志物具有重要意义。
miRNAs是一类非编码小RNA。研究发现,miRNAs与PTC发生、进展、预后等密切相关[5-6]。Borrelli等发现miRNAs与PTC的生长相关,可协助FNA诊断PTC[7]。Lee等发现miRNAs与PTC的进展及复发密切相关[8-9]。Sondermann等发现miR-9和miR-21可作为监测PTC复发的标志物[10]。本研究在TCGA数据库 (The Cancer Genome Atlas,http://cancergenome.nih.gov/)选取了可能在PTC中表达改变的miR-1301、miR-1976[11],通过RT-qPCR检测 miR-1301、miR-1976在癌旁正常组织、良性肿瘤组织、癌组织中的相对表达量,并分析其与PTC临床病理特点之间的关系,探讨其作为PTC诊断的生物标志物的可能性。
1 材料与方法
1.1临床样本选取 2015 年 8 月~ 2016 年 12 月于西南医科大学附属医院就诊并行手术治疗的甲状腺肿瘤患者共65 例,其中甲状腺乳头状癌 30例,男性 11例,女性19 例;年龄 19~ 71 岁,平均(42.14 ± 14.1)岁,TNM分期及ASA复发风险分层按照ATA(美国甲状腺协会)指南标准(2015)。良性肿瘤患者35例,年龄23~70岁,平均(40.14 ± 12.1)岁,见表1。 手术中留取离体肿瘤组织及距肿瘤>1cm非瘤组织于液氮中速冻,然后转入-80 ℃冰箱保存备用。所有肿瘤及邻近正常组织均由两名病理科医生确认。该研究经西南医科大学附属医院伦理委员会批准, 并取得所有患者的知情同意。
1.2试剂细胞裂解液Trizol reagent(BD公司,美国)。miRNA提取试剂盒miRNeasy Mini Kit、反转录试剂盒miScript II RT kit、实时荧光定量试剂盒miScript SYBR Green PCR kit(QIAGEN 公司,德国)。引物has-miRNA-1301 (RiboBio 公司)。实时荧光定量 PCR 仪( ABI 公司,美国)。
1.3检测方法
1.3.1RNA提取、反转录取100 mg组织在液氮中研磨成粉末,加入1ml Trizol充分混合,静置5min。分别按照miRNeasy Mini Kit、miScript II RT kit试剂盒说明书进行RNA提取及逆转录操作。使用Nanodrop 2000 (NanoDrop, Thermo Fisher Scientific, MA, USA)检测总RNA浓度及纯度(A260/A280在 1.8~2.0,RNA 浓度在 300~500 ng/μl之间),琼脂凝胶电泳成像检测RNA完整性;反转录为cDNA后放入20℃冰箱保存。

表1 65例甲状腺肿瘤患者的临床病理资料(n)Table 1 Clinicopathological data of 65 patients with thyroid tumor
注:cPTC,经典型乳头状瘤;Fv-PTC,滤泡性乳头状癌,Tg:甲状腺球蛋白
1.3.2实时荧光定量PCR(RT-qPCR)将cDNA用无酶水稀释11倍后,充分混匀用于荧光定量 PCR。取2μl稀释后的cDNA,加入10μlMix,2μl miRNA-1301引物,2μul下游引物,4μl无酶水。反应步骤:95 ℃ 15 min,然后 95 ℃ 15 s,55 ℃ 30 s,70 ℃ 30 s,共 40 个循环。每个样本进行3次重复,以 U6作为内参,2-ΔΔCt法计算相对表达量,最终结果表示为mean±SE。
1.3.3生物信息学分析通过Targetscan (http://www.targetscan.org/vert-50/)预测miR-1301靶基因,GEPIA (http://gepia.cancerpku.cn/index.html)分析TCGA及GTEx数据库中甲状腺癌基因表达变化。
1.4统计学分析采用 SPSS 19.0软件进行统计学分析。用K-S检验测试数据是否符合正态分布,如果数据符合正态分布,则使用独立样本t检验;如果数据不符合正态分布,则使用秩和检验,P<0.05为差异有统计学意义。受试者工作特征曲线(Receiver operating characteristic; ROC曲线)用于分析miRNAs对肿瘤的诊断价值。ROC曲线下面积以及最佳截断值使用MedCalc软件分析。
2 结果
2.1总RNA质量结果显示,28s rRNA 和 18s rRNA 条带清晰,28 s条带的亮度约为 18s的两倍,见图1。所有样本RNA浓度、纯度以及完整性均符合实验要求。

图1 组织总RNA琼脂糖浆电泳图Figure 1 Agarose gel electrophoresis of the total RNA
2.2miR-1301、miR-1976在瘤旁正常甲状腺组织、良性肿瘤组织和乳头状癌组织中的表达RT-qPCR结果显示,与肿瘤旁正常甲状腺组织比较,miR-1301在良性肿瘤组织、乳头状癌组织中表达均明显降低(P<0.05),且在乳头状癌组织中降低更为明显(P<0.05)。miR-1976在肿瘤组织表达无明显变化(P<0.05),见图2、3,提示miR-1301对甲状腺肿瘤的良、恶性辨别具有重要意义。

图2miR-1301在瘤旁正常组织、良性肿瘤组织和乳头状癌组织中的表达
Figure2miR-1301expressionlevelsinnormal,benignandPTCtissues
注:Normal:瘤旁正常组织;Benign:良性肿瘤组织;PTC:乳头状癌组织;与瘤旁正常组织比较,①P<0.05,②P<0.01;与良性肿瘤组织比较,③P<0.05

图3miR-1976在瘤旁正常组织、良性肿瘤组织和乳头状癌组织中的表达
Figure3miR-1976expressionlevelsinnormal,benignandPTCtissues
注:Normal:瘤旁正常组织;Benign:良性肿瘤组织;PTC:乳头状癌组织
2.3miR-1301在PTC中表达变化与肿瘤原发灶情况(T)、淋巴结转移情况(N)的相关性结果表明,miR-1301与PTC临床病理分级T、N密切相关。“T”“N”分级越高,miR-1301相对表达量越低(P=0.005或P=0.045),见图4、5。同时miR-1301的表达与肿瘤类型、ASA分级、性别、甲状腺球蛋白(Tg)、多中心性等之间虽有差异,但无统计学意义(P>0.05),提示miR-1301可能为评估乳头状癌进展情况的潜在分子标志物。
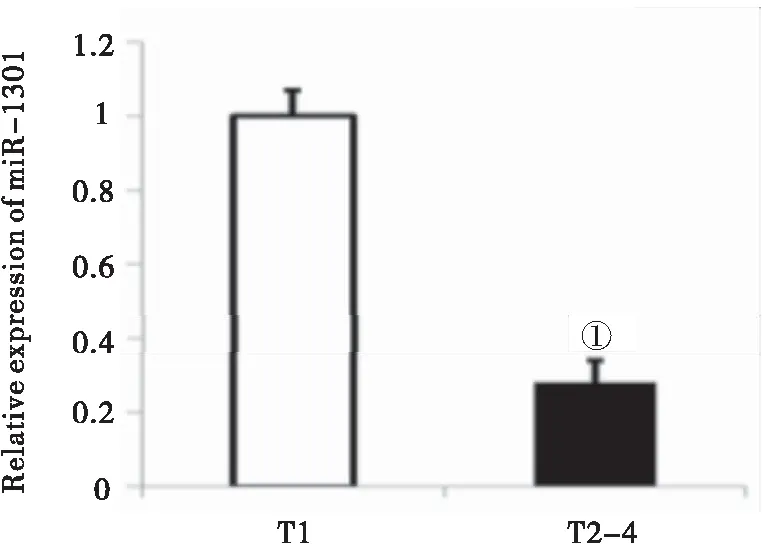
图4 miR-1301在不同T分级中的表达Figure 4 miR-1301 expression profiles in difference T stages注:与T1比较,①P<0.01

图5 miR-1301在不同N分级中的表达Figure 5 miR-1301 expression profiles in difference N stage注:与No比较,①P<0.05
2.4miR-1301对PTC的诊断价值通过绘制ROC曲线分析发现,曲线下面积(AUC)分别为0.690和0.774;最佳 ΔCT截断值分别为-12.84、-12.89;对诊断良性肿瘤组织敏感性为40%,特异性为91%;诊断癌组织的敏感性为50%,特异性为90%,见图6,提示miR-1301可用于对甲状腺肿瘤的辅助诊断。

图6 miR-1301受试者工作特征曲线(ROC)Figure 6 miR-1301 receiver operating characteristic (ROC) curves注:sensitivity:敏感性;specificity:特异性
2.5miR-1301对PTC发生、进展的作用Targetscan预测发现,CLDN1、TRPC5为miR-1301的两个靶基因, GEPIA分析TCGA及GTEx数据库中甲状腺癌基因表达,发现 CLDN1、TRPC5在甲状腺癌中表达升高,见图7。本研究结果表明,CLDN1、TRPC5与肿瘤发生发展密切相关。由此推测,miR-1301可能通过对CLDN1、TRPC5的负性调控作用,参与PTC的多个生物学过程。
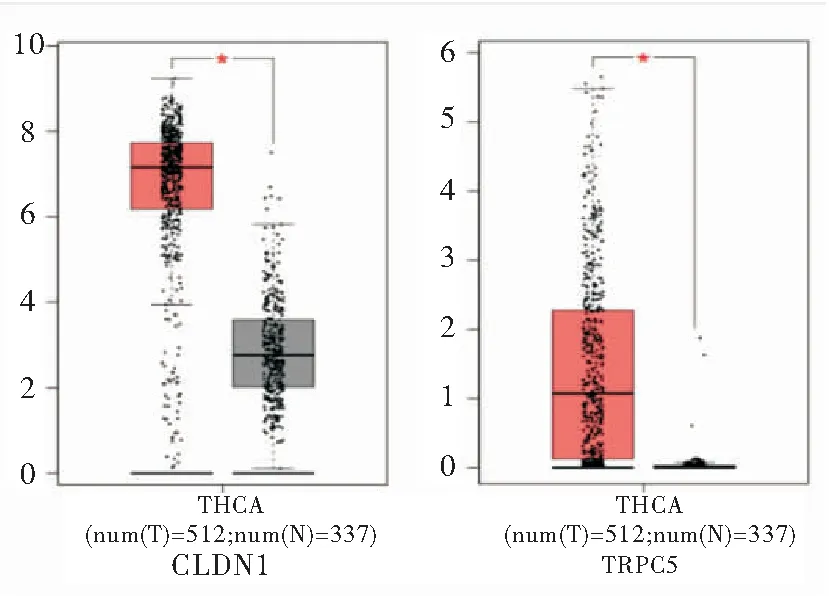
图7GEPIA分析TCGA和GTE数据库中CLDN1和TRPC5在甲状腺癌中表达情况
Figure7CLDN1andTRPC5expressionprofilesinthePTCfromTCGAandGTExdatabyGEPIA
注:通过GEPIA 分析TCGA 和GTEx数据库中512例甲状腺癌组织、337例正常组织中基因表达变化,结果显示,红色方框代表癌组织表达情况(①P<0.05)
3 讨论
本研究通过参考相关文献,从TCGA中选取在甲状腺乳头状癌中表达可能变化的miR-1301、miR-1976,利用RT-qPCR检测他们在PTC癌旁正常组织和良性肿瘤组织、乳头状癌组织中的表达水平,发现miRNA-1301在良、恶性肿瘤组织中表达均明显低于肿瘤旁正常组织,且在恶性肿瘤组织中降低更为明显(P<0.05),而miR-1976在肿瘤组织中表达无明显变化(P<0.05)。临床相关性分析表明,miRNA-1301与PTC临床病理特点密切相关。miRNA-1301在T2-T4中降低较T1更为明显; miRNA-1301在发生淋巴结转移N1较未发生淋巴结转移T0降低更为明显。预测miRNA-1301靶基因推测其在乳头状癌的多个生物学过程中可能通过对其靶基因CLDN1、TRPC5的负性调控,抑制PTC的发生与进展。ROC曲线结果表明,miRNA-1301对PTC具有一定诊断价值,其对乳头状癌的诊断效能为0.774,可作为诊断PTC的潜在分子标志物。
甲状腺乳头状癌起源于甲状腺滤泡细胞。近几十年来,发病率明显升高[12]。虽然大部分PTC患者经积极治疗后,远期生存率很好,但仍有部分PTC患者早期即发生淋巴结转移及远处转移而表现出较差预后[12]。目前超声引导下FNA是诊断甲状腺结节良恶性的金标准[12]。但FNA的诊断准确性受多方面限制[14]。虽然联合肿瘤相关变异基因的检测使FNA的诊断准确率有所提高,但仍有部分患者结节性质不能明确。这部分患者往往不能获得适当的治疗,心理负担较重[9]。
miRNA在多种肿瘤中通过多种途径参与多个生物学过程,从而调控肿瘤发生与进展[15]。He 等[16]于2005首次提出miRNAs在PTC中表达异常,通过联合5个miRNAs成功准确诊断12对恶性肿瘤组织。此后,许多研究相继表明,miRNAs与PTC的发生、发展密切相关。Qiu等[17]发现miR-613可通过调控SphK2抑制PTC肿瘤细胞的生长、迁移及侵袭,为PTC治疗提供了新方向。Minna等[18]发现miR-199a-3p在PTC中具有与巨噬细胞类似作用,可抑制肿瘤进展。Zhang等[19]通过分析甲状腺癌中miRNA表达图谱发现多个miRNAs在PTC组织中表达异常,且与PTC病理分期相关,提示miRNAs在PTC的发生发展过程中起重要作用。
目前研究表明,miRNA-1301表达变化与多种肿瘤相关。Krishnan 等[20]研究发现,miRNA-1301可能参与了头颈部鳞状细胞癌的发病与进展。Bi等[21]报道miRNA-1301可负性调控PPP2R2C,促进前列腺癌细胞增殖。Bai[22]和Zhi等[23]发现,miRNA-1301在胶质瘤组织中表达降低,与胶质瘤多样化进展及差预后明显相关,体外实验证实miRNA-1301可通过负性调控N-Ras抑制胶质瘤细胞增殖。Wang等[24]研究表明,miRNA-1301通过UBE4B-p53通路对多种人肿瘤细胞的迁移及侵袭产生抑制作用。但miRNA-1301在PTC中表达情况尚未见报道。我们的研究结果表明,miRNA-1301在PTC癌细胞中表达降低。临床相关性分析表明,miRNA-1301在PTC中表达与肿瘤原发灶情况“T”及淋巴结转移情况“N”分级明显相关。“T”“N”分级越高,miRNA-1301表达降低更为明显。我们还分析了miRNA-1301与肿瘤亚型、ASA分级、性别、甲状腺球蛋白(Tg)、多中心性等的关系,但未发现具有统计学意义的差异,这可能是样本量不够的原因所致,将来还需进一步扩大样本进行深入分析。miR-1976与肿瘤的关系鲜有报道。Chen等[25]研究发现,miR-1976在非小细胞肺癌中作为抑癌基因表达减低,并且和肿瘤TNM分期以及经手术治疗后患者生存率相关。高表达的miR-1976可通过对其靶基因PLCE1的表达抑制,从而抑制非小细胞肺癌的生长与远处转移。我们分别在肿瘤旁正常组织、良性肿瘤组织、乳头状癌组织中检测了miR-1976的表达,遗憾的是,我们未能发现具有统计学意义的差异,这可能提示miR-1976未参加PTC发生、进展的生物学过程。我们此次样本量有限,以后我们将进一步加大样本量进行验证。
ROC曲线用于评估分子标志物的诊断效能早有报道。Li等[26]通过ROC曲线分析表明,miR-25-3p及miR-451a对PTC诊断效能分别为0.835及0.857,特异性分别为68.8% 及66.7%,敏感性为92.8% 及88.9%。Kitano等[27]绘制ROC曲线表明,miR-7与miR-126对甲状腺癌的诊断价值分别为0.806及0.767。我们绘制ROC曲线发现,miRNA-1301诊断PTC癌组织的敏感性为50%,特异性为90%,AUC为0.774,提示miRNA-1301可作为分子标志物为PTC诊断提供参考。
miRNA通过与靶基因的结合发挥其生物学功能。我们通过Targetscan预测miR-1301靶基因,结合GEPIA选出在PTC中表达上调的基因CLDN1、TRPC5[28]。CLDN1是一种跨膜蛋白,与细胞间紧密连接,密切相关,参与多种肿瘤细胞的迁移与侵袭[29]。Mahati等[30]报道,CLDN1在肝癌中表达增高,可促进肿瘤细胞增殖与迁移。Huang等[31]研究发现,CLDN1在胃癌中可通过抑制失巢凋亡,促进肿瘤细胞的增殖与迁移。有研究报道,CLDN1在PTC中表达增高与肿瘤发生侵袭与远处转移密切相关[32]。TRPC5是瞬时受体电位通道5,为一种受体激活的非选择性钙通道。Chen等[32]报道TRPC5在结肠癌中通过调控HIF-1α/Twist通路促进肿瘤转移。Wang等[33]发现,TRPC5在乳腺癌患者外周血中高表达与化疗药物耐药相关,可作为辅助检测患者耐药的分子标志物,提示CLDN1、TRPC5与肿瘤的增殖、凋亡、迁移、远处转移和肿瘤耐药等密切相关。由此我们推测,在PTC中miRNA-1301通过对CLDN1、TRPC5的靶向调控作用,抑制PTC的发生、发展。
4 结论
本实验通过在TCGA数据库中选取并通过RT-qPCR验证发现,miRNA-1301在PTC癌组织中表达降低,且与PTC临床病理“T”“N”分级密切相关,对PTC具有一定诊断价值。同时miRNA-1301可能通过对其靶基因CLDN1、TRPC5的负性调控作用,参与了甲状腺乳头状癌的多个生物学过程,抑制PTC的发生与进展。miRNA-1301可作为PTC诊断、术前风险评估和预后分析的潜在分子标志物。

