高原不同人群体外红细胞无氧酵解能力的差异*
吴显熠 张中伟 吴小东 冯露 邹茜婷 杨超
(1.四川大学华西医院西藏驻成都办事处分院重症医学科,四川 成都 610000;2.四川大学华西医院重症医学科,四川 成都 610000)
高原红细胞增多症( high altitude polycythemia,HAPC ) 是一种高原低氧环境下所致的慢性疾病,主要表现为红细胞与血红蛋白代偿性增多,引起血液黏稠度增高,全血比黏度增高,进而引起循环阻力增高,加重心脏负荷和组织缺氧,产生一系列症状和体征的临床综合征[1]。HAPC 的基本治疗包括吸氧、 抗凝、血液稀释等[2]。有研究表明,血液稀释疗法是降低红细胞数量、控制血液粘滞度的有效手段[3]。基本方法是输入适当的各种稀释液或放血,以期使血液浓度变稀,血细胞比容、胞粘稠度降低,从而改善增加局部血液流量,起到治疗疾病的治疗方法[4]。但HAPC患者放血疗法的血液在临床上常废弃,未再利用。随着我国医疗卫生事业的不断发展,临床用血逐年上升,血液供应日益紧张[5]。现献血人群主要来自健康人群。若此类患者可作为无偿献血者,一定程度上可达到治疗目的,也可增加血液资源。
红细胞在体内主要功能是运输O2和CO2,而无氧酵解是红细胞维持自身结构和功能稳定的能量来源。成熟红细胞因没有线粒体,几乎完全依赖血浆中摄取葡萄糖,经一系列酶促反应,完成无氧酵解,产生ATP,其中LDH是无氧酵解中一种主要的催化酶。ATP是红细胞能量代谢的重要产物,具有维持红细胞膜ATP酶运转、启动糖酵解通路、维持红细胞正常的双凹形态以及红细胞的血液流变学特性等多项功能[6]。本文通过采集不同Hb水平的高原人群组与平原正常人群组血液制成红细胞悬液,在血液体外保存条件下对悬浮红细胞无氧酵解能力相关指标进行对比检测分析,初步探讨其高原人群和平原人群体外保存悬浮红细胞无氧酵解能力的不同,从代谢水平分析红细胞功能差异。
1 材料与方法
1.1仪器与试剂BC-5800 血细胞计数仪(深圳迈瑞);HITACHI全自动生化分析仪(日本日立仪器有限公司);葡萄糖试剂盒(批号:20130405137,上海荣盛生物药业有限公司);邻联甲苯胺(批号:20100609), ATP检测试剂盒。
1.2实验分组收集西藏自治区驻成都办事处医院2016年12月5日~2017年1月16日期间受检的30例健康男性志愿者,年龄18~65岁。根据Hb水平和居住地区将志愿者分为A、B、C 3组,A组(高原红细胞增多组):世居高原(海拔≥3500m),Hb≥180g/L;B组(高原正常人群组):世居高原(海拔≥3500m),Hb120~160g/L;C组(平原正常人群组):世居平原地区(海拔<2500m),Hb120~160g/L。
1.3悬浮红细胞制备采集志愿者全血200ml,同时另外采集10ml全血作为待检样本立即进行检测。将全血标本离心后去除大部分血浆,每份全血离心后加50ml MAP红细胞保存液,制备得到悬浮红细胞。再将每份悬浮红细胞分装到4个50ml转移袋中,于-40℃冰箱保存,于第 1、7、21、35d分别取样检测。
1.4检测指标及方法
1.4.1血常规于采血当天取全血及于保存第1、7、21、35d取悬浮红细2ml用血细胞计数仪测定红细胞计数、Hb浓度、HCT、红细胞平均体积(MCV)。
1.4.2葡萄糖、LDH将悬浮红细胞于3000g离心5 min取上清,然后用电解质检测仪直接检测。
1.4.3ATP 分别在洗涤前/后取样,每例10μl,加入裂解液1000μl,用微量移液器轻轻洗吸6次混匀,得到样品裂解液(样1),用生理盐水稀释400倍(样2)待测,全部操作在冰浴进行,取ATP检测试剂及ATP检测试剂稀释液,按1:9(V/V)混合,室温放置3~5min,取100μl样2加入96孔板,立即上机检测。ATP检测试剂盒(上海碧云天生物技术有限公司;编号:S0026)

2 结果
2.13组人群初始状态外周全血常规检测结果A组红细胞计数、Hb、HCT明显高于C组(P<0.05),而B、C两组间则差异无统计学意义(P>0.05),见表1。
注:与C组比较,t分别为6.833、7.749、7.890,①P<0.05
2.23组人群ATP检测结果A组与C组相比,仅在保存第7d时差异有统计学意义(P<0.05),表现为A组的ATP含量低于C组;B、C两组间差异无统计学意义(P>0.05)。随保存时间延长,A组的ATP含量变化表现为先增高后降低(P<0.05),B、C两组的ATP含量变化差异则无统计学意义(P>0.05),见表2。
2.33组人群LDH检测结果在整个保存过程中,随保存时间延长,LDH均逐渐增多(P<0.05);A、B组与C组LDH相比,差异均无统计学意义(P>0.05),见表3。
2.43组人群葡萄糖检测结果与C组比较,A组仅在第21d时葡萄糖浓度降低,差异有统计学意义(P<0.05);B、C两组间差异无统计学意义(P>0.05)。随保存时间延长,3组葡萄糖均逐步降低,差异均有统计学意义(P<0.05),见表4。
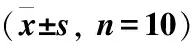
表2 3组人群ATP含量的变化情况Table 2 The change of ATP content in the 3 groups
注:与C组比较,t=-3.809,①P<0.05;与A组第1、7、21、35d比较,F=5.356,②均P<0.05
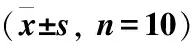
表3 3组人群LDH浓度变化情况Table 3 The change of LDH concentration in the 3 groups
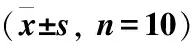
表4 3组人群葡萄糖浓度的变化情况Table 4 The change of glucose concentration in the 3 groups
注:与C组比较,t为-2.443,①P<0.05;第1、7、21、35d比较, F分别为32.599、42.579、22.353,均P<0.05
3 讨论
临床应用成分输血始于20世纪60年代,到20世纪80年代末各发达国家成分输血比例均在95%以上[7]。悬浮红细胞作为成分血一个主要的血液组分,在临床上得到了广泛的应用。现代医疗中, 临床输注全血或红细胞的主要目的是增加患者循环血量, 提高血液携氧能力[8]。但研究表明,血液在保存过程中, 红细胞会发生一系列结构和功能的改变, 从而影响血液质量和临床输血效果[9]。近期研究表明,在储存过程中,对血液新陈代谢指标更好的掌握,对于改善输血策略非常重要,可能有助于临床医生在获得对代谢的快速、有用的评估[10]。而无氧酵解相关指标反应的红细胞能量代谢水平,可从一个方面分析红细胞在体外保存中的质量。
ATP是无氧酵解的能源物质,是红细胞内多种生化反应正常进行所必须的。多项研究表明 ,ATP对于维持红细胞膜钠泵的运转,红细胞内钙环境的恒定,膜脂质的更新,红细胞的正常形态和功能,延长红细胞的保存期,以及提高输注后红细胞的存活率等均有举足轻重的作用[11-13],且当红细胞 ATP 的含量<1.5μmol/L时,输血后24h红细胞的存活率显著下降[14]。在本研究中,高原红细胞增多组人群ATP较既往研究[7,9,11,15]不同之处在于,呈现出先上升后下降趋势,而平原、高原健康组内人群均为逐渐下降。而高原红细胞增多组较平原健康人群组仅在第7d时出现统计学差异。
LDH是参与无氧酵解过程中催化乳酸和丙酮酸之间氧化还原反应重要的酶类,提示无氧酵解的潜力[16-17]。本研究结果显示,高原红细胞增多人群、高原健康人群较平原健康人群在血液保存期间LDH变化均一致,表现为随时间延长逐渐增加,但差异无统计学意义(P>0.05),提示无氧酵解反应均逐渐增强。
葡萄糖为无氧酵解的底物,是提供红细胞能量的主要来源。随着保存时间延长,高原红细胞增多组和平原健康人群组之间,仅在第21d时出现葡萄糖下降,差异存在统计学意义(P<0.05)。3组人群葡萄糖浓度总体呈现下降趋势,提示红细胞在离体过程中不断消耗能量物质,以维持自身结构和功能。
4 结论
本研究结果表明,高原不同Hb水平人群与平原正常人群的悬浮红细胞体外保存,3组人群的红细胞无氧酵解相关指标无显著性差异,大致符合既往研究[11-21],反应了不同HB人群红细胞无氧代谢水平的一致性,为高原红细胞增多症患者作为献血者提供一部分依据,但尚需更大样本量体外研究及临床实验进一步论证。

